第17章 胺
17胺

2. 1HNMR
RNH HCN H
δH :0.5~5(加入D2O后消失) α-H :2.7~3.1
H C C N H β-H :1.1~1.7 3. MS
南京大学基础学科教育学院
6
南京大学化学化工学院
1
基础有机化学
17.3 胺的化学性质
一、碱性
+ + .. H Cl
+ - NaOH
RNH2
RNH3 Cl
0~5OC
芳香重氮 b.芳 盐只能在 香族 低温下(5oc 重氮 以下)存 盐在 在,否则 有机 分解出N2 合成
中有
与脂肪2O胺类似
出现黄 广泛 色,油状 应用
N(CH3)2 HNO2 ON
N(CH3)2
绿色晶体 对位占据,则进邻位
物 出现绿色 晶体
南京大学基础学科教育学院
南京大学化学化工学院
基础有机化学
RR’R2N 叔胺
N H
H
RR’R2R3N+X季铵盐
南京大学基础学科教育学院
2
南京大学化学化工学院
基础有机化学
三、胺的命名
•简单的胺:用“胺”作官能团,把它所含烃基的名称和数目写 在前面,按简单到复杂先后列出,后面加上“胺”字。
N CH3
甲(基)乙(基)环丙胺
CH2CH3
•复杂的胺:作为烃类的衍生物来命名
基础有机化学
第十七章 胺
南京大学基础学科教育学院
1
南京大学化学化工学院
基础有机化学
17.1 胺的结构和命名 一、胺的结构
氨和胺分子呈角锥型,N:sp3 杂化 苯胺:N:接近sp3 杂化,形成p-π共轭体系
N
H
17章胺

(CH3)2CH CH2
N-甲基-N-乙基异丁胺
Organic Chem
2、比较复杂的胺,把胺 基当作取代基,烃基作为母体来命名
CH3CH CH2CH(CH3)2 NH2 2-氨基-4-甲基戊烷 CH3 N+ CH3 OHC2H5
CH3 N(C2H5)2 CH3CH2CH CHCH3 2-(N,N-二乙胺基)-3-甲基戊烷 氢氧化三甲乙胺
-H
CH3CH
CH2 H2O CH3CHCH3 OH CH3CHCH3
-H
Organic Chem
邻氨基醇的亚硝酸重排
OH NH2 O R C R' C R R'
HNO2 R'
R
C R
C R'
类似Pinacol重排
-H OH R C R C R' R' R OH R' C C R R'
Organic Chem
:N
O: ..
Organic Chem
伯胺与 HNO2 的反应的机理(重氮化反应)
NaNO2, HCl
H
RNH2
R N NCl
H O H N O + H2O NO
R+ + Cl- +N2
机理经过 碳正离子
H O NO +
H O H
NO
N RNH2
O RNH2 H NO
-H RNH NO
H RN
O N
CN,Ph-Cl等)测定确按此顺序) • 从溶剂效应看:N上取代基多,与H2O形成氢键少,与H+结合 形成铵离子后,溶剂化稳定作用弱,碱性减弱。
Organic Chem
第17章 胺

强。
(1)(2)芳胺的亲电取代反应1. 卤化NH2(CH3CO)2O CH3 NHCOCH3 Br2, CH3CO2H NHCOCH3 BrCH3Br2, H2O NH2 Br BrCH3 1) HCl, H2O Δ 2) NaOH NH2 BrCH3CH32. 硝化:NH2 (CH3CO)2ONHCOCH3 HNO3NHCOCH3 NO2CH(CH3)2CH(CH3)2CH(CH3)2 KOH, EtOHΔNH2 NO23. 弗瑞德-克莱福特反应 (Friedel-Crafts)NH2 C2H5 CH3COCl, AlCl3CH(CH3)2NH2 C2H5 (CH3CO)2ONHCOCH3 C2H5 CH3COCl, AlCl3NHCOCH3 C2H5COCH3胺的制备一氨或胺的烷基化(Hofmann烷基化)SN2RNH2 + RNH2X CH2R'RNHRNH2 + R'CH2XRNH+ + RNH3X-CH2R'+ CH R' RN + RNH3X2 CH2R'+ R'CH2X+ - RNH2 RNHX (CH2R')2CH2R'RN CH2R' + R'CH2X CH2R'+ RN(CH2R)3X-RI > RBr > RCl > RF1º RX 或 2º RX, 3º RX易发生消除反应9混合产物,合成伯胺时, NH3需要过量. 9合成季铵盐, RX 需要过量.氨或胺的烷基化的具体应用1 工业制备(结合高效率的分馏塔) 2 利用电子效应和原料配比的调节,可以制备1°胺PhCH2NH2 + CH3I C2H5OH PhCH2NHCH3 + PhCH2N(CH3)2 + PhCH2N(CH3)3I 15% 45% 10%+PhCH2Cl + NH3C2H5OHPhCH2NH2 + NH4Cl 50%40倍CH3CHCOOH + NH3 BrCH3CHCOONH3 + 65 % -70%CH3OH+ HBr1mol70molCH2NH2 + 3CH3ICH2N(CH3)3I 相转移催化剂+****卤代芳烃的氨解BrNaNH2 NH3 ( l )反应历程为:NH2Br H苯炔的结构NH2-*NH3NH2 * +*NH2·sp2杂化轨道·CF3 ClNaNH2 NH3 ( l )反应历程为:CF3 NH2CF3 Cl NaNH2NH3 ( l )CF3NH2-CF3· ·-CF3 NH2 +稳定· ·-NH2CF3· ·-CF3NH3NH2+ NH- 2 NH2二 盖布瑞尔(S.Gabriel)合成法利用邻苯二甲酰亚胺的烷基化来制备一级胺,称为盖 布瑞尔合成法。
第17章胺--

(2)霍夫曼消除的规律
霍夫曼规则:四级铵碱热解时,若有两种β-H可以发 生消除。总是优先消去取代较少的碳上的β-H。
ββ 2CH3CH2CH2CHCH3 OH-
N+(CH3)3
C2H5OK 130oC C2H5OH -2H+
2CH3CH2CH2CH=CH2 + CH3CH2CH=CHCH3 + 2N(CH3)3
17.4.2 胺与酸的成盐反应
胺有碱性,遇酸能形成盐。
RNH2 + CH3COOH CH3NH2 + HCl
CH3COO- +NH3R
+
CH3 NH3 Cl-
罗氏化学 出品
胺与无机酸成盐反应的应用
1. 用于分离提纯
HCl RNH2 不溶于水
RN+ H3Cl- NaOH RNH2 + H2O + NaCl
罗氏化学 出品
CF3 NH2
CF3 2,5-bis(trifluoromethyl)benzenamine
2,5-双(三氟甲基)苯胺
罗氏化学 出品
3. 胺盐和四级铵化合物的命名:
CH3NH2 HCl methylamine hydrochloride
甲胺盐酸盐
CH3CH2NH2 HOAc ethylamine acetate
N,4-二甲基-N-乙基苯胺
CH3 N(C2H5)2 CH3CH2CH CHCH3
N,N- diethyl-3-methyl-2-pentanamine N,N-二乙基-3-甲基-2-戊胺
NH2既可以作为取代基命名,也可以作为主官能团命名, 作为主官能团命名时,选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位。
第十七章--胺

第三节 胺的物性
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键;
胺的反应
1. 胺的成盐反应 四级铵盐的应用 2. 四级铵碱和霍夫曼消除反应 3. 胺的酰化和兴斯堡反应 4. 胺的氧化和科普消除 5. 胺与亚硝酸的反应
CH3
Cl
NO2
NO2
pkb 8.50 8.90 9.30 10.02 13.0 13.82
二、胺与酸的成盐反应
胺有碱性,遇酸能形成盐。 RNH2 + CH3COOH
成盐反应的应用
CH3COO- +NH3R
1. 用于分离提纯
HCl RNH2
不溶于水
RN+ H3C-l NaOH RNH2 + H2O + NaCl
效的p-π共轭。
如果N原子上连有三个不同基团的化合物存在 着对映体,理论上可以分离出左旋体和右旋体。
C2H5 N H
CH3
N CH3 H
C2H5
但难以拆分,其原因在于简单胺的构型转化只需
25kJ/mol的能量,该转化经历一个平面过渡态而迅速
转化,过渡态的氮原子呈sp2杂化。
sp3
C2H5 N H
CH3
第八节 胺与亚硝酸的反应
一、 脂肪胺、芳香胺与亚硝酸的反应 ------重氮化反应
重氮化试剂: 亚硝酸(实际用的是NaNO2 +HCl or
NaNO2 + H2SO4)用量大于 1 mol
1. 伯胺与亚硝酸的反应
脂肪胺: 生成的重氮正离子不稳定,分解后生成碳正离子
第17章胺-精品文档
C H (C H 3 ) 2
C H (C H 3 ) 2
(2)化学还原
CH3 CH3 NO2 Fe E tO H , H C l h e at NH2 NH2
Sn、Fe/HCl
NO2
选择性还原试剂
硫化铵
硫氢化钠
硫化钠
还原剂计量: 二硝基化合物选择还原
p775
4. 腈及其它含氮化合物的还原
R C l + aC N N N i / H 2 R C H N H R C N 2 2 or L i A l H 4
O N N O
+ R N H + H O 2 2
O
氨基酸合成 p773
3. 硝基化合物还原
(1)催化氢化:污染少,逐步替代化学方法。中性条件下进行,
适于对含有对酸、碱敏感的官能团化合物进行还原
CH3 CH3 NO2 H 2, N i h e at , p re s s u re NH2
制备伯胺
Ni, Pd, Pt
5. 还原氨化——醛(酮)在氨存在下催化氢化生成 胺的反应(reductive amination)
RC O H (R') + NH 3 Ni/H 2 RC H NH 2 H (R')
NH RC H (R')
中间体
R
R ' C N R '' R '''
醛(酮)与伯胺的反应通过半缩胺 (亚胺)中间体发生,与仲胺的反应 则通过半缩胺(亚胺离子)
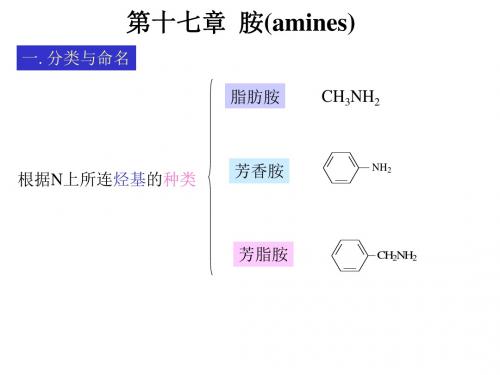
第十七章 胺(amines)
一. 分类与命名
脂肪胺 CH3NH2
根据N上所连烃基的种类
芳香胺
NH2
王积涛著《有机化学》第二版课后习题答案--第十七章 胺

O N-CH3 O LiAlH4 N-CH3
=
CO2H 解: (1) CO2H
CH2
PCl3
CO2Cl CO2Cl
NH3CH3
=
(2)
C CH2 O CH2C-NHCH2
O NH2OH
CH2 C CH2 H3O+ O CH2COH
H+ N-OH △ Beckmann重排
O (3) (C6H5)2CHCOH + NH3
Cl (1) Cl + Na2CO3 (H2O) NO2 NO2 OH Cl
NO2 (2)
CH3
CH3 Zn/OH-
H3C
H3C H+ H N 2
CH3 NH2
NH-NH
NO2 Cl (3) NO2 Cl NH4SH Cl
NH2
NO2 Cl
宁夏大学化学化工学院
6
-
(4) CH3CH2NO2 + CH3CH2CHO
宁夏大学化学化工学院
CH3 Zn NaOH NH NH
CH3 H+ △
20
CH3 H2N CH3
H3PO2
CH3 NH2
NaNO3 HCl,0℃-5℃
CH3 Cl-N N+
CH3 N+ NCl-
CH3
H2O,△
10 . 完成下列转化:
CO2H (1) CO2H N-CH3
(2)(C6H5CH2)2C=O
R-C-N - O-C-R` O R-NH-C-O-H
-R`CO-
O=C=NR O
+ OH -H2O
-
R-NH + C=O +H2O - OH
第十七章 胺和酰胺教材
N+ ≡N Cl-
氯化重氮苯 (重氮盐)
D H2O
OH + N2
+ HCl
仲胺与亚硝酸的反应 生成黄色油状物或黄色固体N-亚硝基胺。
(CH3)2NH + HNO2 ——> (CH3)2N-NO + H2O
N-亚硝基二甲胺(90%)
CH3 N—H
NaNO2 + HCl
(2) 酰化反应和磺酰化反应 伯胺、仲胺易与酰氯、酸酐或羧酸等酰化剂作
用,氨基中的氢原子被酰基取代,生成N-取代酰 胺。叔胺N上没有氢原子,不发生酰化 。
-CH2CH2NH2 +
吡啶 -CO-Cl
-CH2CH2NHCO-
89%~98%
-CO-Cl + HN
NaOH
——>
-CO— N
酰化剂 R3N ——— O
CONH
H2C
CO
CONH
丙二酰脲存在酮式-烯醇式的互变异构现
象,其烯醇式呈酸性所以又称巴比妥酸。
O NH O NH
O
HO N
OH
N HO
R—NH—R’
R’’ R—N—R’
胺类广泛存在于生物界,具有极重要的生 理作用。绝大多数药物都含有胺的官能团—— 氨基。蛋白质、核酸、许多激素、抗生素和生 物碱,都含有氨基,是胺的复杂衍生物,掌握 胺的性质是研究这些复杂天然产物的基础。
一、胺的分类
(1) 根据NH3分子中H被烃基取代的数目将胺分为:
N-甲基乙酰胺
O
CH3
CH3
C
N C2H5
N-甲基-N-乙基乙酰胺
二、酰胺的物理性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环状胺通常按含氮杂环化合物的氢化衍生物命名。例如:
N H 四氢吡咯
N H 六氢吡啶
§ 17.2 一元胺的物理性质
化合物 熔点/℃ –93 –81 –83 –101 –50 –86 –104 –68 –96 –42 –40 –61 –59 –42 –115 –94 –117 –115 –6 –57 2 54 126 沸点/℃ –7 17 49 33 77.8 68 63 45 134 53 7 37 56 111 84 159 56 3.5 156 90 185 184 196 194 302 365
N-甲基-N-乙基异丁胺
在取代基前加N-(读作氮位),是为了明确取代基所在的位置。
结构比较复杂的胺,可以作为烃类的氨基衍生物命名。
(CH3)2CHCH2CHCH3 NH2 4-甲基-2-氨基戊烷 CH3CH2CHCH3 N(CH2CH3)2 2-(二乙胺基)-丁烷
季铵盐的命名与铵盐相似。
(CH3)4N+Cl氯化四甲铵 C6H5CH2N+C2H5)3Cl 氯化三乙基苄基铵
而芳香族胺的碱性则比氨弱。
17.3.1 脂肪胺
但仍然是弱碱
乙胺的碱性比氨强,这是因为C-N键是极化的,乙胺有偶极矩,方
向是由乙基指向氮原子。在乙胺的共轭酸——乙基铵离子中,氮原子上的正 电荷在偶极的影响下,部分分散到乙基中,使乙基铵离子比铵离子更稳定:
NH3 CH3CH2NH2 H NH3
+ +
H NH2CH2CH3
:
N H
N CH3 CH3 H
HNH=113°
苯胺分子中N原子更接近于平面结构,其杂化状态介于 sp3和sp2杂化之 间,更接近于sp2。这样才能使孤对电子对所在的轨道具有更多的p成分, 与苯环中π电子轨道重叠更多,使N-C具有部分双键的性质,因此,N-C 的键长比甲胺中的N-C键短。苯胺的结构用共振式表示更为恰当:
芳香族胺为高沸点的液体或低熔点固体,有特殊气息,在水里的溶解度 比相应的酚略低。 邻硝基苯胺的熔、沸点(71.5℃,284℃)都比间位(114℃,306℃)
和对位异构体(148℃,332℃)低,这是 因为邻位异构体能生成分
子内氢键,而间位和对位则生成分子间氢键。分子间氢键在晶体熔
化时部分断裂,而在气相中差不多完全断裂,所以,间位和对位异构体在 相变过程中需要的能量高于邻位异构体。
铵离子中四个氢原子都被烃基取代,则生成季铵盐:
NH4+Cl 铵盐 RR1R2R3N+Cl 季铵盐
许多胺类化合物具有生物活性。
§17.1 胺的结构和命名
17.1.1 胺的结构
氨分子中氮原子位于三个氢原子所在平面的上方,整个分子呈角锥形, 其键长键角为:
:
N
H
H H
N H 100.8 pm HNH=107.3°
第十七章 胺
学习要求
1.掌握胺的分类、命名和制法。
2.熟练掌握胺的性质及胺的碱性强弱次序,理解影响胺 的碱性强弱的因素。
3.掌握区别伯、仲、叔胺的方法及氨基保护在有机合成
中的应用。 4.掌握伯、仲、叔胺的制备方法、原理及反应涉及的机 理。 5.掌握重氮盐的反应和偶联反应在有机合成中的应用。 6.了解季铵盐、季铵碱的性质和应用。 7.Cope消去和Hofmann消去反应。
基取代的铵离子中有三个能参与氢键生成的氢,二烃基取代的铵离子和三 烃基取代的铵离子中各有两个和一个能参与氢键形成的氢,因此,生成氢 键使胺的碱性增强的顺序是: 伯胺 > 仲胺 > 叔胺 正好与结构因素使碱性增强的次序: 伯胺<仲胺<叔胺
相反,这两种因素协同作用,对于不同的烃基可以得出不同的
次序。
在氯仿、乙腈、氯苯等非质子溶剂中测定胺的碱性强弱,可以避免生成 氢键的干扰。例如:在氯苯中测定的丁胺,二丁胺和三丁胺的碱性强弱次 序为: CH3CH2CH2CH2NH2 < (CH3CH2CH2CH2)2NH < (CH3CH2CH2CH2)3N
直链伯胺和在α-碳上没有支链,在m/z=30处有强峰。芳香族胺和低级 脂肪胺常有M–1峰。
§17.3 胺的碱性
胺分子中氮原子上的孤电子对使它能接受质子而显碱性,进 攻缺电子中心而显亲核性;芳胺中氮原子上的孤对电子对与苯 环中的π电子共轭,使芳环高度活化,环上的亲电取代反应更 容易进行,但其碱性和亲核性相应减弱。
10.67 10.73 10.99 11.00
10.09 9.80 10.65 10.85 9.34 4.85 4.85 5.06 0.8
由于氮的电负性小于氧,N-H键的极化程度小于O-H键,因而氢键N -H·· ·也比O-H·· · ·弱。因此,伯胺的沸点高于分子量接近的烷烃而低于醇。 · 位阻能妨碍氢键的生成,伯胺分子间生成的氢键比仲胺强,叔胺分子间不 能生成氢键,所以,碳原子数相同的胺中,伯胺的沸点最高,仲胺次之, 叔胺最低。 所有胺,即使叔胺,分子中氮原子上的孤对电子能接受质子溶剂如水或 醇分子羟基上的氢,生成分子间氢键,因此,含有6~7个碳原子的低级胺 能溶于水,胺在水中的溶解度略大于相应的醇,高级胺与烷烃相似,不溶 于水。
NH3 < C2H5NH2 < (C2H5)3N < (C2H5)2NH pKa 9.25 10.80 10.85 11.09
与在气相中测定的次序不同,说明溶剂对碱性强弱有一定的影响。
一种简化的解释为:烃基取代的铵离子在水溶液中能与水生成氢键:
H
+
OH2 OH2 OH2
CH3CH2
N H H
氢键的生成使铵离子的稳定性增加,即使胺的碱性增强。一烃
:
N H H H CH3
:
H
苯胺分子中键长,键角的数值为:
N H H N H N C 100 pm 140 pm
苯环平面与NH2三个原子所在平面间的夹角为142.5°,而甲胺分子中的N -C键与NH2所在平面之间的夹角为125°:
H 142.5° H N N H H CH3
125°
说明苯胺分子中N原子更接近于平面结构,其杂化状态介于sp3 和sp2杂化之间,更接近于sp2。
本节先讨论胺的碱性。 胺同氨相似,其碱性比水强,胺的水溶液呈碱性反应,与酸反应生成烃 基取代的铵盐,铵盐用碱处理又释出胺。
RNH2 + H2O RNH2 + HCl RNH3Cl + NaOH
+ + RNH3 + -OH + RNH3Cl
RNH2 + NaCl + H2O
通常根据胺的共轭酸-烃基取代铵离为:
:
:
N CH3 H H
:
N C N H
147.4 pm 101.1 pm
∠HNC=112.9° ∠HNH=105.9°
CH3 CH3
:
N H
N C N H
147 pm 100.8 pm
∠CNC=108°
因此,可以认为氨和胺分子中氮原子为sp3杂化,四个sp3杂化轨道中, 有一个为电子对所占据,其他三个sp3轨道则与氢或碳原子生成σ键。
H N
+
N O 邻硝基苯胺
H O-
O N O
H N H
O N O
H N H
O N O
H N H
对硝基苯胺
芳胺毒性很大,液体芳胺还能透过皮肤而被吸收,虽然其蒸气压不大, 长期呼吸后也会中毒。空气中含1×10-6的苯胺,连续呼吸12小时就会产生 中毒的症状。苯胺、α-和β-萘胺都有致癌作用。
17.2.2 偶极矩
第十七章 胺
胺是氨的有机衍生物。氨分子中一个、两个或三个氢原子被 烃基取代衍生的化合物分别称为伯胺、仲胺和叔胺:
NH3 氨 RNH2 伯胺 RR1NH 仲胺 RR1R2N 叔胺
伯胺和仲胺分别含有氨基(―NH2 )和亚氨基(―NH―)。
胺可以根据烃基不同分为脂肪族胺和芳香胺。根据分子中含胺基的数 目,胺还可以分为一元胺和多元胺。
脂肪胺的偶极矩比相应的醇小;芳胺的偶极矩与脂肪胺相近,但方向相 反:
CH3CH2OH 1.7D CH3CH2NH2 1.2D NH2 1.3D
这是由取代苯胺的偶极矩推测的。例如,对三氟甲基苯胺的偶极矩与苯胺 和三氟甲苯的偶极矩之和相近,三氟甲基是吸电子的取代基,因此,氨基 应当是给电子的取代基:
NH2 NH2
因此,乙基铵离子的酸性比铵离子弱,而乙胺的碱性比氨强。二乙基铵 离子和三乙基铵离子中,氮原子上的正电荷可以分散到两个和三个乙基上, 比乙基铵离子更稳定。在气相中测定的碱性强弱次序为:
NH3 < C2H5NH2 < (C2H5)2NH < (C2H5)3N
即氮原子上乙基数目越多碱性越强。 在水溶液中测定的碱性强弱次序为:
pKa(共轭酸) 水,25℃ 10.66 10.88 10.85 10.60 10.68
一 些 一 元 胺 的 物 理 性 质
甲胺 乙胺 丙胺 异丙胺 丁胺 异丁胺 仲丁胺 叔丁胺 环己胺 烯丙基胺 二甲胺 甲乙胺 二乙胺 二丙胺 二异丙胺 二丁胺 三甲胺 三乙胺 三丙胺 三丁胺 苄胺 苯胺 N-甲基苯胺 N,N-二甲基苯胺 二苯胺 三苯胺
RNH3 + H2O
+
Ka
RNH2 + H3O
+
[RNH2 ][H3O ] Ka [RNH3 ]
在稀溶液中水的浓度接近于恒定,故未包括在公式中。
胺的碱性越强,越容易接受质子,它的共轭酸越不容易失去 质子,即共轭酸的酸性越弱而pKa值越大。因此,胺的碱性越强,
其共轭酸的pKa值越大。一些胺的共轭酸的pKa值见表17.1。 氨的共轭酸——铵离子的pKa值为9.25,因此,脂肪胺的碱性比氨强,
17.2.5 质谱
脂肪族的M+ 很弱,分子量较大的开链胺则观察不到M+ ,环胺和芳胺的 M+ 很强。含奇数氮原子的化合物,其分子量为奇数(氮规则) 。 而含偶数氮原子的化合物及其他化合物的分子量均为偶数。 脂肪族胺最重要的裂解方式为:
