化学计量地相关计算
化学计量与化学反应的计算

化学计量与化学反应的计算化学计量是研究化学反应中各种物质之间的数量关系的分支学科。
化学反应的计算是根据反应的化学方程式,通过计算出反应物与生成物的数量关系,从而确定反应物与生成物的摩尔比例和化学计量关系。
本文将介绍一些常见的化学计量和化学反应的计算方法。
一、化学计量问题化学计量问题主要涉及到反应物的物质量、物质的摩尔数和物质的体积等方面的计算。
常见的化学计量问题包括:1. 摩尔质量计算:根据元素的原子质量和分子式,计算出物质的摩尔质量。
摩尔质量的计算公式为:摩尔质量 = 原子质量1 ×原子个数1 + 原子质量2 ×原子个数2 + ... + 原子质量n ×原子个数n。
2. 摩尔比例计算:根据化学方程式,计算反应物与生成物之间的摩尔比例。
摩尔比例可以通过化学方程式中的系数来确定,系数表示了反应物与生成物之间的物质的摩尔比例关系。
3. 反应物的量与物质量关系计算:根据已知的反应物的物质量,通过化学方程式和摩尔质量的计算,可以确定反应物的摩尔数。
摩尔数可以与化学方程式中的系数进行比较,从而得到反应物的摩尔比例关系。
4. 体积与摩尔数关系计算:根据气体的理想气体状态方程和摩尔体积的概念,可以将气体的体积与其摩尔数之间建立数学关系。
根据气体体积和摩尔体积之间的关系,可以计算气体的摩尔数和摩尔比例。
二、化学反应计算方法在化学反应中,反应物的量与生成物的量之间存在一定的摩尔比例关系。
根据这个关系,可以通过已知物质量和化学方程式中的摩尔比例关系,计算出生成物的摩尔数。
化学反应的计算方法包括:1. 已知反应物的物质量,求生成物的物质量:根据已知反应物的物质量和反应物与生成物的摩尔比例关系,可以计算出生成物的物质量。
计算公式为:生成物的物质量 = 已知反应物的物质量 ×生成物的摩尔数 / 反应物的摩尔数。
2. 已知反应物的物质量,求生成物的摩尔数:根据已知反应物的摩尔质量和反应物与生成物的摩尔比例关系,可以计算出生成物的摩尔数。
2020届高三化学题型强化训练——化学计量的相关计算

2020届高三化学题型强化训练——化学计量的相关计算1 / 252020届届届届届届届届届届届——届届届届届届届届届一、单选题(本大题共20小题,共40分)1. 标准状况下,将VLA 气体(摩尔质量为M g/mol)溶于0.1L 水中,所得溶液密度为ρg/mL ,则此溶液物质的量浓度为( )A. VρMV+2240 mol/LB. 1000VρMV+2240 mol/LC. 100VρMV+2240 mol/LD. 1000+VρMMV+2240 mol/L2. 在200mL 含Mg 2+、Al 3+、NH 4+、H +、Cl −等离子的溶液中,逐滴加入4mol/L 的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述正确的是( )A. 原溶液中n(Mg 2+):n(Al 3+)=10:1B. 原溶液中的c(H +)=0.8mol/LC. x 与y 的差值为0.01molD. 原溶液中c(Cl −)=0.66mol/L3. 往含0.2mol NaOH 和0.1mol Ba(OH)2的溶液中持续稳定地通入CO 2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO 2气体的体积关系正确的图象是(气体的溶解忽略不计)( )A. B.C. D.4. 1.52g铜镁合金完全溶解于50mL密度为1.40g⋅mL−1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol⋅L−1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是()A. 该合金中铜与镁的物质的量之比是1:2B. 该浓硝酸中HNO3的物质的量浓度是14.0mol⋅L−1C. NO2和N2O4的混合气体中,NO2的体积分数是80%D. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL5.将一定量Mg、Al合金溶于1mol⋅L−1的HCl溶液中,进而向所得溶液中滴加1mol⋅L−1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下。
化学计量在方程式中的计算
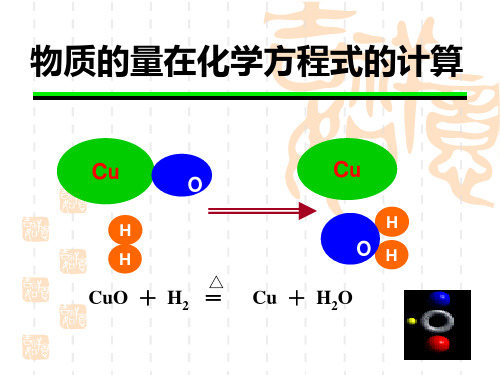
物质的量在化学方程式的计算
Cu
O
H
H △
CuO + H2 =
Cu
H
OH Cu + H2O
回忆以物质的量为核心的计算公式 V(气体)
÷Vm ×Vm
N ÷NA n ×M
×NA
÷M
m
÷V(溶液) ×V(溶液)
C
方程式中化学计量数与物质的量的关系
MnO2+4HCl==MnCl2+ Cl2 化学计量数 1 : 4 : 1 : 1 : 2 +2H2O
一题多变
1、完全中和0.1 mol NaOH,所需H2SO4 的质量是多少?
2、将8.1g铝与足量的氢氧化钠反应, 计算生成氢气 ___ L,需要氢氧化钠 __ mol。
已知:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑
综合计算
某盐酸的 =1.18g/cm3,HCl的质量分
数为36.5%。求①该盐酸物质的量浓度是 多少?②200mL该盐酸与过量铁屑充分反 应,生成 H2的体积(标况状况下)是多少? 若反应后溶液体积变化忽略不计则FeCl2 物质的量浓度是多少?有多少克FeCl2?
能生成氢气___L(标准状况)。盐酸的物 质的量浓度为___。
Zn + 2HCl = ZnCl2 + H2↑
1
2
1
n(Zn)
n(HCl)
n(H2)
化学方程式计算的步骤
设 设所求物质的物质的量n 写 写出相关的化学方程式
在化学式下面标出化学计量数及所 标 求物质的物质的量 列 列出比例式 解 根据比例式求n,再求V、C、m 答 简明地写出答案
粒子数N之比 1 : 4 : 1 : 1 : 2 扩大NA倍 1NA : 4NA : 1NA : 1NA : 2NA
化学计量的基本原则和方法

化学计量的基本原则和方法化学计量学是化学领域中研究物质之间量的关系和化学反应中物质比例的科学。
化学计量的基本原则和方法是化学实验和理论研究的基础,掌握这些原则和方法对于学习化学具有重要意义。
1.摩尔概念:物质的量的基本单位是摩尔,简称mol。
1摩尔物质含有阿伏伽德罗常数(约为6.022×10^23)个粒子(原子、分子、离子等)。
2.原子量:原子量是元素原子质量的相对值,以碳-12原子质量的1/12作为标准。
原子量是确定化合物化学式的基础。
3.相对分子质量:相对分子质量是分子中各个原子相对原子质量的总和。
它用于表示分子的质量大小,也是确定化合物化学式的重要依据。
4.化学方程式:化学方程式是用化学符号和数字表示反应物和生成物之间的化学反应关系。
化学方程式遵循质量守恒定律,即反应物的总质量等于生成物的总质量。
5.化学计量数:化学计量数是化学方程式中反应物和生成物的系数,表示它们在反应中的物质的量比例。
化学计量数根据实验数据确定,是进行化学计算的基础。
6.物质的量浓度:物质的量浓度是表示溶液中溶质物质的量与溶液体积的比值,常用单位是mol/L。
物质的量浓度用于描述溶液的浓度大小。
7.质量分数:质量分数是溶液中溶质质量与溶液总质量的比值,无单位。
质量分数用于表示溶液的组成和浓度。
8.摩尔质量:摩尔质量是1摩尔物质的质量,单位是g/mol。
摩尔质量与相对分子质量在数值上相等,但单位不同。
9.化学计算:化学计算是根据化学方程式和化学计量数进行物质的量之间的换算。
化学计算方法包括交叉相乘法、比例计算法等。
10.物质的量浓度计算:物质的量浓度计算是根据溶液中溶质物质的量和溶液体积求算物质的量浓度。
计算方法包括直接法和间接法。
11.质量分数计算:质量分数计算是根据溶液中溶质质量和溶液总质量求算质量分数。
计算方法包括直接法和间接法。
12.化学方程式的配平:化学方程式的配平是根据化学方程式中反应物和生成物的化学计量数,通过调整系数使方程式两边原子数目相等。
化学计量的相关计算

化学计量的相关计算化学计量是研究化学反应中物质的质量关系的学科。
它涉及到对化学方程式的解读和化学反应的质量关系进行计算。
化学计量的相关计算包括化学方程式的平衡计算、反应物的摩尔关系计算以及反应的产物计算等。
一、化学方程式的平衡计算化学方程式是化学反应的表达式,它描述了反应物和产物之间的定量关系。
化学方程式的平衡计算是指根据化学方程式所给出的反应物和产物的化学计量关系,推算出化学反应中各物质的质量关系。
平衡计算的关键在于利用化学方程式中的化学计量关系来推导出化学反应中反应物和产物的摩尔比例关系。
化学方程式平衡计算的具体步骤如下:1.根据化学方程式列出各物质的摩尔数。
2.根据反应物和产物的摩尔数,计算出物质的质量。
3.判断反应物和产物中哪些物质的量较少,以确定限量反应物。
4.根据限量反应物的摩尔数,计算出非限量反应物和产物的摩尔数。
5.根据非限量反应物和产物的摩尔数,计算出非限量反应物和产物的质量。
二、反应物的摩尔关系计算反应物的摩尔关系计算是指根据给定的反应物的质量,计算出其他反应物和产物的摩尔量。
反应物的摩尔关系计算主要包括以下几种类型的问题。
1.已知反应物的质量,求其他反应物的摩尔数。
例如:已知铁和硫的质量,求生成亚硫酸亚铁的摩尔数。
解题步骤:1.计算铁和硫的摩尔数。
2.根据化学方程式中所示的化学计量关系,计算出亚硫酸亚铁的摩尔数。
2.已知反应物的梅尔数,求其他反应物的质量。
例如:已知氢气和氧气的摩尔数,求生成水的质量。
解题步骤:1.根据化学方程式中所示的化学计量关系,计算出水的摩尔数。
2.根据水的摩尔数和相应的摩尔质量,计算出水的质量。
三、反应的产物计算反应的产物计算是指根据给定的反应物的质量,计算出反应生成物的质量。
反应的产物计算同样需要根据化学方程式中所示的化学计量关系来计算。
反应的产物计算包括以下几种类型的问题。
1.已知反应物的质量,求其中一产物的摩尔数。
例如:已知氯化铵的质量,求生成氨气的摩尔数。
化学计量问题的解题公式和计算

单击添加标题
计算公式: Kc=([C]^m×[D]^n)/([A] ^p×[B]^q),其中C、D、 A、B分别代表不同物质的浓 度,m、n、p、q分别代表
它们的化学计量数。
单击添加标题
注意事项:化学平衡常数只 受温度影响,与反应物和生 成物的浓度无关。在计算时 需要注意单位的统一和平衡
06 化 学 计 量 问 题 的 发 展趋势和展望
Part One
单击添加章节标题
Part Two
化学计量问题的基 本概念
化学计量数的定义
化学计量数:表示反应物和生成物之间物 质的量比例的系数
化学计量数与化学方程式的关联:化学计 量数是化学方程式中各物质的化学式前的 数字
化学计量数的意义:表示反应中各物质之 间的定量关系,是计算反应物和生成物的 物质的量、质量、气体体积等的基础
物料守恒的应用
定义:物料守恒是指化学反应前后,物质的质量和物质的量保持不变。
应用场景:在化学计量问题中,物料守恒可以用于解决各种问题,如化学反应平衡、 化学反应速率等。
解题公式:利用物料守恒,可以推导出许多有用的解题公式,如质量守恒、物质的量 守恒等。
计算方法:通过物料守恒,可以简化计算过程,快速得到答案。
化学计量问题的解 题公式
质量守恒定律的应用
质量守恒定律的定义:化学反应前后,物质的质量总和保持不变。
应用场景:计算化学反应中各物质的质量关系,确定反应物和生成物的质 量比。
计算公式:利用质量守恒定律,可以推导出各种化学计量问题的计算公式, 如化学方程式的配平、反应物和生成物的质量计算等。
注意事项:在应用质量守恒定律时,需要注意物质的质量单位和化学计量 数的一致性,以及反应前后物质的质量变化情况。
计量点对应浓度计算公式

计量点对应浓度计算公式在化学分析中,常常需要计算溶液中某种物质的浓度,这就需要用到计量点对应浓度计算公式。
计量点对应浓度计算公式是一种用来计算溶液中物质浓度的公式,它能够帮助化学分析师准确地计算出溶液中物质的浓度,从而为化学实验提供准确的数据支持。
计量点对应浓度计算公式是根据滴定实验的结果得出的。
滴定实验是一种常用的化学分析方法,通过在滴定过程中加入一种已知浓度的试剂来确定待测物质的浓度。
在滴定实验中,通常会选择一种适当的指示剂来指示滴定终点,当滴定终点达到时,根据滴定过程中所耗试剂的量,就可以计算出待测物质的浓度。
在滴定实验中,计量点是指滴定终点的位置。
计量点对应浓度计算公式是根据滴定过程中所耗试剂的量和计量点的位置来推导出来的。
计量点对应浓度计算公式的一般形式为:C = (N V) / m。
其中,C表示溶液中物质的浓度,N表示滴定试剂的标准浓度,V表示滴定试剂的体积,m表示待测物质的摩尔数。
根据这个公式,可以得出在滴定实验中,通过测量滴定试剂的体积和知道滴定试剂的标准浓度,就可以计算出溶液中物质的浓度。
这种计量点对应浓度计算公式的应用范围非常广泛,不仅可以用于滴定实验,还可以用于其他化学分析方法中。
在实际应用中,计量点对应浓度计算公式的使用需要注意一些问题。
首先,需要选择适当的滴定试剂和指示剂,以确保滴定实验的准确性和可靠性。
其次,需要准确测量滴定试剂的体积,避免误差的产生。
最后,需要根据实际情况调整计量点对应浓度计算公式的参数,以确保计算结果的准确性。
除了计量点对应浓度计算公式,化学分析中还有其他一些计算公式用于计算溶液中物质的浓度。
例如,质量平衡法、电化学法等都是常用的计算溶液中物质浓度的方法。
这些方法各有特点,可以根据实际情况选择合适的方法进行浓度计算。
总之,计量点对应浓度计算公式是化学分析中常用的一种计算方法,它能够帮助化学分析师准确地计算出溶液中物质的浓度。
在实际应用中,需要注意选择适当的滴定试剂和指示剂,准确测量试剂的体积,以及根据实际情况调整计量点对应浓度计算公式的参数,从而确保计算结果的准确性。
化学计量方程式

化学计量方程式化学计量是指在化学反应中,研究反应物和产物之间的质量关系的方法。
化学计量法则是化学基础中最重要的概念之一,它们为化学反应的预测和计算提供了基础。
在本文中,我们将深入探讨化学计量方程式。
化学计量方程式通常用于描述化学反应中的原子和分子之间的相对数量关系。
它们示范了反应涉及到的各种化学物质的组成和数量。
例如,氢气和氧气反应生成水,化学计量方程式是:2H2 + O2 → 2H2O这个方程式表明,在这个化学反应中,两个氢气分子与一个氧气分子组合成两个水分子。
当研究化学反应时,重要的是要识别反应物和产物。
反应物是化学反应中开始时存在的物质,而产物是经过化学反应生成的物质。
前面提到的方程式中,氢气和氧气是反应物,而水是产物。
对于任何给定的化学反应,都可以编写一个化学计量方程式,以显示反应物和产物之间的化学组成和比例关系。
这些方程式非常重要,因为它们允许化学家从实验数据中推断反应中的未知物质的比例和质量。
化学计量方程式可用于测量反应物的摩尔量,这是研究化学反应时常用的一种计量单位。
摩尔量是一种测量物质数量的单位,定义为一个物质中包含的粒子数。
在化学计量方程式中,括号里的数字表示各种化学物质的摩尔量。
例如,我们可以使用这个方程式来计算氢气和氧气反应生成水时产生的热量:2H2 + O2 → 2H2O + 572kJ这个方程式满足热力学中的定律,即反应产生的热量等于反应物中各元素放出或吸收的的热量的代数和。
化学计量方程式提供了化学反应中组成和摩尔量之间相对应的数学关系。
它们提供了化学家对化学物质数量和组成的清晰理解。
总之,化学计量方程式是化学基础中重要的概念之一。
它们为化学反应的预测和计算提供了基础,也为我们理解反应过程提供了深入的视角和指导意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学计量的相关计算物质的量摩尔质量一、物质的量(一)物质的量(n)1.定义:表示含有一定数目微观粒子的集合体的一个物理量2.单位: 摩尔(简称“摩”),符号:mol▲把含有6.02×1023个粒子的任何粒子集体计量定为1摩尔▲物质的量与微观粒子数之间成正比:n1/n2=N1/N23.使用物质的量应注意事项:①物质的量这四个字是一个整体,是专用名词,不得简化或增添任何字。
②物质的量只能描述分子、原子、离子、中子、质子等微观粒子,不能描述宏观物质,用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。
如:1 mol H、1 mol H+、 1 mol H2 ,不能用“1 mol 氢”这样含糊无意义的表示。
③物质的量计量的是粒子的集合体,不是单个粒子,物质的量的数值可以是整数,也可以是小数。
(二)阿伏加德罗常数(N A)事实证明,1mol粒子集体所含的粒子数与0.012g 12C所含的碳原子数相同,约为6.02 ×1023。
国际上把1mol任何粒子集体所含的粒子数叫做阿伏伽德罗常数。
(12C是指原子核内有6个质子和6个中子的碳原子。
)1.阿伏加德罗常数(1)含义:科学上规定把0.012kg12C中所含有的碳原子数叫做阿伏加德罗常数。
(2)符号:N A(3)单位:mol-1(4)近似值:6.02×1023mol-1(5)物质的量(n),阿伏加德罗常数(N A)与粒子数(N)三者之间关系:n=N/NA。
(三)物质的量、阿伏加德罗常数与粒子数间的关系粒子数(N)、物质的量(n)和质量(m)之间的关系:【例题】在0.5 mol O2中含有的氧原子数目是多少?随堂练习:1.1 mol C中约含有个碳原子2.0.3 mol H2SO4含有个硫酸分子3.1.204 ×1024个H2O2分子的物质的量为。
4.1 mol Na2CO3中约含有__ _molNa+、_ __molCO32-离子,共含有离子的个数为__________个。
二、摩尔质量1.定义:单位物质的量的物质所具有的质量2.符号:符号:M单位:g/mol或g·mol-13.含义:某物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量。
4.公式:m (g) =n (mol) ·M(g/mol)n=m/M自我检测1.下列说法中正确的是()A .摩尔是表示原子、分子、离子的个数的单位B .摩尔既表示物质中所含的离子数,又表示物质质量的单位C .摩尔是物质的量的单位,用“mol ”表示D .摩尔质量的单位是克/摩,用“g/mol ”表示 2.下列物质中所含氢原子数最多的是( ) A.2molCH 4 B.3molNH 3 C.4molH 2O D.6molHCl 3.下列说法中正确的是( )A .2molCH 4的质量和氧气的摩尔质量都是32g B.1mol 任何气体中都含有相同的原子数 C .1molNaCl 含有6.02×1023个微粒 D.H 3PO 4的摩尔质量是98.0g/mol 4.O 2、SO 2、SO 3三者的质量之比为2:4:5,它们的物质的量之比为( ) A.2:4:5 B.1:2:3 C.1:1:1 D.2:2:35.N A 表示阿伏加德罗常数,下列说法正确的是( ) A. N A 个氢气分子与N A 个氧气分子的质量比为1:1 B. N A 个水分子的质量与水的摩尔质量在数值上相等 C.16g 氧气中含有的氧气分子数为N A D.44gCO 2与28gCO 所含有的分子数均为N A 6.下列说法中不正确的是( )A .Na 的摩尔质量为23g B. Na 的摩尔质量为23C .Na 的摩尔质量为23g·mol —1 D. Na 的摩尔质量为2.3×10—2 kg·mol —1 7.含有不同氧原子数的两种物质是( )A.质量比为2:1的SO 2和O 2B.9g 水和22gCO 2C.12gNO 和9.8gH 2SO 4D.物质的量相同的H 2SO 4和H 3PO 4 8. 49g H 2SO 4的物质的量是 。
1.5molH 2SO 4的质量是 ,其中含有 molH ,含有 gO 。
9.0.8molCO 2和0.8molCO 中含有碳原子的物质的量之比为 ,含有氧元素的质量之比为 ,两物质中含有电子的物质的量之比为 。
10. 1.5 mol H 2SO 4的质量是 。
其中含有 mol O, mol H,其质量分别为 和 。
11. 0.01 mol 某物质的质量为1.08 g ,此物质的摩尔质量为 。
12.下列说法正确的是( )A.71 g 氯相当于2 mol 氯B.每摩尔物质中含有6.02×1023个原子C.阿伏加德罗常数为12 g 12C 所含的碳原子数D.1 mol KClO 3中含有3 mol 氧元素 13.如果1 g 水中含有m 个氢原子,则阿伏加德罗常数是( ) A.m91B.9mC.2mD.18m 14.下列说法正确的是( )A.氮原子的质量就是氮的相对原子质量B.氢氧化钠的摩尔质量是40 gC.1 mol H 2SO 4中含有1 mol H 2D.氩气的摩尔质量在数值上等于它的相对原子质量15.0.8g 某物质含有3.01*1022个分子,该物质的式量约为()A.8B.16C.64D.16016.与22gCO2所含分子数相等的水的质量为()A.44gB. 22gC.18gD.9g17.28%的KOH溶液中,平均多少个水分子溶有一个OH-()A.6B. 8C.10D.2818.能电离出的Cl-数目与2molNaCl电离出的Cl-数目相同的是()A.1molMgCl2B.2molKClO3C.1molAlCl3D.1.5molCaCl219.有98g纯H2SO4和纯H3PO4的混酸,其中含氧64g,则混酸中H2SO4和H3PO4的物质的量之比为()A.1:1B.2:3C.3:2D.任意比20.由FeO、Fe2O3、Fe3O4组成的混合物,测得铁与氧元素的质量比为21:8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能是()A. 1:2:1B. 2:1:1C.1:1:1D.1:2:321.2.16gX2O5中含有0.1mol氧原子,则X的相对原子质量为()A.21.6B.28C.31D.1422.V2O3和V2O5按不同物质的量之比混合可按化学计量系数完全反应,今欲制备V8O17,则V2O3和V2O5的物质的量之比为()A.1:2B.2:1C. 3:5D.5:323.如果mg氨气由a个原子构成,则2m g硫化氢中含有的分子数为(用含a的代数式表示)。
24.0.5mol氯酸钾所含氯原子数与__ g氯化钙中所含氯离子数相同,所含氧原子数与g水中所含氧原子数相同。
25.24.5gH2SO4的物质的量为,其中含 molS,含 gH,含个O。
当它溶于水完全电离时,可产生____ molH+和 molSO42-。
26.0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是。
27.71gNa2SO4中含有的Na+和SO42-的物质的量多少?28.24.5gH2SO4的物质的量是多少?1.50molNaCO3的质量是多少?29.等质量的下列物质中,所含分子数最少的是()A.Cl2B.HClC.NH3D.H2SO430.1g H2O中含有a个氢原子,则阿伏加德罗常数为()A.(a/9)mol-1B. 9a mol-1C.2a mol-1D.a mol-131.用N A表示阿伏加德罗常数的值。
下列说法中正确的是( )。
A.1molO2比1molN2的质子数多N A B.2g氢气中含有的原子数为N AC.3.01×1023个氮分子中含有的原子数为N A D.17g氨气中含有的电子数为10N A32.用N A表示阿伏加德罗常数的值。
下列说法中错误的是( )A.1molOH-含10N A个电子B.18g水中所含的电子数为8N AC.1molH2O分子的质量与N A个H2O分子的质量相等D.1molH2SO4分子约含有1.204×1024个H原子33. 19.6g H2SO4中氧元素的质量_________________34. 含有1.5*1022个分子,其质量为2.7g ,求分子质量?35. 多少克H2SO4所含的分子数与3.6克10%盐酸所含溶质的分子数相等?36. 0.2 mol KClO3中所含的Cl原子数与多少克CaCl2中所含的C l-离子数相等?气体摩尔体积一、气体摩尔体积(一)1.单位物质的量的气体所占的体积,就叫作气体摩尔体积。
符号:V m单位:L/mol2.在标准状况下,任何气体的摩尔体积都约为22.4 L/mol在0℃、101KP时,1mol任何气体的体积都约为22.4L。
我们将0℃、101KP称为标准状况。
在标准状况下,1mol任何气体所占的体积都约为22.4L。
3. V m = V/n (单位:L/mol)【注意】(1)气体摩尔体积仅仅是针对气体而言(2)气体在不同状况下的气体摩尔体积是不同的,在标准状况下的气体摩尔体积约为22.4 L/mol(3)同温同压下,气体的体积只与气体的分子数目,而与气体分子的种类无关。
二、阿伏伽德罗定律及其推论1.阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
即同温同压下:2.相关推论:(1)在同温同压下,相同体积的气体质量比等于摩尔质量比,(相对分子质量),即:(2)在同温同压下,两种不同的气体的密度比等于摩尔质量(相对分子质量)比: (“D”为气体1 对气体2 的相对密度)(3)在同温同压下,等质量的两种气体的体积比与摩尔质量成反比:(4)在同温同体积下,两种不同气体的压强比等于物质的量之比:专题:混合气体平均相对分子质量的几种求法【例题1】在标准状况下,由10gCO和CO2组成的混合气体的体积为6.72L,则此混合气体中CO和CO2的分子个数之比为多少?【例题2】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。
则该混合气体中CO2、H2和CO的体积比为()A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57随堂练习一:1.已知空气的平均摩尔质量为29g/mol,在同温同压下,某气体R对空气的相对密度为2,该气体的相对分子质量为:____________2.由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2的体积比为多少?自我检测1.下列关于物质的量表示正确的是()A、1mol氢B、2mol分子C、3mol氧原子D、4mol H22.下列说法正确的是()A、氮原子的质量在数值上等于它的摩尔质量B、NaOH的摩尔质量是40gC、氩气的摩尔质量在数值上等于它的相对原子质量D、CaCO3的摩尔质量是100Kg/mol3.0.5molO3中含有的O3数目是______________,含有的O原子数目是______________,含有的质子数目是______________。
