章末高考题组检测(十一) 化学与技术
【南方新课堂】新高考化学一轮新高考总复习:第十一单元化学与技术课时作业(含答案解析)

第十一单元化学与技术(选考)第 1 节化学与工农业生产一、选择题 (本大题共42 分,每题 6 分,每题只有一个正确选项)1.工、农业及城市生活污水中含磷,对于办理污水时要不要除掉磷,以下说法正确的是()。
A.磷是生物的营养元素,不用除掉B.含磷的污水是很好的肥料,不用除掉C.含磷污水排到自然水中,惹起藻类生殖,使水变质,一定除掉D.磷对人无毒,除掉与否没关紧急2.依据化学知识,以下说法正确的选项是()。
A.施用碳铵后应立刻盖上土壤B.复合肥是两种或两种以上化肥的混淆物C.可用工业用盐作食盐用于烹饪D.加碘食盐中的“碘”往常是指碘单质3.以下工业生产顶用到的原料气体,能够不经过净化办理的是()。
A.硫酸工业中进入热互换器的气体B.合成氨工业中进入合成塔的气体C.硝酸工业中进入氧化炉的气体(氨的催化氧化)D.漂白粉工业中通入石灰乳的气体4. (2015 年江苏徐州模拟 )联合制碱法中重点的一步是把NH 4Cl 从几乎饱和的 NaHCO 3溶液中分别出来,为此依据NaCl 和 NH 4Cl 溶解度的差别,向混淆溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO 3的 NH 4Cl 。
NaCl 和 NH 4Cl 共同存在时的溶解度曲线以下图,以下操作正确的选项是()。
选项通入气体温度控制A CO230~ 40 ℃B CO20~10 ℃C NH330~ 40 ℃D NH30~10 ℃5.(2015 年东北三校联考)以下有关工业生产的表达正确的选项是()。
A.在硫酸工业、合成氨工业、硝酸工业中,均一定对尾气进行汲取办理B.硫酸工业中,在接触室安装热互换器是为了利用SO3转变为 H2SO4时放出的热量C.炼铁是铁矿石在高温下被氧化的过程D.用烧碱溶液汲取硝酸工业尾气中的氮氧化物,不单能够防备有害物质的排放,还可以生产实用的NaNO 26.以下对于化工生产原理的表达中,均切合当前工业生产本质的是()。
高考化学二轮复习配套复习:主观题综合训练 化学与技术(选考)

化学与技术(选考)【主观题综合训练】化学与技术(选考)1.(2021·开封二模)硅及其化合物的开发由来已久,在现代生活中有广泛应用。
回答下列问题。
(1) 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下。
发生的主要反应电弧炉SiO+2C Si+2CO↑2流化床反应器Si+3HCl SiHCl+H23还原炉①还原炉中发生主要反应的化学方程式为,该工艺中可循环使用的物质为(填化学式),用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和。
物质Si SiCl4SiHCl3 SiH2Cl2SiH3ClHCl SiH4沸点/℃2355 57.6 31.8 8.2 -30.4 -84.9-111.9③SiHCl3极易水解,其完全水解的化学方程式为。
(2) 氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。
粉末状Si3N4遇空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在230×1.01×105 Pa和185 ℃的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2。
①由SiCl4和NH3反应制取Si3N4的化学方程式为。
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为。
③Si3N4和适量氧化镁在230×1.01×105 Pa和185 ℃的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成(填化学式)物质,热处理后除去MgO和Mg3N2的方法是。
人教版高中化学高考第一轮复习专题13《化学和技术》测试卷(解析版)

人教版高中化学高考第一轮复习专题13《化学与技术》测试卷一、单选题(共15小题)1.在金属A中含有金属B,发生电化锈蚀时,金属A被腐蚀;将金属A与金属C组成原电池,则A为电池的正极,A,B,C三种金属还原性的强弱顺序是()A. A>B>CB. C>B>AC. B>C>AD. C>A>B2.下列哪一项符合“绿色化学”的原则( )A.排放前对废气、废水、废渣进行无害化处理B.在化学生产中少用或不用有害物质以及少排放或不排放有害物质C.在化工生产中,尽量避免使用任何化学物质D.在化工厂范围多种草种树,努力构建花园式工厂3.酚醛树脂可用苯酚和甲醛反应制得。
实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得的酚醛树脂若不易取出时,则可趁热时加入一些乙醇来取出树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出,用加热或加溶剂的方法都很难将树脂取出。
在上述两种情况下,下列有关叙述正确的是()A.酸性条件制得的是线型酚醛树脂,碱性条件制得的是网状结构酚醛树脂B.酸性条件制得的是体型酚醛树脂,碱性条件制得的是线型酚醛树脂C.两种条件下制得的都是线型酚醛树脂D.两种条件下制得的都是网状结构酚醛树脂4.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸B.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸5.在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:A.氧化亚铜(Cu2O)B.氧化钴(Co2O3)C.氧化铅(PbO)D.硼砂(Na2B4O7·10H2O)(1)制造化学仪器的玻璃需加入的物质是______。
(2)制造光学仪器的玻璃需加入的物质是______。
(3)制造蓝色玻璃需加入的物质是____________。
高考化学复习专题11化学与技术(选修)(3年高考)高考化学大题狂做系列(第02期)(原卷版).docx
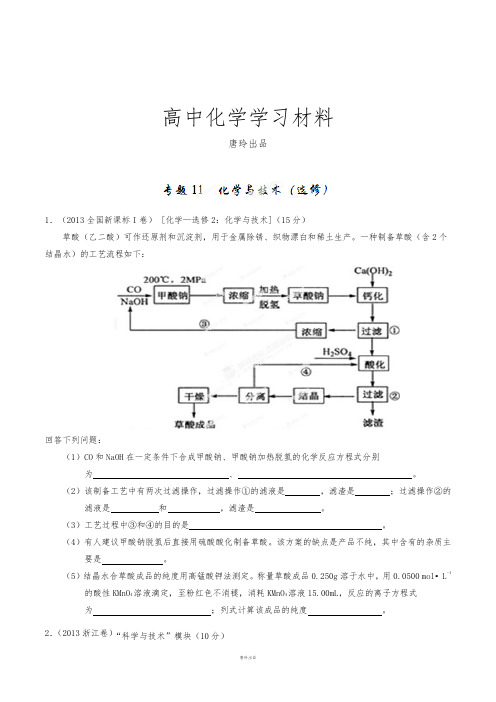
高中化学学习材料唐玲出品1.(2013全国新课标I卷) [化学—选修2:化学与技术](15分)草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。
一种制备草酸(含2个结晶水)的工艺流程如下:回答下列问题:(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。
该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250g溶于水中,用0.0500 mol•L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为;列式计算该成品的纯度。
2.(2013浙江卷)“科学与技术”模块(10分)电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:用电石浆可生产无水,某化工厂设计了以下工艺流程:已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用①。
(2)脱色槽中应加入的物质X是②;设备A的作用是③;设备B的名称为④;设备C的作用是⑤。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是⑥。
A.水 B.浓硫酸 C.石灰乳 D.硝酸(4)将设备B中产生的母液重新引入反应器的目的是⑦。
3.(2013上海卷)七、(本题共12分)溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。
实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:完成下列填空:(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、。
(2)已知步骤Ⅲ的滤液中不含NH4+。
2020年高考化学二轮复习验收测试《化学与技术》含答案及详细解析

绝密★启用前2020年高考化学二轮复习验收测试《化学与技术》本试卷共100分,考试时间90分钟。
一、单选题(共15小题,每小题4.0分,共60分)1.铝生产产业链由铝土矿的开采、氧化铝的制备、铝的冶炼与铝材加工等环节构成。
下列有关铝的冶炼的说法错误的是()A.为满足社会对铝材的需求,促进经济发展,需大量开采铝土矿B.工业上通过电解氧化铝-冰晶石(Na3AlF6)的熔融体制得铝,加入冰晶石的目的是降低氧化铝的熔化温度C.电解氧化铝得到的铝中含有少量Fe、Si等杂质,需进一步电解提纯,提纯时阳极的电极反应式为Al-3e-===Al3+D.纯铝的性能有时不能满足工农业、科研和国防建设等的需要,因此需将铝加工成铝合金2.下列有关材料的说法不正确的是()。
A.金属材料是指金属及合金,合金性能优于纯金属B.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐C.复合材料是由基体和增强体两部分组成的D. C60也是一种材料3.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是()A.使用吸收塔设备B.使用尾气吸收装置C.使用H2作原料D.使用催化剂4.下列材料的特性及用途说法错误的是()A.氧化铝陶瓷具有两性,不可用来制造人造牙齿B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机C.光导纤维导光的能力很强,是非常好的通讯材料D.压电陶瓷十分敏感,可以将极其微弱的机械振动转换成电信号,可用来制压电地震仪5.海水中含有氯化镁,是镁的主要来源之一。
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将得到的产物熔融后电解。
关于提取镁,下列说法正确的是()。
A.此法对环境不会造成任何污染B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化C.若提取12 kg Mg,则电子转移1 000 molD.以上提取镁的过程涉及的离子反应共有3个6.下列塑料的合成,所发生的反应类型与另外三种不同的是()7.下列离子在稳定人体血液的pH中起作用的是( )A. Na+B. HCO3-C. Fe2+D. Cl-8.航天科学家正在考虑用塑料飞船代替铝制飞船,进行太空探索。
2020届高中化学高考复习人教版专题13《化学和技术》测试卷

2020届高中化学高考复习人教版专题13《化学和技术》测试卷专题13《化学与技术》测试卷一、单选题(共15小题)1.对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确的是()A.反应中SiO2是氧化剂,C是还原剂B.硅元素被还原了,碳元素被氧化了C.在反应中C只作还原剂D.在反应中氧化剂与还原剂的物质的量之比为1∶22.对下列化学反应的分析判断不正确的是()A.反应类型属于缩聚反应B.反应类型属于加聚反应C.生成物可划归为烃D.生成物分子中链节不只一种3.下列关于无机非金属材料的说法中正确的是()。
A.传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐4.符合实际并用于工业生产的是()。
A. CO2通入氢氧化钠溶液中制Na2CO3 B. H2和Cl2光照制HCl C. Cl2通入澄清石灰水中制漂白粉D.用硫黄制硫酸5.下面有关发泡塑料饭盒的叙述,不正确的是( )A.主要材质是高分子材料B.价廉,质轻,保温性能好C.适用于微波炉加热食品D.不适于盛放含油较多的食品6.世界上60%的镁是从海水中提取的,其主要步骤如下:∶把贝壳制成石灰乳∶在海水中加入石灰乳,过滤,洗涤沉淀物∶将沉淀物与盐酸反应,结晶、过滤∶在氯化氢热气流中干燥晶体∶电解上述晶体的熔融物。
下列说法不正确的是()A.镁元素在元素周期表中位于第3周期,∶A族B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净C.在氯化氢热气流中干燥晶体的目的是抑制MgCl2水解D.步骤∶也可以采用电解该晶体水溶液的方法7.世界著名的科技史专家,英国剑桥大学的李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了。
”下列有关玻璃的说法不正确的是()。
高考化学二轮复习高考周卷化学与技术含解析

化学及技术可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba~137 Ca~40 Cu~64 Mg~24、选择题〔本大题共15小题。
在每题给出的四个选项中,只有一个选项是符合题目要求的〕1.信息、材料、能源被称为新科技革命的“三大支柱〞。
以下观点或做法错误的选项是( )......A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源B.加大煤炭的开采速度,增加煤炭燃料的供给量,以缓解石油危机C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅〔Si3N4〕具有较高的硬度与耐磨性,可用于制造汽车发动机2.以下说法不正确的选项是〔〕A.接触法制硫酸的主要步骤是造气.接触氧化与三氧化硫的吸收B.硫酸厂应该建在靠近原料产地的地区C.由于常压下SO2转化为SO2的转化率很高,所以SO2接触氧化时不采用高压的反响条件D.工业“三废〞的综合利用不仅减少污染,还获得有用的副产品3.在硫酸的工业制法中,以下生产操作及说明生产操作的主要原因二者都正确的选项是〔〕A.从沸腾炉出来的炉气需净化,因为炉气中SO3会及杂质反响B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧用%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全3氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率24. “纳米材料〞是指颗粒的三维线度中的任一维都在1~100 nm范围内的材料。
纳米技术所带动的技术革命及其对人类的影响,远远超过电子技术。
以下关于纳米技术的表达不正确的选项是( )。
A.将“纳米材料〞分散到液体分散剂中可制得液溶胶B.用纳米级金属颗粒粉剂作催化剂可加快反响速率,提高反响物的平衡转化率C.用纳米颗粒粉剂做成火箭的固体燃料将有更大推动力D.银器能抑菌.杀菌,纳米银粒子植入内衣织物中,有奇异的抑菌.杀菌效果5.煅烧硫铁矿〔主要成分是FeS2〕,可获得制取硫酸所需要的SO2,反响为4FeS2+11O2高温2Fe2O3+8SO2,为了提高生成SO2的速率,以下措施可行的是〔〕A.增加硫铁矿的投入量B.降低温度C.向炉内喷氧气,增加氧气压D.尽快把SO2从反响体系中别离出来6.工业生产中要考虑化学反响速率,以下有关说法正确的选项是( )A.在生产中化学反响速率越快越好B.在生产中,增加一种反响物的量一定可以到达加快反响速率的目的C.催化剂的用量多少及化学反响速率无关D.工业生产中采用适当的条件获取适宜的化学反响速率7.在NH3.HNO3.H2SO4的工业生产中,具有的共同点是A.使用吸收塔设备B.使用尾气吸收装置C.使用H2作原料D.使用催化剂8.有关接触法制硫酸,以下说法中不正确的选项是〔〕A.用硫与硫铁矿均可做为原料转化为SO3,需在催化剂与加热条件下进展2可用水直接吸收3D.热交换器可对生成气体冷却,对原料气体加热9.以下物质不属于“城市空气质量日报〞报导的是( )A.二氧化硫B.氮氧化物C.二氧化碳D.悬浮颗粒10.化学工业在经济开展中的作用举足轻重,以下有关工业生产的表达中正确的选项是( )。
2021届 人教版高中化学高三基础复习专题13《化学与技术》测试卷

专题13《化学与技术》测试卷一、单选题(共15小题)1.以农副产品为原料可制得高分子材料,它能在一定条件下迅速降解,有希望用于制造一次性饭盒,有关该高分子的判断正确的是( )A.相对分子质量一定是偶数B.相对分子质量一定是奇数C.由单体通过加聚反应制得D.其单体为2.下列说法不正确的是( )A.晶体硅是“信息革命”的支柱材料,是工业上制造光导纤维的主要原料B.复合材料是由两种或两种以上性质不同的材料经特殊加工而制成的C.耐高温陶瓷、生物陶瓷等新型陶瓷已不再是以硅、氧两种元素为主的组成体系D.线型高分子材料可溶于一些有机溶剂,属于热塑性聚合物3.下列化学肥料属于复合肥料的是( )A.氯化钾B.硝酸铵C.磷酸二氢钙D.硝酸钾4.下列金属的防护方法不正确的是( )A.对健身器材涂油漆以防止生锈B.对某些工具的“机械转动部位”选用刷油漆的方法来防锈C.用牺牲锌块的方法来保护船体D.自行车的钢圈上镀上一层Cr防锈5.下列关于钢和铁的说法错误的是()A.生铁和钢中主要成分是铁,都是混合物B.纯铁是由铁原子构成的C.通常说的“钢铁”,意思是钢就是铁,铁就是钢,钢铁是一种物质D.生铁和钢冶炼的原理不同,冶炼时前者用还原剂,后者用氧化剂6.我国多位工程院士指出:发展生物柴油具有战略意义。
所谓生物柴油就是以大豆、油菜子等油料作物,油棕、黄连木等油料林木果实,工程微藻等水生植物以及动物油脂、废餐饮油等为原料制成的液体燃料,是优质的汽油、柴油代用品。
据以上信息,下列有关生物柴油的说法中错误的是( )A.生物柴油是可再生能源B.生物柴油的组成成分与矿物柴油完全相同C.发展生物柴油有益于保护生态环境D.发展生物柴油有利于调整产业结构,增加农民收入7.海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是()A.历史最悠久的海水淡化方法是蒸馏法B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO 与H2O化学性质不同C.从海水中可以得到NaCl电解熔融NaCl可制备金属钠D.从海水中提取镁可以采用下列方法:海水Mg(OH)2MgCl2溶液→MgCl2→MgCl2(熔解)Mg8.下列说法中不正确的是( )A.新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高B.光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便C.高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点D.光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面9.下列说法中不正确的是( )A.新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高B.光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便C.高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点D.光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面10.下列使用化肥,农药的描述中正确的是( )A.高温多雨时比较适合施用钾肥B.长期施用硫铵会造成土壤板结C.石硫合剂必须与硫酸混合后才能施用D.过磷酸钙必须经硫酸处理后才能施用11.下列说法正确的是( )A.把煤加强热使之分解的过程叫干馏B.煤的干馏属于化学变化C.煤是工业上获得芳香烃的一种重要来源,主要存在于煤干馏所得的焦炉气中D.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来12.从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是( ) A.加适量的KI溶液B.通入溴蒸气C.加入适量的NaOH溶液D.加入适量的NaBr溶液13.如图所示,利用海洋可提取很多重要的化工原料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
章末高考题组检测(十一)化学与技术题组一、化工生产1.(2012·上海高考)下列关于硫酸工业生产过程的叙述错误的是()A.在接触室中使用铁粉作催化剂B.在接触室中运用热交换技术可充分利用能源C.把硫铁矿磨成细粉末,可以提高原料的利用率D.该反应采用450~500℃主要是因为该温度下催化剂活性好2.(2012·海南高考)合成氨的流程示意图如下:回答下列问题:(1)工业合成氨的原料是氮气和氢气。
氮气是从空气中分离出来的,通常使用的两种分离方法是____________________________________________________________________、____________________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式______________________,______________________;(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为____________________________;(3)设备B的名称是________________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。
不宜从相反方向通水的原因是_________________________________________ __________________________;(4)设备C的作用是_______________________________________________________;(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)CO2(g)+H2(g)。
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O)∶c(CO)不低于________。
3.(2011·海南高考)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。
请回答下列问题:(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为:________________________________________________________________________;②硫酸钠和焦炭、石灰石反应的化学方程式为:______________________________(已知产物之一为CaS);(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是______,D是______(写化学式);②装置乙中发生反应的化学方程式为_________________________________________________________________________________________________________________;(3)联合制碱法对氨碱法的改进,其优点是____________________________________;(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。
请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?________________________________________________________________________ ________________________________________________________________________。
题组二、化学与资源开发利用4.(2012·山东高考)石油和煤炭加工过程涉及多种技术和设备。
(1)石油分馏时,在不断向________(填工业设备名称)内投放原料的同时获得产品,该过程为________操作过程。
(2)石油裂化分为热裂化、________和加氢裂化,裂化的目的是提高________的产量。
(3)煤的洗选是为了降低原煤中灰分和________的含量。
煤的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭颗粒________进行燃烧的过程。
(4)煤的直接液化是煤与适当溶剂混合后在高温和________存在下与________作用生成液体燃料的过程。
5.(2010·新课标全国卷)水是一种重要的自然资源,是人类赖以生存不可缺少的物质。
水质优劣直接影响人体健康。
请回答下列问题:(1)天然水中溶解的气体主要有________、________。
(2)天然水在净化处理过程中加入的混凝剂可以是______________________________(填两种),其净水作用的原理是____________________________________________________;(3)水的净化与软化的区别是________________________________________________;(4)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。
若某天然水中c(Ca2+)=1.2×10-3 mol·L-1,c(Mg2+)=6×10-4 mol·L-1,则此水的硬度为________;(5)若(4)中的天然水中c(HCO-3)=8×10-4 mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2________g,后加入Na2CO3________g。
题组三、化学与材料6.(2010·山东高考)玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中________加入甲醛,且反应釜应装有________装置。
(2)玻璃纤维由玻璃拉丝得到。
普通玻璃是由石英砂、________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为________________________________________________。
(3)玻璃钢中玻璃纤维的作用是__________。
玻璃钢具有________________________等优异性能(写出两点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是________。
a.深埋b.粉碎后用作树脂填料c.用作燃料d.用有机溶剂将其溶解,回收树脂7.(2011·全国新课标)普通纸张的主要成分是纤维素。
在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。
请回答下列问题:(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。
经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________________________________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为__________________________________。
(2)为了保护这些纸质文物,有人建议采取下列措施:①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等。
这样操作产生的主要问题是________________________________________________________________________;②喷洒Zn(C2H5)2。
Zn(C2H5)2可以与水反应生成氧化锌和乙烷。
用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________________________________,________________________________________________________________________。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO 3)为原料按下列过程进行的,请完成下列化学方程式: ① FeTiO 3+ C + Cl 2=====900℃ TiCl 4+ FeCl 3+ CO② TiCl 4+ O 2=====1000~1400℃ TiO 2+ Cl 28.(2012·新课标全国卷)由黄铜矿(主要成分是CuFeS 2)炼制精铜的工艺流程示意图如下: 铜矿石――→选矿 铜精矿砂――――→焙烧和除渣反射炉冰铜――→还原转炉粗铜――→精炼电解槽电解铜 (1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000℃左右,黄铜矿与空气反应生成Cu 和Fe 的低价硫化物,且部分Fe 的硫化物转变为低价氧化物。
该过程中两个主要反应的化学方程式分别是______________________、______________________,反射炉内生成炉渣的主要成分是________;(2)冰铜(Cu 2S 和FeS 互相熔合而成)含Cu 量为20%~50%。
转炉中,将冰铜加熔剂(石英砂)在1 200℃左右吹入空气进行吹炼。
冰铜中的Cu 2S 被氧化为Cu 2O ,生成的Cu 2O 与Cu 2S 反应,生成含Cu 量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____________________、__________________________________;(3)粗铜的电解精炼如右图所示。
在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d 上发生的电极反应式为____________________________________;若粗铜中还含有Au 、Ag 、Fe ,它们在电解槽中的存在形式和位置为___________________。
答 案章末高考题组检测(十一)1.选A 硫酸工业生产中,在接触室中用铁触媒作催化剂,使SO 2氧化为SO 3,A 项错误;使用热交换装置可节约能源,B 项正确;把硫铁矿磨碎可增大其与氧气的接触面,使反应更充分,速率更快,可提高原料的利用率,C 项正确;反应温度采用450~500℃是因为该温度下催化剂活性最高,D 项正确。
2.解析:(1)提取空气中的氮气可用物理方法:分离液态空气法,也可以用化学反应除去其中的氧气。
(2)合成氨的反应在合成塔中进行;(3)冷凝分离产品设备为冷凝器,入水口应该在下面,因逆向冷凝效果好;(4)分离器是气—液分离用设备。
(5)以转化率为90%为基准计算,用平衡常数求水与一氧化碳浓度比。
