化工原理实验报告-填料塔吸收实验
填料吸收塔实验报告

填料吸收塔实验报告篇一:填料吸收塔实验报告填料吸收塔一、实验目的1.熟悉填料吸收塔的构造和操作。
2.测定气体通过干湿填料塔的压力降,进一步了解填料塔的流体力学特征。
3.测定填料吸收塔的吸收传质系数。
二、实验原理填料吸收塔一般要求控制回收率越高越好。
填料塔为连续接触式的气液传质设备,填料塔操作时液体从塔顶经分布器均匀喷洒至塔截面上,沿填料表面下流经塔底出口管排出,气体从支承板下方入口管进入塔内,在压力的作用下自下而上的通过填料层的空隙而由塔顶气体出口管排出。
填料层内气液两相成逆流流动,在填料表面的气液界面上进行传质,因此两相组成沿塔高边缘变化,由于液体在填料中有倾向塔壁的流动,故当填料层较高时,常将其分为若干段,在两段之间设置液体再分布装置,以利于流体的重新均匀分布。
填料的作用:1.增加气液接触面积。
满足(1)80%以上的填料润湿;(2)液体为分散相,气体为连续相。
2.增加气液接触面的流动。
满足(1)合适的气液负荷;(2)气液逆流。
三、实验步骤(1)将液体丙酮用漏斗加入到丙酮汽化器,液位高度约为液体计高度的2/3以上。
(2)关闭阀V3,向恒压槽送水,以槽内水装满而不溢出为度,关闭阀V5。
(3)启动空气压缩机,调节压缩机使包内的气体达到0.05~0.1Mpa时,打开V2,然后调节气动压力定值器,使进入系统的压力恒定在0.03Mpa。
(4)打开V4,调节空气流量(400L/H~500L/H); 打开V6,调节空气流量(5)室温大于15℃时,空气不需要加热,配制混合气体气相组成y1在12%~14%mol左右;若室内温度较低,可预热空气,使y1达到要求。
(6)要改变吸收剂温度来研究其对吸收过程的影响,则打开液体加热电子调节器,温度t3 (7)各仪表读数恒定5min以后,既可记录或取样分析有关数据,再按预先设计的试验方案调节有关参数。
(8)A1为取样测y1; A2为取样测y2;(9)阀V10为控制塔底液面高度,以保证有液封。
化工原理实验实验报告

篇一:化工原理实验报告吸收实验姓名专业月实验内容吸收实验指导教师一、实验名称:吸收实验二、实验目的:1.学习填料塔的操作;2. 测定填料塔体积吸收系数kya.三、实验原理:对填料吸收塔的要求,既希望它的传质效率高,又希望它的压降低以省能耗。
但两者往往是矛盾的,故面对一台吸收塔应摸索它的适宜操作条件。
(一)、空塔气速与填料层压降关系气体通过填料层压降△p与填料特性及气、液流量大小等有关,常通过实验测定。
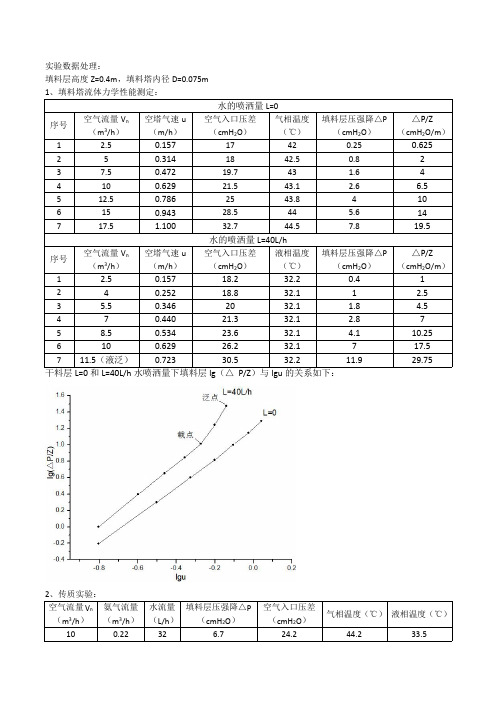
若以空塔气速uo[m/s]为横坐标,单位填料层压降?p[mmh20/m]为纵坐标,在z?p~uo关系z双对数坐标纸上标绘如图2-2-7-1所示。
当液体喷淋量l0=0时,可知为一直线,其斜率约1.0—2,当喷淋量为l1时,?p~uo为一折线,若喷淋量越大,z?p值较小时为恒持z折线位置越向左移动,图中l2>l1。
每条折线分为三个区段,液区,?p?p?p~uo关系曲线斜率与干塔的相同。
值为中间时叫截液区,~uo曲zzz?p值较大时叫液泛区,z线斜率大于2,持液区与截液区之间的转折点叫截点a。
姓名专业月实验内容指导教师?p~uo曲线斜率大于10,截液区与液泛区之间的转折点叫泛点b。
在液泛区塔已z无法操作。
塔的最适宜操作条件是在截点与泛点之间,此时塔效率最高。
图2-2-7-1 填料塔层的?p~uo关系图 z图2-2-7-2 吸收塔物料衡算(二)、吸收系数与吸收效率本实验用水吸收空气与氨混合气体中的氨,氨易溶于水,故此操作属气膜控制。
若气相中氨的浓度较小,则氨溶于水后的气液平衡关系可认为符合亨利定律,吸收姓名专业月实验内容指导教师平均推动力可用对数平均浓度差法进行计算。
其吸收速率方程可用下式表示: na?kya???h??ym(1)式中:na——被吸收的氨量[kmolnh3/h];?——塔的截面积[m2]h——填料层高度[m]?ym——气相对数平均推动力kya——气相体积吸收系数[kmolnh3/m3·h]被吸收氨量的计算,对全塔进行物料衡算(见图2-2-7-2):na?v(y1?y2)?l(x1?x2) (2)式中:v——空气的流量[kmol空气/h]l——吸收剂(水)的流量[kmolh20/h]y1——塔底气相浓度[kmolnh3/kmol空气]y2——塔顶气相浓度[kmolnh3/kmol空气]x1,x2——分别为塔底、塔顶液相浓度[kmolnh3/kmolh20]由式(1)和式(2)联解得:kya?v(y1?y2)(3) ??h??ym为求得kya必须先求出y1、y2和?ym之值。
化工原理实验 吸收实验 伯努利方程实验
液相温度 填料层压强降△P
(℃)
(cmH2O)
1
2.5
0.157
18.2
32.2
0.4
2
4
0.252
18.8
32.1
1
3
5.5
0.346
20
32.1
1.8
4
7
0.440
21.3
32.1
2.8
5
8.5
0.534
23.6
32.1
4.1
6
10
0.629
26.2
32.1Βιβλιοθήκη 77 11.5(液泛) 0.723
30.5
A 截面-D 截面
0
1
-1
114
115
300
-74
10
128
64
600
66
56
167
278
冲压头为静压头与动压头之和。
在实验导管窗口流量开 600(L/h)时,A 处的静压头为 596 mmH2O 柱,B 处的静压头为 530 mmH2O 柱,PA>PB, 说明 B 处的静压能转化为动能。
0.8
3
7.5
0.472
19.7
43
1.6
4
10
0.629
21.5
43.1
2.6
5
12.5
0.786
25
43.8
4
6
15
0.943
28.5
44
5.6
7
17.5
1.100
32.7
44.5
7.8
水的喷洒量 L=40L/h
序号
化工原理实验报告吸收实验

姓名院 专业 班 年 月 日 实验内容 指导教师一、 实验名称:吸收实验二、实验目的:1.学习填料塔的操作;2. 测定填料塔体积吸收系数K Y a .三、实验原理:对填料吸收塔的要求,既希望它的传质效率高,又希望它的压降低以省能耗。
但两者往往是矛盾的,故面对一台吸收塔应摸索它的适宜操作条件。
(一)、空塔气速与填料层压降关系气体通过填料层压降△P 与填料特性及气、液流量大小等有关,常通过实验测定。
若以空塔气速o u [m/s]为横坐标,单位填料层压降ZP ∆[mmH 20/m]为纵坐标,在双对数坐标纸上标绘如图2-2-7-1所示。
当液体喷淋量L 0=0时,可知Z P ∆~o u 关系为一直线,其斜率约1.0—2,当喷淋量为L 1时,ZP ∆~o u 为一折线,若喷淋量越大,折线位置越向左移动,图中L 2>L 1。
每条折线分为三个区段,Z P ∆值较小时为恒持液区,Z P ∆~o u 关系曲线斜率与干塔的相同。
Z P ∆值为中间时叫截液区,ZP ∆~o u 曲线斜率大于2,持液区与截液区之间的转折点叫截点A 。
Z P ∆值较大时叫液泛区,吸收实验姓名院 专业 班 年 月 日 实验内容 指导教师 ZP ∆~o u 曲线斜率大于10,截液区与液泛区之间的转折点叫泛点B 。
在液泛区塔已无法操作。
塔的最适宜操作条件是在截点与泛点之间,此时塔效率最高。
图2-2-7-1 填料塔层的ZP ∆~o u 关系图图2-2-7-2 吸收塔物料衡算(二)、吸收系数与吸收效率本实验用水吸收空气与氨混合气体中的氨,氨易溶于水,故此操作属气膜控制。
若气相中氨的浓度较小,则氨溶于水后的气液平衡关系可认为符合亨利定律,吸收姓名院 专业 班 年 月 日 实验内容 指导教师 平均推动力可用对数平均浓度差法进行计算。
其吸收速率方程可用下式表示: m Ya A Y H K N ∆⋅⋅Ω⋅= (1) 式中:N A ——被吸收的氨量[kmolNH 3/h];Ω——塔的截面积[m 2]H ——填料层高度[m]∆Y m ——气相对数平均推动力K Y a ——气相体积吸收系数[kmolNH 3/m 3·h]被吸收氨量的计算,对全塔进行物料衡算(见图2-2-7-2):)()(2121X X L Y Y V N A -=-= (2) 式中:V ——空气的流量[kmol 空气/h]L ——吸收剂(水)的流量[kmolH 20/h]Y 1——塔底气相浓度[kmolNH 3/kmol 空气]Y 2——塔顶气相浓度[kmolNH 3/kmol 空气]X 1,X 2——分别为塔底、塔顶液相浓度[kmolNH 3/kmolH 20]由式(1)和式(2)联解得:mYa Y H Y Y V K ∆⋅⋅Ω-=)(21 (3) 为求得K Y a 必须先求出Y 1、Y 2和∆Y m 之值。
化工原理实验报告吸收实验

姓名院 专业 班 年 月 日 实验内容 指导教师一、 实验名称:吸收实验二、实验目的:1.学习填料塔的操作;2. 测定填料塔体积吸收系数K Y a .三、实验原理:对填料吸收塔的要求,既希望它的传质效率高,又希望它的压降低以省能耗。
但两者往往是矛盾的,故面对一台吸收塔应摸索它的适宜操作条件。
(一)、空塔气速与填料层压降关系气体通过填料层压降△P 与填料特性及气、液流量大小等有关,常通过实验测定。
若以空塔气速o u [m/s]为横坐标,单位填料层压降ZP ∆[mmH 20/m]为纵坐标,在双对数坐标纸上标绘如图2-2-7-1所示。
当液体喷淋量L 0=0时,可知Z P ∆~o u 关系为一直线,其斜率约1.0—2,当喷淋量为L 1时,ZP ∆~o u 为一折线,若喷淋量越大,折线位置越向左移动,图中L 2>L 1。
每条折线分为三个区段,Z P ∆值较小时为恒持液区,Z P ∆~o u 关系曲线斜率与干塔的相同。
Z P ∆值为中间时叫截液区,ZP ∆~o u 曲线斜率大于2,持液区与截液区之间的转折点叫截点A 。
Z P ∆值较大时叫液泛区,吸收实验姓名院 专业 班 年 月 日 实验内容 指导教师 ZP ∆~o u 曲线斜率大于10,截液区与液泛区之间的转折点叫泛点B 。
在液泛区塔已无法操作。
塔的最适宜操作条件是在截点与泛点之间,此时塔效率最高。
图2-2-7-1 填料塔层的ZP ∆~o u 关系图图2-2-7-2 吸收塔物料衡算(二)、吸收系数与吸收效率本实验用水吸收空气与氨混合气体中的氨,氨易溶于水,故此操作属气膜控制。
若气相中氨的浓度较小,则氨溶于水后的气液平衡关系可认为符合亨利定律,吸收姓名院 专业 班 年 月 日 实验内容 指导教师 平均推动力可用对数平均浓度差法进行计算。
其吸收速率方程可用下式表示: m Ya A Y H K N ∆⋅⋅Ω⋅= (1) 式中:N A ——被吸收的氨量[kmolNH 3/h];Ω——塔的截面积[m 2]H ——填料层高度[m]∆Y m ——气相对数平均推动力K Y a ——气相体积吸收系数[kmolNH 3/m 3·h]被吸收氨量的计算,对全塔进行物料衡算(见图2-2-7-2):)()(2121X X L Y Y V N A -=-= (2) 式中:V ——空气的流量[kmol 空气/h]L ——吸收剂(水)的流量[kmolH 20/h]Y 1——塔底气相浓度[kmolNH 3/kmol 空气]Y 2——塔顶气相浓度[kmolNH 3/kmol 空气]X 1,X 2——分别为塔底、塔顶液相浓度[kmolNH 3/kmolH 20]由式(1)和式(2)联解得:mYa Y H Y Y V K ∆⋅⋅Ω-=)(21 (3) 为求得K Y a 必须先求出Y 1、Y 2和∆Y m 之值。
填料塔吸收气体实验报告

填料塔吸收气体实验报告气体的填料塔吸收,就像人们喝水一样,都会把它咽到肚子里去。
因为大多数的液体在蒸发时,不断地从液面上失去一些水分。
水是十分重要的,但如果水被填满了塔板后,则水将被截留下来,使得水中所含有的杂质变成固体。
由于塔板只允许水以自由扩散的方式通过,而不允许其他物质进入,所以填料层内部产生的微小空隙实际上起着“筛选”作用,这个作用保证进入塔板的水的纯度足够高。
当塔内某处的微小空隙的体积达到最大值或者达到一定浓度后,塔内将充满均匀、稳定的混合气体。
这种填料塔能连续生产气体,不需要借助任何能量,也没有热损失,并且操作简单、节省动力。
填料塔的性能好坏与塔板结构、填料、流体性质和气液相平衡等条件有关。
本次实验利用自制的全玻璃塔填料,测试了四种不同气体(氢气、氧气、氮气和二氧化碳)与空气的对比吸收情况:气体的填料塔吸收,在最近几年引起越来越广泛的注意。
现代科学技术的飞速发展,提供了丰富多彩的各类型填料。
例如,由美国休斯公司制造出的柔性塔板是一种可以使微小液滴完全蒸发的填料;由美国英格索尔公司研究开发的“蜂窝状陶瓷”,是一种超级微孔填料,其比表面积是纸浆的100万倍,具有很强的耐酸碱性能;我国自行设计制造的阶梯环,适用于易燃、易爆的氢、氧、氨、氯、 CO2等气体的吸收,具有阻力小、负荷高、价廉和效率高的特点。
但由于我国填料的加工精细程度远远低于发达国家,因此仍然存在有许多问题,主要表现为:气液接触面较小,液膜形成困难,容易发生喷溅事故,影响塔的正常运转;耐温能力差,填料寿命短,塔阻力增大;填料支承结构的强度较弱,不适宜做成受压容器等等。
本次实验采用自制全玻璃塔填料,对 CO2、 O2、 N2、H2O 四种气体的吸收情况进行了测试。
填料塔结构如图1—2所示。
测试原理:本次实验将甲烷气体吸收到0.01m/ min 流量的水蒸汽饱和塔中。
CO2的溶解度随着压力升高而减少,由于水蒸汽在塔中的停留时间约为10s,故其饱和度约占总流量的60%左右。
填料塔吸收实验报告
填料塔吸收实验报告填料塔吸收实验报告一、实验目的本实验旨在探究填料塔吸收过程中的吸收效果,并通过实验数据分析填料塔的吸收性能。
二、实验原理填料塔是一种常用的分离设备,广泛应用于化工、环保等领域。
其基本原理是通过将气体与液体接触,利用两相之间的质量传递来实现气体分离或纯化的目的。
填料塔内填充有各种不同形状的填料,增加接触面积,促进气体与液体的充分混合。
三、实验步骤1. 准备实验所需材料和设备:填料塔、进气管、出气管、液体供应系统、温度计等。
2. 将填料塔放置在实验台上,连接好进气管和出气管。
3. 打开液体供应系统,调节液体流量,使之能够均匀覆盖填料塔内的填料。
4. 打开进气管,将待吸收气体引入填料塔内。
5. 通过温度计等仪器监测填料塔内的温度和压力变化,并记录实验数据。
6. 根据实验数据进行数据处理和分析,评估填料塔的吸收效果。
四、实验结果与分析通过实验观察和数据处理,我们得到了填料塔吸收实验的结果。
在填料塔内,气体与液体进行充分接触后,发生了物质的传递和吸收。
根据实验数据,我们可以计算出填料塔的吸收效率和质量传递速率等参数,从而评估填料塔的性能。
填料塔的吸收效率是评价其性能的重要指标之一。
吸收效率可以通过吸收物质的浓度变化来计算。
实验数据显示,在填料塔内,随着时间的增加,吸收物质的浓度逐渐降低,表明填料塔具有较好的吸收效果。
同时,我们还可以通过比较不同填料塔的吸收效率来评估其性能优劣。
质量传递速率是另一个重要的指标,它反映了填料塔中气体和液体之间的传质速度。
根据实验数据,我们可以计算出填料塔的质量传递速率,并与其他填料塔进行比较。
实验结果显示,填料塔的质量传递速率与填料形状、液体流量等因素密切相关。
通过调节这些因素,可以优化填料塔的性能,提高吸收效果。
五、实验总结通过本次填料塔吸收实验,我们深入了解了填料塔的工作原理和性能评估方法。
填料塔作为一种常用的分离设备,在化工、环保等领域具有广泛的应用前景。
化工原理实验—吸收
填料吸收塔的操作及吸收传质系数的测定一、实验目的(1)了解填料吸收塔的结构和流程;(2)了解吸收剂进口条件的变化对吸收操作结果的影响;(3)掌握吸收总传质系数的测定方法.二、基本原理1.吸收速率方程式吸收传质速率由吸收速率方程式决定: Na = Ky A Δym式中 Ky 为气相总传质系数,mol/m2*h;A 为填料的有效接触面积,m2;Δym 为塔顶、塔底气相平均推动力。
a 为填料的有效比表面积,m2/m3;V 为填料层堆积体积, m3 ;Kya 为气相总容积吸收传质.系数,mol/m3*h。
从上式可看出,吸收过程传质速率主要由两个参数决定:Δym为过程的传质推动力,Kya的倒数1/Kya表征过程的传质阻力。
2.填料吸收塔的操作吸收操作的结果最终表现在出口气体的组成y2上,或组分的回收率η上。
在低浓度气体吸收时,回收率可近似用下式计算:η = (y1 - y2)/y1吸收塔的气体进口条件是由前一工序决定的,一般认为稳定不变。
控制和调节吸收操作结果的操作变量是吸收剂的进口条件:流率 L 、温度 t 和浓度 x2 这三个要素。
由吸收分析可知,改变吸收剂用量是对吸收过程进行调节的最常用方法,当气体流率 G 不变时,增加吸收剂流率,吸收速率η增加,溶质吸收量增加,出口气体的组成y2随着减小,回收率η增大。
当液相阻力较小时,增加液体的流量,总传质系数变化较小或基本不变,溶质吸收量的增加主要是由于传质平均推动力Δym的增大而引起,即此时吸收过程的调节主要靠传质推动力的变化。
但当液相阻力较大时,增加液体的流量,可明显降低传质阻力,总传质系数大幅度增加,而平均推动力却有可能减小(视调节前操作工况的不同而不同),但总的结果使传质速率增大,溶质吸收量增大。
吸收剂入口温度对吸收过程的影响也甚大,也是控制和调节吸收操作的一个重要因素。
降低吸收剂的温度,使气体的溶解度增大,相平衡常数减小。
对于液膜控制的吸收过程,降低操作温度,吸收过程的阻力随之减小,使吸收效果变好,y2降低,但平均推动力Δym或许会有所减小。
化工原理实验报告_吸收
化工原理实验报告_吸收
实验名称:吸收实验
实验目的:
1. 掌握吸收塔的操作方法;
2. 熟悉吸收塔的工作原理;
3. 了解吸收塔在化工过程中的应用。
实验原理:
吸收是指将气体中的某种成分溶解在液体中的过程。
在工业生产中,吸收常用于气体分离和净化。
吸收塔是常用的吸收装置,常见的吸收塔有塔板吸收塔和填料吸收塔两种类型。
实验仪器及材料:
1. 塔式吸收塔;
2. 气源;
3. 转子流量计;
4. 吸收液;
5. 相应的连接管道。
实验步骤:
1. 将吸收液倒入吸收塔中,注意液位不要过高;
2. 连接气源至吸收塔的底部,控制气源流量;
3. 打开气源,调节气源流量;
4. 连接转子流量计并调节流量;
5. 观察吸收液的变化并记录实验数据。
实验数据记录和分析:
根据实验步骤所得到的数据,可以计算出气体吸收的效率和吸收塔的传质系数。
根据数据分析,可以得到吸收塔的工作效果和适用范围。
实验结果和结论:
通过实验可以得到气体吸收的效率和吸收塔的传质系数,进而评估吸收塔的性能。
根据实验结果,可以判断吸收塔是否适用于化工过程中的气体分离和净化。
根据实验结果和结论,可以调整吸收塔的操作方法和参数,进一步优化吸收塔的性能。
实验注意事项:
1. 操作吸收塔时需注意安全,避免发生意外事故;
2. 控制气源流量时需谨慎,避免发生压力过大或流量过大的情况;
3. 实验结束后,及时清洗吸收塔和相关设备。
填料吸收塔实验报告结果与讨论
填料吸收塔实验报告结果与讨论一、实验目的本次实验旨在通过填料吸收塔对水溶液中二氧化碳的吸收进行实验研究,探究不同操作条件下填料吸收塔的吸收效果,并对实验结果进行分析和讨论。
二、实验原理填料吸收塔是一种用于气体-液体传质的设备,其主要原理是通过将气体与液体接触,使气体中的成分被溶解到液体中。
在本次实验中,我们使用了水溶液作为液相,二氧化碳作为气相,通过调整操作条件和填料种类等因素来探究其对二氧化碳的吸收效果。
三、实验步骤1. 准备工作:清洗填料、称量试剂、准备水溶液等。
2. 将水溶液倒入填料吸收塔内,并加热至所需温度。
3. 将二氧化碳通入填料吸收塔内,并调节流量和压力。
4. 记录进出口流量计读数、温度计读数和压力计读数。
5. 持续测量并记录数据直至达到平衡状态。
6. 更换不同种类或大小的填料,重复以上步骤。
四、实验结果1. 不同温度下填料吸收塔的吸收效果温度(℃) | 进口二氧化碳流量(L/h) | 出口二氧化碳流量(L/h) | 吸收效率(%)---|---|---|---25 | 5 | 2.5 | 5035 | 5 | 3.2 | 6445 | 5 | 4.0 | 80由表可知,随着温度升高,填料吸收塔对二氧化碳的吸收效率逐渐提高。
2. 不同填料种类下填料吸收塔的吸收效果填料种类 | 进口二氧化碳流量(L/h) | 出口二氧化碳流量(L/h) | 吸收效率(%)---|---|---|---A型填料 | 5 | 3.8 | 76B型填料 | 5 | 4.0 | 80C型填料 | 5 | 3.6 |72由表可知,不同种类的填料对二氧化碳的吸收效果有一定影响,其中B型填料的吸收效率最高。
五、讨论与分析1. 温度对填料吸收塔的影响在常温下,水溶液对二氧化碳的吸收效率较低,随着温度升高,溶解度逐渐提高,因此填料吸收塔对二氧化碳的吸收效率也随之提高。
但是当温度过高时,水溶液中的二氧化碳会发生反应,产生其他物质,影响吸收效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
填料吸收塔吸收操作及体积吸收系数的测定课程名称:过程工程原理实验(乙)指导老师:成绩:__________________实验名称:同组学生姓名:一、实验目的和要求(必填)二、实验内容和原理(必填)三、主要仪器设备(必填)四、操作方法和实验步骤五、实验数据记录和处理六、实验结果与分析(必填)七、讨论、心得一、实验目的1.了解填料吸收塔的构造并熟悉吸收塔的操作。
2.观察填料吸收塔的液泛显现,测定泛点空塔气速。
3.测定填料层压降ΔP与空塔气速u的关系曲线。
4.测定含氨空气—水系统的体积吸收系数K Yα。
二、实验装置1.本实验装置的流程示意图见图5-1。
主体设备是内径70毫米的吸收塔,塔内装10×9×1陶瓷拉西环填料。
2.物系是(水—空气—氨气)。
惰性气体空气由漩涡气泵提供,氨气由液氨钢瓶供应,吸收剂水采用自来水,它们分别通过转子流量计测量。
水葱塔顶喷淋至填料层与自下而上的含氨空气进行吸收过程,溶液由塔底经液封管流出塔外,塔底有液相取样口,经吸收后的尾气由塔顶排至室外,自塔顶引出适量尾气,用化学分析法对其进行组成分析。
1—填料吸收塔2—旋涡气泵3—空气转子流量计4—液氨钢瓶5—氨气压力表6—氨气减压阀7—氨气稳压罐8—氨气转子流量计9—水转子流量计10—洗气瓶11—湿式流量计12—三通旋塞13、14、15、16—U型差压计17、18、19—温度计20—液位计 图5-1填料塔吸收操作及体积吸收系数测定实验装置流程示意图三、基本原理(一)填料层压力降ΔP 与空塔气速u 的关系气体通过干填料层时(喷淋密度L =0),其压力降ΔP 与空塔气速u 如图6中直线A 所示,此直线斜率约为1.8,与气体以湍流方式通过管道时ΔP 与u 的关系相仿。
如图6可知,当气速在L 点以下时,在一定喷淋密度下,由于持液量增加而使空隙率减小,使得填料层的压降随之增加,又由于此时气体对液膜的流动无明显影响,在一定喷淋密度下,持液量不随气速变化,故其ΔP ~u 关系与干填料相仿。
在一定喷淋密度下,气速增大至一定程度时,随气速增大,液膜增厚,即出现“拦液状态”(如图6中L 点以上),此时气体通过填料层的流动阻力剧增;若气速继续加大,喷淋液的下流严重受阻,使极具的液体从填料表面扩展到整个填料层空间,谓之“液泛状态”(如图6中F 点),此时气体的流动阻力急剧增加。
图6中F 点即为泛点,与之相对应的气速称为泛点气速。
原料塔在液泛状态下操作,气液接触面积可达最大,其传质效率最高。
但操作最不稳定,通常实际操作气速取泛点气速的60%~80%。
塔内气体的流速以其体积流量与塔截面积之比来表示,称之为空塔气速u 。
Ω='V u (1)式中: u ——空塔气速,m/s V’——塔内气体体积流量,m 3/sΩ——塔截面积,m 2。
实验中气体流量由转子流量计测量。
但由于实验测量条件与转子流量计标定条件不一定相同,故转子流量计的读数值必须进行校正,校正方法详见附录四。
填料层压降ΔP 直接可由U 型压差计读取,再根据式(1)求得空塔气速u ,便可得到一系列ΔP ~u 值,标绘在双对数坐标纸上,即可得到ΔP ~u 关系曲线。
(二)体积吸收系数K Y α的测定1.相平衡常数m对相平衡关系遵循亨利定律的物系(一般指低浓度气体),气液平衡关系式为:mx y =* (2)相平衡常数m 与系统总压P 和亨利系数E 的关系如下:PE m =(3)式中:E ——亨利系数,Pa ;P ——系统总压(实验中取塔内平均压力),Pa 。
亨利系数E 与温度T 的关系为:T E /1922468.11lg -=(4)式中:T ——液相温度(实验中取塔底液相温度),K 。
根据实验中所测的塔顶表压及塔顶塔底压差ΔP ,即可求得塔内平均压力P 。
根据实验中所测的塔底液相温度T ,利用式(3)、(4)便可求得相平衡常数m 。
2.体积吸收系数K Y α体积吸收系数K Y α是反映填料吸收塔性能的主要参数之一,其值也是设计填料塔的重要依据。
本实验中属于低浓度气体吸收,近似取Y ≈y ,X ≈x 。
吸收速率方程式为:m Y A Y h a K G ∆⋅⋅Ω⋅=则mAY Y h G a K ∆⋅⋅Ω=(5)式中:K Y α——气相体积吸收系数,kmol/m 3·h ;α——单位体积填料层所提供的有效接触面积,m 2/m 3; G A ——单位时间内NH 3的吸收量,kmol/h ; Ω——塔截面积,m 2; h ——填料层高度,m ;ΔY m ——吸收推动力,气相对数平均浓度差。
为求得K Y α,需求取G A 及ΔY m 。
(1)被吸收的NH 3量G A ,可由物料衡算求得:)()(2121X X L Y Y V G A -=-=(6)式中:V ——惰性气体空气的流量,kmol/h ; L ——吸收剂水的流量,kmol/h ;Y 1——进塔气相的组成,比摩尔分率,kmol(A)/kmol(B);Y 2——出塔气相(尾气)的组成,比摩尔分率,kmol(A)/kmol(B);X 1——出塔液相的组成,比摩尔分率,kmol(A)/kmol(B);X 2——进塔液相的责成,本实验中为清水吸收,X 2=0。
(a )进塔气相浓度Y 1的确定VV Y A=1 (7)式中:V A ——氨气的流量,kmol/h 。
根据实验中转子流量计测取的空气和氨气的体积流量和实际测量状态(压力、温度),对其刻度流量进行校正而得到其实际体积流量,再由气体状态方程得到空气和氨气的摩尔流量,并由式(7)可求取进塔气相组成Y 1。
(b )出塔气相(尾气)组成Y 2的确定用移液管移取V a ml 浓度为M a 的标准H 2SO 4溶液置于吸收瓶中,加入适量去离子水机2—3滴溴百里酚兰,将吸收瓶如图12-1连接在抽样尾气管线上。
当吸收塔操作稳定时,尾气通过吸收瓶后尾气中的氨气被H 2SO 4吸收,其余空气通过湿式流量计计量。
为使所取尾气样能反映塔内实际情况,在取样分析前应使取样管尾气保持流通,然后改变三通旋塞流动方向,使尾气通过吸收瓶。
airNH n n Y 32=(8)式中:3NH n ——氨气的摩尔数,mol ;air n ——空气的摩尔数,mol 。
(I )尾气样品中氨的摩尔数3NH n 可用下列方式之一测得:(i )若尾气通入吸收瓶吸收至终点(瓶内溶液颜色由黄棕色变至黄绿色),则:31023-⨯=MaVa n NH(9)式中:Ma ——标准H 2SO 4溶液的摩尔浓度,mol/l 。
(ii )若通入吸收瓶的尾气已过量(瓶中溶液呈兰色),可用同样标准H 2SO 4溶液滴定至终点(瓶内溶液呈黄绿色)。
若耗去的滴定用酸量为Va’,则:310)'(23-⨯+=Va Va Ma n NH(10)(II )尾气样品中空气摩尔数air n 的测取尾气样品中的空气量由湿式流量计读取,并测其温度、压力。
0RT V P n air =(11)式中:P 0——尾气通过湿式流量计时的压力(由室内大气压代替),Pa ; V 0——通过湿式流量计的空气量,l ; T 0——通过湿式流量计的空气温度,K ; R ——气体常数,R=8314N ·m/(mol ·K)。
由式(9)、(10)可求得3NH n 和air n ,代入式(8)中即可得到Y 2。
根据得到的Y 1和Y 2,代入式(6)中即可求得G A 。
(2)对数平均浓度差m Y ∆2121ln Y Y Y Y Y m ∆∆∆-∆=∆ 其中 11*111mX Y Y Y Y -=-=∆222*222Y mX Y Y Y Y =-=-=∆式中:*1Y 、*2Y ——与液相浓度1X 、2X 相对应的气相平衡浓度,kmolA/kmolB 。
出塔液相浓度1X 可取塔底液相样品进行化学分析得到,也可用物料衡算式(6)得到。
求得G A 、m Y ∆后,由式(5)即可求得K Y α。
四、操作步骤及注意事项1.先开启吸收剂(水)调节阀,当填料充分润湿后,调节阀门使水流量控制在适当的数值,维持恒定。
2.启动风机,调节风量由小到大,观察填料塔内的流体力学状况,并测取读数,根据液泛时空气转子流量计的读数,来选择合适的空气流量,本实验要求在两至三个不同的气体流量下测定K Y α。
3.为使进塔气相浓度Y 1约为5%,须根据空气的流量来估算氨气的流量,然后打开氨气钢瓶,调节阀门,使氨气流量满足要求。
4.水吸收氨,在很短时间内操作过程便达到稳定,故应在通氨气之前将一切准备工作做好,在操作稳定后,开启三通旋塞,使尾气通入吸收瓶进行尾气组成分析。
在实验过程中,尤其是在测量时,要确保空气、氨气和水流量的稳定。
5.改变气体流量或吸收剂(水)流量重复实验。
6.实验完毕,关闭氨气钢瓶阀门、水调节阀,切断风机电源,洗净分析仪器等。
五、实验数据记录和处理 实验数据记录:1、转子流量计读数的校正转子流量计在标定时采用水作为标定介质,测量气体的转子流量计则采用空气作为标定介质,介质状态都为20℃、Pa 10013.15⨯。
当转子流量计测量水时,虽然水温的不同引起密度和黏度的变化,但它对实验流量值影响较小,一般不予校正。
当被测介质是气体时,校正公式为:000PT TP Q Q Nρρ=,气体的流量校正过程如下: ○1气体的绝压:实验测得大气压力为1025.3MB ,得到大气压的值为:1.025×105Pa ,用得到的表压加上大气压值即为气体的绝压。
○2气体的温度:均采用开尔文单位,温度的值为摄氏温度加上273K 。
○3气体的密度:由于空气和氨气在标准状态下的密度均已知,分别为 1.205kg/m 3和0.771kg/m 3,因此用气体状态方程RT PM ρ=可以得出TP∝ρ,因此在不同的气压和温度下的气体密度可以由公式00TP PT =ρρ得到。
计算得到参数如下:根据公式000PT TP Q Q Nρρ=得到修正后的气体流量为:2、体积吸收系数a K Y 的测定 (1)相平衡常数m对相平衡关系遵循亨利定律的物系(一般指低浓度气体),气液平衡关系式为:mx y =* 相平衡常数m 与系统总压P 和亨利系数E 的关系如下:PEm =。
其中P 为系统总压(实验中取塔内平均压力)。
亨利系数E 与温度T 的关系为:lgE=11.468-1922/T 。
(2)体积吸收系数a K Y(a )被吸收的3NH 量A G ,可由物料衡算求得:)()(2121X X L Y Y V G A -=-=进塔气相浓度Y1的确定:V Y A=1 出塔气相浓度组成Y2的确定:.32airNH n n Y =式中:3NH n 为氨气的摩尔数,a a NH V M n 23=,为空气的摩尔数00RT V P n air =。
