sp杂化轨道成键特征-西安建筑科技大学
杂化轨道理论要点
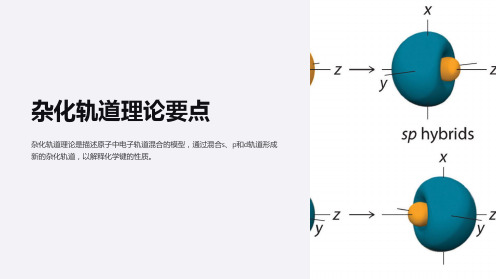
sp杂化轨道是s轨道和一个p轨道的线性组合, 形成两个等价的sp杂化轨道。
除了sp3、sp2和sp杂化轨道外,还存在其他 类型的杂化轨道,如dsp3、sp3d等。
杂化轨道的形成原理
1
轨道杂化形成过程
2
通过改变s和p轨道的比例和重叠程度,
可以形成具有不同方向性和能量的杂化
轨道。
3
电子排斥原理
电子在轨道中相互排斥,若s和p轨道重 叠,会使电子能量增加,因此形成了杂 化轨道。
能量最低原则
形成的杂化轨道应具有最低能量,以保 持系统的稳定性。
sp3杂化轨道
形状
应用
sp3杂化轨道呈四面体形状,分布在空间中四个等角。 sp3杂化轨道解释了甲烷分子中碳原子与四个氢原子 形成的四条等长和等角的化学键。
sp2 杂化轨道
形状
sp2杂化轨道呈平面三角形形 状,与未杂化的p轨道垂直。
应用
杂化轨道用于描述共价键中 电子的空间分布与方向性。
杂化轨道的类型
1 sp3杂化道
2 sp2杂化轨道
sp3杂化轨道是s轨道和三个p轨道的线性组合, 形成四个等价的sp3杂化轨道。
sp2杂化轨道是s轨道、两个p轨道和一个未杂 化的p轨道的线性组合,形成三个等价的sp2 杂化轨道。
3 sp杂化轨道
4 其他类型
sp2杂化轨道解释了烯烃分子 中碳原子之间形成的双键和 单键的几何构型。
π键
未杂化的p轨道形成了烯烃分 子中的π键。
sp杂化轨道
1
形状
sp杂化轨道呈直线形状,与未杂化的p轨道平行。
2
应用
sp杂化轨道解释了炔烃分子中碳原子之间形成的三键和单键的几何构型。
3
π键
杂化轨道的类型

AX3型 (BF3) 平面三角形
AX4型 (CH4) 正四面体 AX5型 ( PCl5 )
双三角锥形
AX6型 ( SF6) 正八面体型
(2) 中心原子有孤对电子 当中心原子有孤对电子时,分子中价电子 的分布仍保持上述基本类型的空间结构。 但由于孤对电子只受一个原子的吸引,电 子云偏向中心原子,对其它价电子有更强 的排斥作用,而使键角和分子构型有所改 变。
(1)在分子中,电子不再从属于某个特定的原子, 而是在整个分子范围内运动,因此分子中电 子的运动应用分子轨道波函数(简称分子轨 道)来描述。
(2) 分子轨道是由分子中原子轨道线性组合而成。 分子轨道的数目和组合前的原子轨道数目 相等。
(3) 原子轨道组合成有效的分子轨道必须遵守的 条件
① 对称性匹配原则
2s
杂化
成键
+ 4H Sp3 杂化轨道
CH4分子
杂化 成键
2、杂化轨道的类型 (1) sp 杂化轨道和dsp杂化轨道
直线 平面三角形
四面体 三角双追 八面体
(2) 等型杂化和不等型杂化 等性杂化:参与杂化的原子轨道均为具有不
成对电子的轨道 不等性杂化:参与杂化的原子轨道不仅包含不
成对电子的轨道,也包含成对电子 的轨道。如NH3分子中的杂化轨道 孤对电子占有的杂化轨道不参与成 键作用
§2.3 轨道杂化理论 ( Pauling, 1931) Hybridization Theory
1、轨道的杂化
在同一个原子中能量相近的不同类型的几 个原子轨道在成键时可以相互叠加而组成同等 数量的能量完全相同的杂化原子轨道
原子形成杂化轨道的一般过程
激发 杂化
轨道重叠
CH4分子的形成 2p
杂化轨道理论介绍课件

演讲人
01.
02.
03.
04.
目录
杂化轨道理论基础
杂化轨道理论的应用
杂化轨道理论的局限性
杂化轨道理论的发展
杂化轨道理论基础
杂化轨道的概念
01
杂化轨道是原子中电子所处的能量和空间分布状态
02
杂化轨道的形成是由于原子中电子的相互作用和能量最低原理
03
杂化轨道可以描述原子中电子的成键行为和化学性质
指导合成路线设计
预测反应产物:根据杂化轨道理论,预测化学反应的产物和反应机理
优化反应条件:通过杂化轨道理论,优化反应条件,提高反应效率和产率
设计新型催化剂:利用杂化轨道理论,设计新型催化剂,提高催化性能
指导药物设计:根据杂化轨道理论,设计新型药物分子,提高药物疗效和降低副作用
杂化轨道理论的局限性
杂化轨道理论可以解释分子的化学性质
杂化轨道理论可以解释分子的物理性质
杂化轨道理论可以解释分子的几何构型
02
03
04
01
预测化学反应
3
2
4
1
杂化轨道理论可以预测化学反应的产物和反应速率
杂化轨道理论在药物设计和合成中有广泛的应用
利用杂化轨道理论可以预测化学反应的机理和途径
杂化轨道理论可以帮助我们理解化学反应的立体化学性质
sp3d2杂化:由一个s轨道和三个p轨道和两个d轨道组合而成,形成六个能量相同的杂化轨道
杂化轨道的稳定性
杂化轨道的形成:原子轨道的线性组合
杂化轨道的稳定性:能量较低,稳定性较高
杂化轨道的种类:sp、sp2、sp3等
杂化轨道的应用:解释分子结构和化学键的形成
杂化轨道理论的应用
杂化轨道的类型与分子空间构型
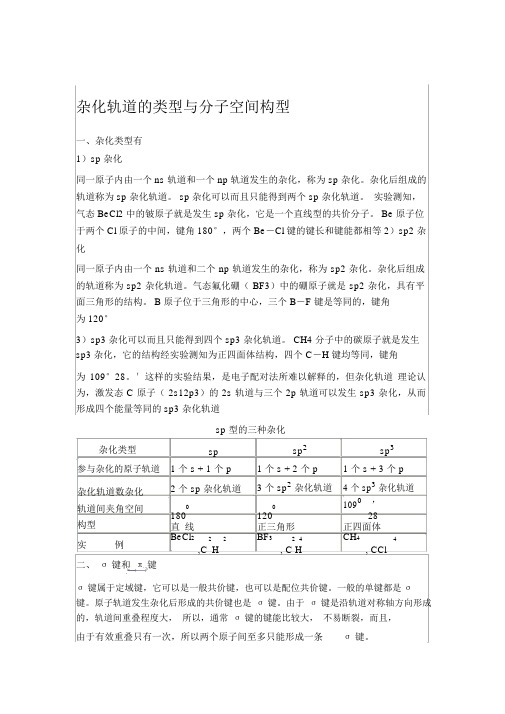
杂化轨道的类型与分子空间构型一、杂化类型有1)sp 杂化同一原子内由一个 ns 轨道和一个 np 轨道发生的杂化,称为 sp 杂化。
杂化后组成的轨道称为 sp 杂化轨道。
sp 杂化可以而且只能得到两个 sp 杂化轨道。
实验测知,气态 BeCl2 中的铍原子就是发生 sp 杂化,它是一个直线型的共价分子。
Be 原子位于两个 Cl 原子的中间,键角 180°,两个 Be-Cl 键的键长和键能都相等2)sp2 杂化同一原子内由一个 ns 轨道和二个 np 轨道发生的杂化,称为 sp2 杂化。
杂化后组成的轨道称为 sp2 杂化轨道。
气态氟化硼( BF3)中的硼原子就是 sp2 杂化,具有平面三角形的结构。
B 原子位于三角形的中心,三个 B-F 键是等同的,键角为 120°3)sp3 杂化可以而且只能得到四个 sp3 杂化轨道。
CH4 分子中的碳原子就是发生sp3 杂化,它的结构经实验测知为正四面体结构,四个 C-H 键均等同,键角为109°28。
′这样的实验结果,是电子配对法所难以解释的,但杂化轨道理论认为,激发态 C 原子( 2s12p3)的 2s 轨道与三个 2p 轨道可以发生 sp3 杂化,从而形成四个能量等同的 sp3 杂化轨道杂化类型参与杂化的原子轨道杂化轨道数杂化轨道间夹角空间构型实例二、σ键和π键sp 型的三种杂化sp sp2 sp31 个 s + 1 个 p 1 个 s +2 个 p 1 个 s +3 个 p2 个 sp 杂化轨道3 个 sp2杂化轨道4 个 sp3杂化轨道0 01090 ’180 120 28直线正三角形正四面体BeCl2 2H2BF3 2 4 CH4, CCl4 ,C , C Hσ键属于定域键,它可以是一般共价键,也可以是配位共价键。
一般的单键都是σ键。
原子轨道发生杂化后形成的共价键也是σ键。
由于σ键是沿轨道对称轴方向形成的,轨道间重叠程度大,所以,通常σ键的键能比较大,不易断裂,而且,由于有效重叠只有一次,所以两个原子间至多只能形成一条σ键。
杂化轨道与反应类型
C1、C5、C6、C7、C8 C4 C2 secondary C 20 ; C3 quarternary C 40
◆ 构象异构体(conformational isomer)
如:乙烷的2种典型构象: (1).交叉式构象(staggered conformer)
H H H
1
H
2
2
C
H C H
H 1 H H
且无其它侧链的烷烃,则按碳原
子总数叫做异某烷(iso- 或i)。
3、若具有基团
CH3 CH3 C CH3
且无其它侧链的含五或六个碳原子
的烷烃,分别命名为新戊烷及新己烷
(neo-)。
系统命名法 (systematic nomenclature)
1、常见烷基(alkyl group, R-)
CH3 甲 基 CH3-CH CH3 异丙 基 (iso-) CH3 CH3CH2 乙 基 CH3 CH3-C 叔 丁基 CH3CH2CH2 正 丙基
+
+ HCl
+H
+ HCl
. CH Cl + Cl2 2
CH2Cl2 + Cl .
.
Cl.
+
H
CHCl2
. CHCl 2
+ HCl
(3) 链 终 止 :
Cl . CH3 . CH3 .
+ Cl .
Cl. CH3 .
Cl2 CH3Cl CH3-CH3
+ +
** Reaction mechanism
(n-)
(tert-)
CH 3-CH 2-CH 2-CH 2- 正丁基(n-)
CH 3-CH 2-CHCH 3
杂化轨道知识点总结归纳

杂化轨道知识点总结归纳杂化轨道理论是描述原子中电子云轨迹的一种模型,它解释了化学键的形成和分子形状的特点。
在化学中,了解和掌握杂化轨道理论是非常重要的。
本文将对杂化轨道的相关知识点进行总结归纳,帮助读者更好地理解这一重要理论。
1. 引言杂化轨道理论是由美国化学家林纳斯·鲍林(Linus Pauling)于20世纪30年代提出的。
它是基于量子力学的电子波动性质,通过混合原子中的原子轨道来描述化学键的形成和分子的几何形状。
2. 杂化轨道的概念杂化轨道是指原子轨道与其他原子轨道通过线性组合形成的新的轨道。
杂化轨道的形成可以进一步解释分子的几何构型。
3. 杂化轨道的种类常见的杂化轨道有sp、sp2和sp3三种类型。
它们分别由一个原子的一个s轨道和一个或多个p轨道线性组合而成。
4. sp杂化轨道sp杂化轨道是由一个s轨道和一个p轨道线性组合而成的。
它常见于含有三键的分子,如氨分子(NH3)和甲烷分子(CH4)。
5. sp2杂化轨道sp2杂化轨道是由一个s轨道和两个p轨道线性组合而成的。
它常见于含有双键的分子,如乙烯分子(C2H4)和苯分子(C6H6)。
6. sp3杂化轨道sp3杂化轨道是由一个s轨道和三个p轨道线性组合而成的。
它常见于含有单键的分子,如甲烷分子(CH4)和乙烷分子(C2H6)。
7. 杂化轨道的形状杂化轨道的形状决定了分子的几何构型。
比如,sp杂化轨道形成的分子倾向于呈线性形状,sp2杂化轨道形成的分子倾向于呈平面三角形形状,sp3杂化轨道形成的分子倾向于呈四面体形状。
8. 杂化轨道与键的特性杂化轨道通过形成和共用电子对,建立了化学键。
它们能够提供更好的重叠,增加键的强度和稳定性。
9. 杂化轨道的应用杂化轨道理论在有机化学、配位化学和分子生物学等领域具有广泛的应用。
它可以帮助我们解释各种化学现象和反应。
10. 小结通过本文对杂化轨道知识点的总结归纳,我们了解到杂化轨道理论可以解释分子形状和化学键的形成。
杂化轨道详细解说
杂化轨道详细解说杂化轨道理论是由鲍林(L. Pauling)于1931年提出的。
其是指在形成分子时,由于原子间的相互作用,同一原子中能量相近的某些原子轨道,在成键过程中重新分配能量和空间方向,组合成一系列形状、能量完全相同的新轨道而改变了原有轨道的状态,这一过程称为轨道杂化(Hybridization),所形成的新轨道叫作杂化轨道(Hybrid Orbit)。
根据参与杂化的原子轨道种类不同,杂化方式可分为sp型杂化、spd型杂化和dsp型杂化等。
根据杂化轨道是否完全相同又可分为等性杂化与不等性杂化。
其中sp型杂化可分为sp³杂化、sp²杂化和sp杂化,spd型杂化可分为sp²d杂化、sp³d杂化、sp³d²杂化等,dsp型杂化可分为dsp²杂化、dsp³杂化、d²sp³杂化等。
杂化轨道理论的提出丰富和发展了现代价键理论。
发展历程1861年,奥古斯特·凯库勒(August Kekule)提出在有机化合物中碳的四价概念。
1874年,范特霍夫(Vant Hoff)和勒贝尔(Lebel)提出了四面体学说,认为有机化合物中饱和碳原子上的4个共价键是以原子核为中心,指向正四面体的4个顶点。
1931年,鲍林(L. Pauling)和斯莱脱(Slater)在价键理论的基础上提出了杂化轨道理论,用数学方法建立了包括碳原子在内的许多原子轨道的立体模型,阐述了甲烷正四面体构型形成的理由。
1953年,中国化学家唐敖庆等统一处理了s、p、d、f轨道杂化,提出了杂化轨道一般方法,进一步丰富了杂化轨道理论的内容。
基本内容1.在形成分子时,由于原子间的相互作用,同一原子中能量相近的某些原子轨道,在成键过程中重新分配能量和空间方向,组合成一系列形状、能量完全相同的新轨道而改变了原有轨道的状态,这一过程称为轨道杂化,所形成的新轨道叫作杂化轨道,每个杂化轨道中均含有一个电子。
杂化轨道详细解说
杂化轨道详细解说在成键过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新的原子轨道,这种轨道重新组合的过程称为杂化(hybridization),杂化后形成的新轨道称为杂化轨道(hybrid orbital)。
杂化,是原子形成分子过程中的理论解释,具体有sp(如BeCl2)、sp(如BF3)、sp(如CH4)、spd(如PCl5)、spd(如SF)杂化等等。
核外电子在一般状态下总是处于一种较为稳定的状态,即基态。
而在某些外加作用下,电子也可以吸收能量变为一个较活跃的状态,即激发态。
在形成分子的过程中,由于原子间的相互影响,在能量相近的两个电子亚层中的单个原子中,能量较低的一个或多个电子会激发而变为激发态,进人能量较高的电子亚层中,即所谓的跃迁现象,从而形成一个或多个能量较高的电子亚层。
此时,这一个与多个原来处于较低能量的电子亚层的电子所具有的能量增加到和原来能量较高的电子亚层中的电子相同。
这样,这些电子的轨道便混杂在一起,这便是杂化,而这些电子的状态也就是所谓的杂化态。
简言之,即某原子成键时,在键合原子的作用下,价层中若干个能级相近的原子轨道有可能改变原有的状态,混杂起来并重新组合成一组有利于成键新轨道,称为杂化轨道。
这一过程称为原子轨道的杂化,简称杂化。
同一原子中能量相近的n个原子轨道。
组合后只能得到n个杂化轨道。
例如,同一原子的1个s轨道和1个p轨道,只能杂化成2个SP杂化轨道。
杂化轨道与原来的原子轨道相比,其角度分布及形状均发生了变化,— 1 —能量也趋于平均化。
但比原来未杂化的轨道成键能力强,形成的化学键的键能大,使生成的分子更稳定。
— 2 —。
杂化轨道_sp_sp2_sp3
杂化轨道杂化轨道理论(hybrid orbital theory)杂化轨道理论(hybrid orbital theory)是1931年由鲍林(Pauling L)等人在价键理论的基础上提出,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
1.在成键的过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化(hybridization),杂化后形成的新轨道称为杂化轨道(hybrid orbital)。
2.杂化轨道的角度函数在某个方向的值比杂化前的大得多,更有利于原子轨道间最大程度地重叠,因而杂化轨道比原来轨道的成键能力强(轨道是在杂化之后再成键)。
电子云的形状3.杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定。
不同类型的杂化轨道之间夹角不同,成键后所形成的分子就具有不同的空间构型。
类型简介理论基础按参加杂化的原子轨道种类,轨道杂化有sp和spd两种主要类型,分为sp杂化电子云图sp,sp2,sp3,dsp2,sp3d,sp3d2,d2sp3,按杂化后形成的几个杂化轨道的能量是否相同,轨道的杂化可分为等性和不等性杂化。
于1931年,鲍林提出一个原子中的几个原子轨道经过再分配而组成的互相等同的轨道。
原子在化合成分子的过程中,根据原子的成键要求,在周围原子影响下,将原有的原子轨道进一步线性组合成新的原子轨道。
这种在一个原子中不同原子轨道的线性组合,称为原子轨道的杂化。
杂化后的原子轨道称为杂化轨道。
杂化时,轨道的数目不变,轨道在空间的分布方向和分布情况发生改变。
组合所得的杂化轨道一般均和其他原子形成较强的σ键或安排孤对电子,而不会以空的杂化轨道的形式存在。
在某个原子的几个杂化轨道中,全部由成单电子的轨道参与的杂化,称为等性杂化轨道;有孤对电子参与的杂化,称为不等性杂化轨道。
sp杂化轨道的特点及应用
sp杂化轨道的特点及应用杂化轨道是指由不同的原子轨道混合形成的新的轨道,它们具有新的能量与方向特性。
SP杂化轨道是常见的一种杂化轨道,由一个s轨道和一个p轨道混合形成。
本文将介绍SP杂化轨道的特点以及其在化学领域中的应用。
一、SP杂化轨道的特点SP杂化轨道的形成发生在碳原子中。
在碳原子中,2s轨道和2个2p轨道会进行杂化,形成两个SP杂化轨道和两个未杂化的2p轨道。
SP杂化轨道的特点如下:1. 方向性:SP杂化轨道呈线性排列,与碳原子构成的化学键的方向一致,使得化学键具有方向性。
2. 异性:SP杂化轨道在方向和能量上与s轨道和p轨道都不同,因此可以与不同性质的原子轨道形成特异的化学键。
二、SP杂化轨道的应用1. 有机化学中的碳碳双键:由于SP杂化轨道的方向性和强极化性质,碳原子通过SP杂化轨道形成的π键可以更牢固地连接两个碳原子,使得碳碳双键在化学反应中更加稳定。
2. 碳氢键的形成:SP杂化轨道使碳原子形成的化学键具有方向性,从而能够有效地形成碳氢键。
碳氢键是有机物中最常见的键,其稳定性和方向性对于有机化学的研究和应用具有重要意义。
3. 分子几何结构的确定:SP杂化轨道的形成使得分子中各个原子的空间排布更加有规律。
通过分析SP杂化轨道的方向性,可以推测出分子的立体化学结构,为合成新的化合物和理解化学反应机理提供了重要的理论依据。
4. 金属配合物的形成:SP杂化轨道在金属配合物中的应用也非常广泛。
金属配合物中的配位键由金属中心原子与配位体的杂化轨道形成,SP杂化轨道的方向性和异性使得金属配合物具有特定的空间结构和反应性质,对于催化剂、光电材料等领域具有重要作用。
5. 分子轨道理论的基础:SP杂化轨道的形成为分子轨道理论提供了基础。
通过杂化轨道的描述,可以更好地理解分子的电子结构和化学性质,为量子化学的研究提供了一种重要的理论工具。
总结:SP杂化轨道具有方向性强、能量独特的特点,使其在化学领域中得到广泛的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制作:张思敬等
理学院化学系
5
课件内容
第1章 化学的发展 第2章 物质结构基础 第7章 电化学 金属材料腐蚀 第8章 金属化学与材料
第3章 气体反应 大气污染
第4章 热化学 能源
第9章 非金属化学与材料
第10章 高分子化合物与材料
第5章 水溶液中的反应 水污染
第6章 配位化合物
第11章 表面与胶体化学
杂化轨道理论.
新理论必须解决如 下问题
制作:张思敬等
理学院化学系
8
第2章 物质结构基础
Chapter 2 Basic of Substance Structure
本章教学要求
1. 了解原子核外电子运动的基本特征,明确量子数的取值规 律,了解原子轨道和电子云的空间分布。 2. 掌握核外电子排布的一般规律及其与元素周期表的关系。 3. 了解化学键的本质及键参数的意义。 4. 了解杂化轨道理论的要点,能应用该理论判断常见分子 的空间构型、极性等。 5. 了解分子间作用力以及晶体结构与物质物理性质的关系。
B
88
C
77
N
74
O F
66 64
Na Mg
191 160
Al Si P S
143 118 110 104
Cl
99
K
235
Ca Sc Ti V
197 164 147 135
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
129 137 126 125 125 128 137 153 122 121 104 114
“ 过去,对光过分强调波性而忽视 它的粒性;现在对电子是否存在另 一种倾向,即过分强调它的粒性而 忽视它的波性.”
制作:张思敬等
h = 6.626醋 10h 为Planck 常量
34
J s
这就是著名的 德布罗依关系式.
理学院化学系 12
Atomic radii (in pm)
Li Be
157 112
制作:张思敬等
理学院化学系
3
本课件主要内容涉及化学的发展简史、化学 热力学、化学动力学、电化学、物质结构、功能 材料、表面与胶体以及生命活动与化学共12章。 每章结构以教学要求、教学内容、正文及小结组
成。为使用配套教材的广大教师提供了一个可操
作的平台,便于教师按照不同的教学要求和教学 内容进行剪裁、补充和组织,从而达到适合不同 类型学校各类教师备课的目的。
理学院化学系
13
(2)价键理论的局限
两个问题 问题1:C原子的共价数与其原子结构。 根据共价键理论,C原子的外层原子轨道上有4个电 子,2个在2s轨道上,已成对,2个平行占据2p轨道的电子 未成对,共价数应为2。然而事实上C原子的共价数常为4。 问题2:共价键的方向性与H2O分子中两个系
10
2.1 原子结构的近代概念
2.2 多电子原子的电子分布方式和周期系
2.3 化学键与分子间相互作用力 2.4 晶体结构
制作:张思敬等
理学院化学系
11
●
微粒波动性的直接证据 — 光的衍射
灯光源
●
德布罗依关系式 — 一个伟大思想的诞生
1924年,Louis de Broglie认为:质 在光的波粒二象性 量为 m ,运动速度为v 的粒子,相应的波 的启发下,德布罗依提 长为: 出 一 种 假 想 . 他 于 1924 l = h / mv = h / p 年说:
第12章 生命活动与化学
制作:张思敬等
理学院化学系
6
动画与视频***
Flash动画
视频文件
*** 选自浙江大学普通化学电子教案媒体库。
制作:张思敬等
理学院化学系
7
动画与视频目录
三类系统 弹式热量计 混乱度自发增大 过渡态理论 催化剂的作用 反应温度与活化分子数 原电池 臭氧层空洞 电子云统计规律 σ键 π键 sp3杂化 sp2杂化 sp杂化 差异充气腐蚀 温室效应
272 224 172 159 147 141 137 135 136 139 144 155 171 175 182
Source:Wells A F,Structural Inorganic Chemistry,5th edn.Clarendon Press,Oxford(1984).
制作:张思敬等
大学化学电子课件
西安建筑科技大学 理学院 化学系
张思敬 主 编
2009年8月
• 课件简介
• 课件内容
• 动画与视频
• 课件内容示例
制作:张思敬等
理学院化学系
2
课件简介
大学化学电子课件使用PowerPoint及Microsoft Word 软件制作,用户环境友好,具有良好的通用性和操作性, 可在各种多媒体教室使用,使用方便,操作简单。电子 课件适用于各类PC机。课件正常运行要求安装IE5.0以上, 需安装FLASH 5.0以上插件以显示动画。 本电子课件以我校自编国家级十一五重点规划教材《 大学化学》(高等教育出版社2005年出版)为蓝本,章节 划分与之对应,可作为大学化学教师进行多媒体授课的电 子讲义,也可作为工科院校学生学习大学化学做预习和复 习参考之用。
O原子的3个两两垂直的2p轨道上有四个电子,其中 两个轨道上各有一个未成对电子,它们可以与H原子生成 键。根据共价键的方向性,这两个键的夹角是90º 。但 事实上两个O—H键的夹角是104.5º 。
制作:张思敬等
理学院化学系
14
在众多科学家的探索中,
Pauling 利用“杂化概念”建
立 了 新 的 化 学 键 理 论
Rb Sr Y
250 215 182
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I
160 147 140 135 134 134 137 144 152 167 158 141 137 133
Cs Ba Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi
制作:张思敬等 理学院化学系 4
课件特点
课件设计工作量大,内容全面,体系完整,融合教
师多年的教学经验,注重互动与启发式教学,突出教学 重点和难点。
采用PowerPoint传统的界面风格,辅以大量图、表及 近20幅动画及视频等多媒体手段,图文并茂,直观形象 生动,寓教于乐,有利于激发学生学习积极性。 课件整体风格统一,导航清晰简捷,物理量及单位符 号使用规范,界面布局、色彩搭配力求具有强烈的视觉效 果和艺术感染力。
