水质pH及电导率的测定..
基础生态学实验2-水质分析 水温、pH和电导率的测定03.04

电导率的测定
• 传导电流的能力,电阻的倒数 • R电阻,L电极间距,A截面积, 电阻率,Q电导池常数 • 水溶液的电导率定义为长1m,截面积1m2的水溶液的电导, 单位S/m(西门子/米),表示水中电离性物质的总量。电 导率的大小同溶于水中物质的浓度、活度和温度有关。 • 新煮沸蒸馏水 0.5-2 S/cm • 天然水 50-1500 S/cm • 海水 40000 S/cm • 电导率与水溶液的组成有关,电导也可用于弱电解质电离 常数的测定
缓冲溶液的配制
• 商品缓冲标准液或商品缓冲液配制药粉 • 根据弱电解质组合进行配制 • 邻苯二甲酸氢钾,称取在115℃±5℃干燥2~3h的邻苯二甲 酸氢钾10.12 g,加水溶解并稀释至1000 ml,25℃ 时pH为 4.008 • 磷酸氢二钠与磷酸二氢钾,称取在115℃士5℃干燥2~3 h 的无水磷酸氢二钠3.533 g与磷酸二氢钾3. 387 g,加水溶解 并稀释至1000 ml,25℃ 时pH为6.865 • 提供两个档的pH标准缓冲液,4.01和7.00,对pH计进行两 点校准
• 在天然海水正常的pH范围内,其酸-碱缓冲容量的95%都是 由CO2-碳酸盐体系所贡献,在几千年以内的短时间尺度上, 海水的pH主要受控于该体系; • 海水中总CO2浓度的短期变化主要有海洋生物的光合作用 和代谢作用引起
材料
1. 2. 3. 4. 5. 6. 各种型号的pH计、酸度计或离子活度计 复合pH电极(玻璃电极,干汞电极) 磁力搅拌器(样品混合均匀,加速电极平衡) 50 mL烧杯,最好是聚乙烯或聚四氟乙烯烧杯(玻璃烧 杯也可以) 容量瓶、玻璃棒等(准确定量,标准液配制) 套装标准缓冲溶液
浓度增大,尽管离子浓度增大 了,但溶液的粘度也有增加, 离子间的相互作用随之增多, 离子迁移阻力增大,导致电导 率的增速下降,最后导致其增 速与浓度不成等比例变化
纯水电导率测定

纯水电导率测定一、引言纯水电导率是指在特定条件下,单位长度和单位截面积的纯水中,通过的电流所引起的电势梯度的大小。
纯水电导率的测定是检验水质纯净程度的重要指标之一,广泛应用于环境监测、水质评价、工业生产等领域。
本文将介绍纯水电导率的测定方法及其应用。
二、纯水电导率测定方法1. 电导率测定仪器电导率测定的主要仪器是电导仪,它由电导率测量单元和温度测量单元组成。
电导率测量单元通过测量电流和电势差的比值来确定电导率值,而温度测量单元则用于补偿温度对电导率的影响。
2. 测定步骤(1)准备工作:将待测纯水样品倒入干净的测量容器中,确保容器表面没有附着杂质,并将电导仪的电极插入样品中。
(2)仪器校准:将电导仪放置在标准溶液中,按照仪器说明书进行校准,确保测量结果准确可靠。
(3)测量纯水电导率:将电导仪的电极插入待测纯水中,等待一定时间,直到电导仪稳定显示纯水的电导率值,记录测量结果。
3. 测量注意事项(1)保持电极清洁:电极表面附着杂质会影响测量结果,因此在每次测量前后,应仔细清洗电极。
(2)避免温度影响:纯水的电导率与温度有关,为了排除温度对测量结果的干扰,应记录测量时的温度,并进行温度补偿。
(3)避免空气氧化:电极长时间暴露在空气中容易氧化,影响测量准确性,因此在测量前应迅速将电极插入待测样品中。
三、纯水电导率的意义与应用1. 环境监测纯水电导率可以反映水体中的溶解性固体物质含量,如盐类、金属离子等。
通过测定不同水样的电导率,可以评估水体污染程度,为环境监测和水质评价提供依据。
2. 工业生产在许多工业生产过程中,纯水被广泛应用。
例如,在锅炉供水、电子芯片制造和医药生产中,纯水的纯净度是关键因素。
通过测定纯水的电导率,可以判断纯水中是否存在杂质,从而保证生产过程的正常进行。
3. 水质评价纯水电导率也是水质评价的重要指标之一。
纯水电导率越低,表示水质越纯净。
通过定期测量纯水电导率,可以监控水质变化,及时采取措施保证水质达标。
水质简分析操作规程

水质简分析操作规程水质简分析操作规程一、实验目的本实验旨在通过对水样的简单分析,判断水质的优劣,并根据结果评估其适用于特定用途的能力。
二、实验仪器与试剂1. 仪器:分光光度计、pH计、电导率测定仪、溶氧仪、温度计等。
2. 试剂:指示剂、标准溶液、缓冲溶液等。
三、实验步骤1. 准备水样从待测水源中采集适量的样品,并使用玻璃瓶或塑料瓶保存。
2. pH值检测(1)根据实验室条件设置pH计,并对其进行校准。
(2)将待测水样倒入干净的容器中,将pH电极插入水样中,记录pH值。
3. 电导率测定(1)根据实验室条件设置电导率测定仪,并对其进行校准。
(2)将待测水样倒入电导率测定仪的测量池中,启动测定,并记录电导率值。
4. 溶氧测定(1)根据实验室条件设置溶氧仪,并对其进行校准。
(2)将待测水样倒入溶氧仪的测量池中,启动测定,并记录溶氧值。
5. 温度测定(1)使用温度计对待测水样的温度进行测定,并记录结果。
6. 分光光度测定(1)根据实验要求选择适当的试剂,并进行所需的反应。
(2)使用分光光度计检测所得反应产物的吸光度,并记录结果。
7. 数据处理及分析根据所得数据,进行数据处理和分析,综合评估水质的优劣。
四、注意事项1. 实验操作前,检查仪器是否正常工作,并进行必要的校准。
2. 操作过程中,应严格按照安全操作规程进行,注意防护措施,避免发生意外。
3. 确保实验用具的清洁卫生,尽量避免污染样品。
4. 操作过程中,注意根据具体情况选择适当的试剂和测定方法。
5. 记录实验过程中的实验条件、操作方法和观察结果,确保数据的准确性和可靠性。
6. 实验结束后,清洗仪器设备,并归还到指定的位置。
五、实验结果的判定及意义根据实验所得的数据和分析结果,可以对水质的优劣进行判断,并评估其适用于特定用途的能力。
例如,根据pH值可以判断水样的酸碱性质;根据电导率可以初步了解水样的盐分含量;根据溶氧测定可以判断水样中的氧气含量;根据分光光度测定可以判断水样中某种成分的含量等。
实验六 水样中电导率的测定

实验六水样中电导率的测定一、目的要求:1.了解电导率的含义。
2.掌握电导率测定水质的意义及其测定方法二、实验原理:电导率是以数字表示溶液传导电流的能力。
纯水的电导率很小,当水中含有无机酸、碱、盐或有机带电胶体时,电导率就增加。
电导率常用于间接推测水中带电荷物质的总浓度。
水溶液的电导率取决于带电荷物质的性质和浓度、溶液的温度和粘度等。
电导率的标准单位是S/m(即西门子/米),一般实际使用单位为mS/m,常用单位µS/cm(微西门子/厘米)。
单位间的互换为1mS/m=0.01mS/cm=10µS/cm。
新蒸馏水电导率为0.05-0.2 mS/m,存放一段时间后,由于空气中的二氧化碳或氨的溶入,电导率可上升至0.2-0.4 mS/m;饮用水电导率在5-150 mS/m之间;海水电导率大约为3000 mS/m:清洁河水电导率为10 mS/m。
电导率随温度变化而变化,温度每升高1℃,电导率增加约2%,通常规定25℃为测定电导率的标准温度。
由于电导是电阻的倒数,因此,当两个电极(通常为铂电极或铂黑电极)插入溶液中,可以测出两电极间的电阻R。
根据欧姆定律,温度一定时,这个电阴.值与电极的间距L(cm)成正比,与电极截面积A(cm2)成反比,即:R=ρ×L/A由于电极面积A与间距L都是固定不变的,故L/A是一个常数,称电导池常数(以Q表示)。
比例常数ρ叫做电阻率。
其倒数1/ρ称为电导率,以K表示。
S=1/R=1/(ρ×Q)S表示电导,反映导电能力的强弱。
所以,K=QS或K=Q/R当已知电导池常数,并测出电阻后,即可求出电导率。
三、仪器与试剂:仪器:LC-DDB-1A型便携式电导率仪,铂黑电极,温度传感器。
试剂:纯水(电导率小于0.1 mS/m),待测水样,氯化钾标准溶液C(KCl):0.0100 mg/L。
氯化钾标准溶液配置方法称取0.7456g于105℃干燥2h并冷却的氯化钾,溶于纯水中,于25℃下定容至1000ml,此溶液在于25℃时的电导率为141.3 mS/m。
水质检测指标

坩埚法、滤膜法等方法,各种方法间因 滤孔大小对测定有很大影
响,报告结果时应注明测定方法。我们 采用滤纸法,用滤纸过滤
水样,经103~105℃烘干后得到的总不可 滤固体物含量。
MLSS测试方法同SS,指曝气池活性 水质污分泥析含量。
Ⅸ、SS的测定
反应器中取出,翻转几次使之混合,冷却 至室温。
6、按住ON键直到打开比色计。按ENTER 水键质选分择析测定项目及量程。
一、方法原Ⅷ理 、BOD的测定
生化需氧量是指在规定条件下,水中 有机物和无机物在生物氧
化作用下所消耗的溶解氧。目前国内外规 定于20±1℃培养5天,分
别测定样品培养前后的溶解氧,二者之差 即为BOD5值,以氧的
比例常数ρ称为电阻率。其倒数1/ρ称为电 导率,以K表示。
S=1/R=1/ρQ S表示电导度,反映导电能力的强弱。所以, 水K质=分Q析S或K=Q/R。
Ⅵ、电导率的测定
四、校正与测量
➢ 打开电源进入Operation界面 ➢ 按Cell键进入校准界面,按Cal K键进入
CALIBRATE K界面。 ➢ 将探头插入校准液中,按Single PT进入单
钠溶液C,(m充g /分L)振 C摇1 ,10滴00至V溶1 液100由.1紫红色刚好 变为蓝色时,即为滴定终V点0 。
记录消耗EDTA二钠溶液体积的毫升数。
水质分式析中:
一、方法Ⅲ原理、氯离子的测定
在中性或弱碱性溶液中,以铬酸银为指 示剂,用硝酸银滴定氯化物
时,由于氯化银的溶解度小于铬酸银,氯离 子首先被完全沉淀后,铬酸
水五质、分仪析器的校正
Ⅴ、浊度的测定
➢ S1灯亮,显示20.0
水质电导率的测量原理分析及方法介绍

( 2 - 4 )
物质 按 照其在 电场 作 用下 导 电与否 可分 为导 体 、 半 导体 和绝 缘 体。导体又可按导 电方 式分 为两大类。第一类导体依靠 自由电子在电 场作用 下作定 向运动 而导电 , 故称之为 电子型导体 ; 第二类导 体则依靠 离 子的定 向移动而导 电, 故称之 为离子型导体 。在工程技术上 , 通常用 电阻来衡 量第一类导 体的导 电能 力 , 用 电导来 衡量第二 类导体 的导 电 能力。本 文主要研究 第二类导体 的测量技术 , 常见 的离 子型导体 为各
1 . 电导 率 测 量 的主 流 方 法
电导率测 量的方法众 多 , 但一 部分方法 实现 比较 困难。这里着 重 介 绍 电导率 测量 的主流方法 , 即较 容易实现 的方法 。按 电导率测量 的 原理可 以大致 分为四种形式 : 1 ) 平衡 电桥 测量原理 法 : 它是将 电导池作 为惠斯登 电桥 的一个 桥 臂, 通过调整另一 只桥臂可变 电阻使 电桥达到平衡 , 从而计算 出电导池 的电导率 。 2 ) 直接 电阻分 压原理法 : 它是通 过测 量与 电导池 串连 的分压 电阻 上 的分 压 , 并且分压电阻分档可调 , 后接放 大 、 检波( 整流 ) 和滤波 电路 , 这是一种相 当成熟且 应用广泛的测量方法。 3 ) 利用运放 I / V 变换原理法 : 将 电导池直接 与运放的反相输入端相 连, 通 过反馈 电阻在运放 的输 出端就 可得 到与输入 电流成正 比的 电压 信号 。 4 ) 变频法 : 它是将 电导率转换成与之成正 比的频 率信 号 , 可 以用 电 阻一 频 率变换电路 ; 或采用时基 电路 与电导 电极传感 器构成多谐振荡 电 路将 电导率转化 为频率信号 , 电极作 为振 荡 电路 的一部分 。这 种方法 提供 了高精度远距 离的传输 方式 , 且结构 简单 , 成本 低 , 易做成 便携式 电导率仪 。
水质分析-水温、pH和电导率的测定方法

pH值测定
• 天然水的pH值多在6-9范围内; • 天然饮用水的pH 值要求在6.5-8.5之间,如pH异常,说明
受到污染; • 工业用水的pH值必须保持在7.0-8.5之间,以防止金属设备
和管道被腐蚀 • pH计、酸度计、离子活度计都可测定pH值,测量方法不
• 样品采集:水样用250ml聚乙烯瓶装至溢满,上岸后立即到实验 室测定
渤海夏季海水pH 值年际时空变化
• 收集渤海断面1978~2010 年历年8 月海水pH 值、 海水温度和大连站8 月降水量观测资料,结果表明 渤海夏季海水pH 值年际变化范围为7.86~8.30,尚 在适宜水生物生长的范围;
水质分析 水温、pH和电导率的测定
2014.3
水温的重要性
• 不同鱼类适应生长的水温不同 • 水温影响着化学、生物化学反应和反应速
率(赤潮、水华) • 水温对水的密度、黏度、蒸汽压等也都有
直接的影响
2008.2.27 澎湖寒潮导致死鱼
• 福建省近岸海域水温周日变化主要与太阳辐射、气温有关, 最大日较差4.82℃,发生在夏季表层。
粒径直径的三种方法
a-定向直径 b-定向面积等分直径 c-投影面积直径
分析表明,同一颗粒的dF>dA>dM
(2)筛分法
筛分直径:颗粒能够通 过的最小方筛孔的宽度
目数 孔径 mm
以1英寸(25.4mm)宽
4
5
度的筛网内的筛孔数表
8 2.5
示,因而称之为‘目数’ 10 2
一般来说,目数×孔径 (微米数)=15000
温度校准
• 当温度不是25 oC时,需要进行校准 • 温度下降,溶液的粘度增加,离子迁移阻力增大,电导降
水质 电导率的测定 电极法
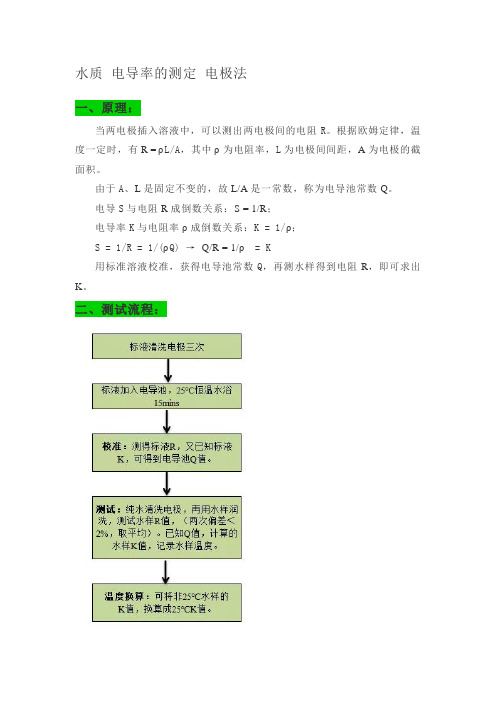
水质电导率的测定电极法一、原理:当两电极插入溶液中,可以测出两电极间的电阻R。
根据欧姆定律,温度一定时,有R = ρL/A,其中ρ为电阻率,L为电极间间距,A为电极的截面积。
由于A、L是固定不变的,故L/A是一常数,称为电导池常数Q。
电导S与电阻R成倒数关系:S = 1/R;电导率K与电阻率ρ成倒数关系:K = 1/ρ;S = 1/R = 1/(ρQ) →Q/R = 1/ρ= K用标准溶液校准,获得电导池常数Q,再测水样得到电阻R,即可求出K。
二、测试流程:三、注意事项:1.水样采集和保存:水样采集后应尽快分析;采集水样应贮存于聚乙烯瓶中,注满封存,于4°C 冷藏保存,在24h内完成测定。
2.前处理:水样中含有粗大悬浮物质、油和脂等时,可以干扰测试。
可先测水样,再测标准溶液,以了解干扰情况,若有干扰,应经过滤或者萃取处理水样。
3.影响因素:①电极极化影响:浓差极化使电极表面和溶液浓度无法到达平衡,造成测试误差。
消除方法:铂片上刷铂黑,增加表面积(减小电流密度);使用交流电,正反抵消浓差极化。
②电容影响:交流供电时,电极的电容不可忽略。
电容会改变极片间的电阻。
消除方法:改变电解池常数,增加电阻值;增加电源频率,减小电容。
③温度影响:温度每增加1℃,电导率上升2%。
测试过程需要保持溶液温= Kt/[1+a(t-25)] 温度系数a=0.022度稳定 K25℃④背景影响:空气中氨气或二氧化碳为溶液吸收时,影响测试结果;溶液、纯水、器皿中杂质亦会影响测试结果。
4.不同水体电导率的范围参考标准:GB 13580.3-92 大气降水电导率的测定方法GB/T 6908-2008 锅炉用水和冷却水分析方法电导率的测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、实验仪器与试剂 1.DDS-11型电导仪,电导电极(光亮电极和铂黑 电极),电磁搅拌器,搅拌子,恒温水槽。 2.试剂:0.02mol/L KCl溶液,离子交换水,自来水。
四、实验步骤 1.电导池常数的测定 (1)将电导仪接上电源,开机预热。装上电导电极, 用蒸馏水冲洗几次,并用滤纸吸去水珠。 (2)将洗净的电导池用去离子水洗涤3次,再用 0.02mol/L KCl溶液润洗3次。
②用洗上述塑料瓶的方法洗100ml 烧杯,然后取 近80ml的河水。 ③取下pH计上的保护套,将电极浸入烧杯内,约 4cm深。 ④轻轻搅动,直到显示读数稳定。 ⑤在记录纸上记下该pH值。 按2)~4)的步骤测定三次pH值,计算平均pH值
实地采集水样pH值测定记录表
次
1 2 3
数
pH
平均值
四、 注意事项 (1)测量结果的准确度,首先决定于标准缓冲溶 液pH标准值的准确度。因此,应按GB11076-89《pH 测量用缓冲溶液制备方法》制备、保存缓冲溶液。 (2)应按规范选择、处理和安装玻璃电极和甘贡 电极。 (3)测定水样的pH值最好在现场进行,否则,应 在采样后把样品保持在0-4℃,并在采样后6h之内 进行测定。
五、数据记录与处理
试样 0.02mol/LKCl 自来水 离子交换水 电导(1) 4.48 mΩ -1 335µΩ -1 6.15µΩ -1 电导(2) 4.49 mΩ -1 336µΩ -1 6.20µΩ -1 电导(3) 4.50 mΩ -1 339µΩ -1 6.20µΩ -1 电导平均 4.48 mΩ -1 337µΩ -1 6.18µΩ -1
实验二(2):电导法测定水质纯度 一、实验目的 1.掌握电导分析法的基本原理; 2.学会用电导法测定水纯度的实验方法; 3.掌握电导池常数的测量技术。 二、实验原理 1.水质纯度的一项重要指标是水质的电导率的大小。 电导率愈小,即水中离子总量愈小,水质纯度就高; 反之,电导率愈大,离子总量愈大,水质纯度就低。 普通蒸馏水的电导率约为3~5×10-6S∙cm-1,而去 离子水可达1×10-7S∙cm-1。水溶液中的离子,在电 场作用下具有导电能力。导电能力称为电导(G), 其单位是西门子(S)。电导G与电阻R的关系为:
2.由上述公式可知,影响电导(G)的因素有电阻, 溶液的导电能力与溶液中的正负离子数目、离子所 带的电荷数、离子在溶液中的迁移速度等因素有关。 3.电导分析法:通过测量电解质溶液的电导(G)值, 来确定物质含量的分析方法。测定溶液的电导实际 上是测定它的电阻。 4.电导分析法的特点:电导分析法具有极高的灵敏 度,但由于溶液的电导并不是某一个离子的特性, 溶液的电导是存在于溶液中所有各种离子单独电导 的总和,只能测量离子的总量,而不能鉴别和测定 某离子及其含量,因此其选择性很差。
将铂黑电导电极插入电导池中,加入待测的KCl溶 液,以溶液淹没电极为宜调节电极位置。置电导池于 25°C恒温水槽中,将电极导线接到电导仪上。待恒 温水槽的温度显示屏显示的温度差几度达到25°C时, 将电导仪的开关扳至“ON”及“校正”位置,调节校 正旋钮使电指针指在满标度。待达到25°C时,将开 关扳至“测量”档,进行测量。测量时,可调节量程 选择开关各率的测定 用待测水样洗涤电导池,按上述分别测量离子交换 水,自来水的电导。
2、玻璃电极法 (1)测定原理 玻璃电极法是利用饱和甘汞电极为参比电极,以 玻璃电极为指示电极,与被测水样组成工作电池, 再用pH计测量工作电动势,由pH计直接读取pH值。 其特点:玻璃电极法测pH准确、快速,受水体色度、 浊度、胶体物质、氧化剂、还原剂及盐度等因素的 干扰少。 (2)仪器 a、酸度计或离子计。b、玻璃电极(2支,其电 极响应斜率须有一定差别),饱和甘汞电极。
θ =к /G=0.0027685S·cm-1/4.48 mΩ -1 =0.618cm-1 к (自来水)=θ G=0.618cm-1×337µΩ -1 =208.27µS·cm-1 к (离子交换水)=θ G=0.618cm-1×6.18µΩ -1 =3.82µS·cm-1
六、测量注意事项 (1) 电解质溶液的电导率随温度的变化而改变,因 此,在测量时应保持被测体系处于恒温条件下。 (2) 电极接线不能潮湿或松动,否则会引起测量的 误差。 七、问答题 1.新制备的蒸馏水放入电导池后,为什么应立即 测定? 答:空气中的二氧化碳会溶解在水中生成HCO3- 1和CO 2-,使蒸馏水的电导率增大。 3
实验二(1):水样pH值的测定 一、实验目的 1、掌握玻璃电极测量水质pH值的基本原理和测量 技术。 2、学会测定玻璃电极响应斜率,进一步加深对玻 璃电极响应特性的了解。 二、实验原理 pH值是溶液氢离子活度的负对数,即pH = logα H+ 当溶液浓度很稀时,氢离子活度近似于氢离子浓度 [H+]
(3)试剂 标准缓冲溶液的配制 ① pH标准缓冲溶液甲(pH4.008,25℃): 称取先在110-130℃干燥2-3h的邻苯二甲酸氢 钾(KHC8H4O4)10.12g,溶于水并在容量瓶 中稀释至1L。 ② pH标准缓冲溶液乙(pH6.865,25℃): 分别称取先在110-130℃干燥2-3h的磷酸二氢 钾(KH2PO4)3.388g和磷酸氢二钠 (Na2HPO4)3.533g,溶于水并在容量瓶中稀 释至1L。
pH值是最常用的水质指标之一,天然水的pH值 多在6-9范围内;饮用水pH值要求在6.5~8.5之间; 某些工业用水的pH值应保证在7.0-8.5之间,否则 将对金属设备和管道有腐蚀作用。 pH值和酸度、碱度既有区别又有联系。pH值表 示水的酸碱性的强弱,而酸度或碱度是水中所含 酸或碱物质的含量。水质中的pH值的变化预示了 水污染的程度。其pH值的测定方法有比色法和玻 璃电极法。
③ pH标准缓冲溶液丙(pH=9.180,25℃):称取饱和 溴化钠(或氯化钠加蔗糖溶浓、室温)共同放置在干 燥器中平衡两昼夜的硼砂(Na2B4O7.10H2O)3.80g, 溶于水并在容量瓶中稀释1L。 (4) 监测步骤 ①采样 在小河适当的部位选择取样的位置,用500ml塑料 瓶盛取适量的河水,洗瓶内三次,然后盛满河水,拧 紧瓶盖,带回实验室作为实验样品。 采集的水样应 该在当场用浓硫酸调pH=2.0,以防止微生物的生长。
2.用蒸馏法和离子交换法制得的纯水各有何优点? 说明如何制备高纯水。 答:①蒸馏法制纯水的优点:水质电阻率较低,能 除去水中非挥发性的杂质。 ②离子交换法制得的纯水优点:产量高,成本低, 除去离子的能力强,电导率很低,制得的水纯度比 蒸馏水高。 ③高纯水制备的工艺流程如下: 源水→过滤→活性炭过滤器(或有机大孔树脂吸附 器)→反渗透器(或电渗析器)→阳离子交换柱→ 阴离子交换柱→混和离子交换柱→有机物吸附柱→ 紫外灯杀菌器→精密过滤器→高纯水使用点。
三实验方法 1、比色法 (1)测定原理 比色法是利用pH试纸简单的粗略测定方法。常用的 pH试纸有两种,一种是广泛pH试纸,可以测定的pH范 围为1~14;另一种是精密pH试纸,可以比较精确的测 定一定范围的pH值。 (2)测定步骤 ①取一条试纸剪成4~5块,放在干净干燥的玻璃板 上, ②用干净的玻璃棒分别沾少许待测水样于pH试纸 上, ③片刻后,观察试纸颜色,并与标准色卡对照,确 定水样的pH值。
G= 1/R (1—1) 而导体的电阻与其长度(L)和截面积(A)的 关系可用下式表示: R= ρL/A (1—2) 式中ρ称为电阻率,单位为Ω·㎝。电阻率的倒 数(1/ρ)称为电导率(K),由此,电导与电导 率关系可表示为: G=KA/L=κ/θ ( 1 —3 ) 式中θ称为电导池常数,是电极间距离(L)与 其面积(A)之比。一支电导电极池的常数为确 定值。
