第一阶段 专题三 第2讲 非金属及其化合物
第2专题 非金属及其化合物

第2专题非金属及其化合物一、氯及其化合物1、实验室制取氯气的原料是和,化学方程式为。
工业上用的方法来获取氯气,化学方程式为。
2、常温下,氯气是有气味的色气体,密度比空气,毒。
氯气的化学性质主要有:①能和非金属单质(如H2)反应,有关化学方程式为:;②能和金属单质(如Na、Fe、Cu等)反应,有关化学方程式为:;③能和水反应,有关化学方程式及离子方程为:;④能和碱(如NaOH溶液)反应,有关化学方程式及离子方程式为;⑤能和盐(如KBr、KI、FeCl2等),有关化学方程式及离子方程式为:。
3、次氯酸是(填“强”或“弱”)酸,具有强性,可起、的作用。
次氯酸不稳定,易分解,化学方程式为:。
4、工业上用和反应制取漂白粉,化学方程式为。
漂白粉的主要成分是,有效成分为,能和空气中的反应生成而产生漂白作用,化学方程式为,因此,漂白粉需保存。
5、氯水是氯气溶于水得到的水溶液,属于物,呈色。
由于氯气和水反应生成的次氯酸,实验室中氯水需保存在中。
二、硫及其化合物1、硫单质常温下为色固体,溶于水,在空气中燃烧,火焰呈色,化学方程式为:。
2、二氧化硫属于氧化物,能和水、碱性氧化物(如CaO)及碱(如Ca(OH)2)反应,有关化学方程式为。
二氧化硫能使溶液褪色,说明二氧化硫具有作用,褪色后的溶液再加热,发现。
二氧化硫还具有还原性,能被氧化剂(如O2、H2O2)氧化,有关方程式为:。
3、的燃烧产生的二氧化硫排放到空气中,会形成。
其形成原理用化学方程式可表示为:。
4、浓硫酸加入胆矾,发现胆矾从色变成色,说明浓硫酸具有性;浓硫酸加入到蔗糖中,能使蔗糖化,说明浓硫酸具有性;浓硫酸还具有性,能使活泼金属如Fe、Al发生,也能和不活泼金属如Cu反应,化学方程式为,还能和非金属如C反应,化学方程式为。
三、氮及其化合物1、大部分氮元素以态存在于中,化学上把态氮转化为态氮的过程称为氮的固定。
N2的电子式为,结构式为,化学性质稳定。
2、俗话说“雷雨发庄稼”,用化学方程式表示其原因:。
苏教版化学必修一专题1-3第2单元知识点总结
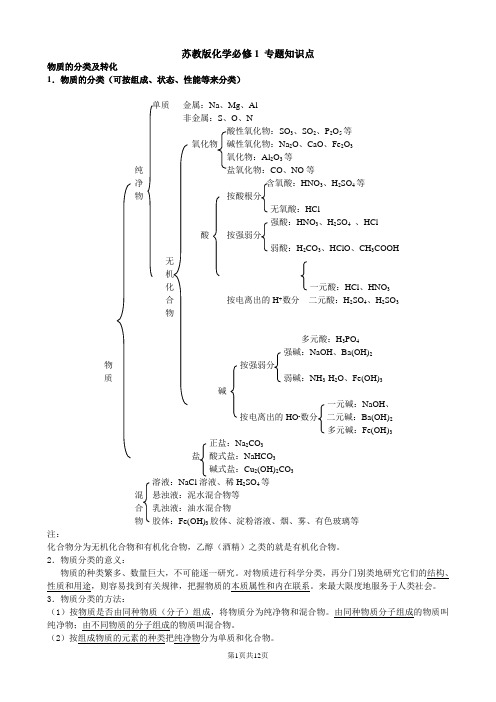
苏教版化学必修1 专题知识点物质的分类及转化1.物质的分类(可按组成、状态、性能等来分类)单质金属:Na、Mg、Al非金属:S、O、NSO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3氧化物:Al2O3等纯CO、NO等净含氧酸:HNO3、H2SO4等物按酸根分无氧酸:HCl强酸:HNO3、H2SO4、HCl酸按强弱分弱酸:H2CO3、HClO、CH3COOH无机化一元酸:HCl、HNO3合按电离出的H+数分二元酸:H2SO4、H2SO3物多元酸:H3PO4强碱:NaOH、Ba(OH)2物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH、按电离出的HO-数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3碱式盐:Cu2(OH)2CO3溶液:NaCl溶液、稀H2SO4等混悬浊液:泥水混合物等合乳浊液:油水混合物物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等注:化合物分为无机化合物和有机化合物,乙醇(酒精)之类的就是有机化合物。
2.物质分类的意义:物质的种类繁多、数量巨大,不可能逐一研究。
对物质进行科学分类,再分门别类地研究它们的结构、性质和用途,则容易找到有关规律,把握物质的本质属性和内在联系。
来最大限度地服务于人类社会。
3.物质分类的方法:(1)按物质是否由同种物质(分子)组成,将物质分为纯净物和混合物。
由同种物质分子组成的物质叫纯净物;由不同物质的分子组成的物质叫混合物。
(2)按组成物质的元素的种类把纯净物分为单质和化合物。
(3)化合物的分类方法很多,如按化合物的性质分类,又把化合物分为酸、碱、盐、氧化物等;若按化合物在水溶液或在融化状态下是否导电,则可以分为电解质和非电解质;若按在化学反应中的表现,则分为氧化剂和还原剂。
(4)按混合物中分散质微粒的直径大小可将混合物分类,分为溶液、胶体和浊液等。
4.单质、氧化物、酸、碱和盐之间的相互关系(1)相互关系的研究方法:先选定一类物质,预测它可能和哪些类别的物质发生反应;然后选出各类物质的代表物,探究它们之间是否发生反应。
高中化学——非金属及化合物知识点总结

高中化学——非金属及化合物知识点总结一、硅及其化合物(一)硅1、硅的存在和物理性质(1)存在:只以化合态存在,主要以SiO2和硅酸盐的形式存在于地壳岩层里,在地壳中含量居第二位。
(2)物理性质:晶体硅是一种灰黑色固体,具有金属光泽,硬而脆的固体,熔沸点较高,能导电,是良好的半导体材料。
2、硅的化学性质3、用途:制造半导体、计算机芯片、太阳能电池。
(二)CO2和SiO2的比较(三)硅酸及硅酸盐1、硅酸(1)物理性质:与一般的无机含氧酸不同,硅酸难溶于水。
(2)化学性质:①弱酸性:是二元弱酸,酸性比碳酸弱,与NaOH溶液反应的化学方程式为:②. 不稳定性:受热易分解,化学方程式为:(3)制备:通过可溶性硅酸盐与其他酸反应制得,如Na2SiO3溶液与盐酸反应:(4)用途:硅胶可用作干燥剂、催化剂的载体等。
2、硅酸盐定义:硅酸盐是由硅、氧、金属所组成的化合物的总称。
(1)硅酸盐结构复杂,一般不溶于水,性质很稳定。
通常用氧化物的形式来表示其组成。
例如:硅酸钠Na2SiO3(Na2O·SiO2),高岭石Al2Si2O5(OH)4(Al2O3·2SiO2·2H2O)。
书写顺序为:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
注意事项:① 氧化物之间以“·”隔开;②计量数配置出现分数应化为整数。
(2)硅酸钠:Na2SiO3,其水溶液俗名水玻璃,是一种无色粘稠液体,是一种矿物胶,用作黏合剂和木材防火剂。
(四)常见无极非金属材料及其主要用途(五)总结提升1、硅(1)硅的非金属性弱于碳,但碳在自然界中既有游离态又有化合态,而硅却只有化合态。
(2)硅的还原性强于碳,但碳能还原SiO2产生,但Si能跟碱溶液作用放出(3)非金属单质跟碱溶液作用一般无H2H:2(4)非金属单质一般不跟非氧化性酸反应,但硅能跟氢氟酸反应。
(5)非金属单质一般为非导体,但硅为半导体。
2、二氧化硅(1)非金属氧化物的熔沸点一般较低,但SiO2的熔点却很高。
非金属及其化合物制备流程与实验探究(Si、N、P、As)(解析版)--2025年高考化学微专题

A .碱石灰有利于3NH 逸出B .锂片必须打磨出新鲜表面C .干燥管中均可选用25P OD .双口烧瓶中发生的变化是()-+33n Li+nNH Li +e NH = 【答案】C【分析】本题利用Li 和液氨反应()-+33n Li+nNH Li +e NH = 制备()-3n e NH ;碱石灰可以吸收浓氨水中的非金属及其化合物制备流程与实验探究(Si 、N 、P 、As )考情分析真题精研水分,同时吸水过程大量放热,使浓氨水受热分解产生氨气;利用集气瓶收集氨气;过量的氨气进入双口烧瓶中在冷却体系中发生反应生成()-3n e NH ;最后的球形干燥管中可装25P O ,除掉过量的氨气,同时防止空气的水进入引起副反应。
【解析】A .碱石灰为生石灰和氢氧化钠的混合物,可以吸收浓氨水中的水分,同时吸水过程大量放热,有利于3NH 逸出,A 正确;B .锂片表面有Li 2O ,Li 2O 会阻碍Li 和液氨的接触,所以必须打磨出新鲜表面,B 正确;C .第一个干燥管目的是干燥氨气,25P O 为酸性干燥剂能与氨气反应,所以不能用25P O ,而装置末端的干燥管作用为吸收过量的氨气,可用25P O ,C 错误;D .双口烧瓶中发生的变化是()-+33n Li+nNH Li +e NH = ,D 正确; 故选C 。
2.(2023·湖北·高考真题)工业制备高纯硅的主要过程如下:石英砂1800~2000 →焦炭℃粗硅2HHCl 33001100SiHCl → →℃℃高纯硅 下列说法错误的是规律·方法·技巧O Si+2OH-Si+2C Si+2CO↑;+4HF SiFO H2Na+SiO2CaSiO二、工业生产单质硅过程中应注意的问题经典变式练①铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色;②铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深;③一段时间后气体颜色逐渐变浅,至几乎无色;④锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
专题三 常见无机物和有机物

专题三 常见无机物和有机物----网络化第1讲 非金属及其化合物【考情分析】常见非金属元素及其化合物的性质仍是高考命题的重点,其命题形式一般为实验探究、推断等。
预计今后的高考中,将会进一步注重非金属元素及其化合物性质知识的整体性和探究性,强化与生活、社会实际问题的联系,试题可以以选择题的形式出现,也可以以实验题和无机推断题的形式出现,以环保为主题设计问题的可能性也比较大。
一、情景自学----感受高考1.[2013·江苏卷]甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲――→丁乙 丁甲丙。
下列有关物质的推断不正确的是( )A. 若甲为焦炭,则丁可能是O 2B. 若甲为NaOH 溶液,则丁可能是CO 2C. 若甲为SO 2,则丁可能是氨水D. 若甲为Fe ,则丁可能是盐酸 2. [2013·北京卷]某学生对SO 2与漂粉精的反应进行实验探究:(1)Cl 2和Ca(OH)2制取漂粉精的化学方程式是___________________________。
(2)pH 试纸颜色的变化说明漂粉精溶液具有的性质是_____________________。
(3)向水中持续通入SO 2,未观察到白雾。
推测现象ⅰ的白雾由HCl 小液滴形成,进行如下实验: a .用湿润的碘化钾淀粉试纸检验白雾,无变化; b .用酸化的AgNO 3溶液检验白雾,产生白色沉淀。
①实验a 的目的是_____________________________________________________。
②由实验a 、b 不能判断白雾中含有HCl ,理由是__________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl -发生反应。
通过进一步实验确认了这种可能性,其实验方案是_______________________ __。
高考化学之高频考点07 非金属及其化合物(解析版)
解密07非金属及其化合物考点1 碳、硅及其化合物1. 扫除易忘知识盲点(1)自然界中无游离态的硅,通常原子晶体不导电,但硅是很好的半导体材料,是制作光电池的材料。
SiO2不导电,是制作光导纤维的材料。
(2)工业上制备粗硅,是用过量的C和SiO2在高温下反应,由于C过量,生成的是CO而不是CO2,该反应必须在隔绝空气的条件下进行。
(3)氢氟酸不能用玻璃容器盛放;NaOH溶液能用玻璃试剂瓶,但不能用玻璃塞。
(4)酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与HF反应。
(5)硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
硅胶(m SiO2·n H2O)是一种很好的无毒干燥剂。
(6)H2CO3的酸性大于H2SiO3的,所以有Na2SiO3+CO2(少量)+H2O===H2SiO3↓+Na2CO3,但高温下Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑也能发生,原因可从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO 2制得低沸点易挥发的CO 2气体。
(7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。
调研1 (衡水中学2020届高三期中)中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色出窑万彩”的神奇窑变著称。
下列关于陶瓷的说法正确的是A .高品质的白瓷晶莹剔透,属于纯净物B .瓷器中含有大量的金属元素,因此陶瓷属于金属材料C .氮化硅陶瓷属于传统无机非金属材料D ."窑变"是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化【答案】D【解析】A .陶瓷中含有多种物质,属于混合物,不符合题意,A 错误;B .瓷器属于无机非金属材料,不符合题意,B 错误;C .氮化硅属于新型无机非金属材料,不符合题意,C 错误;D .“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化,符合题意,D 正确;答案为D 。
高中化学第三章非金属及其化合物重难点十一Fe2+、Fe3+、Fe的相互转变-“铁三角”(含解析)新人

重难点十一 Fe2+、Fe3+、Fe的相互转变-“铁三角”【要点解读】1.Fe只具有还原性,可以被氧化剂氧化(1)与弱氧化剂反应Fe能被S、Fe3+、Cu2+、H+等较弱氧化剂氧化为Fe2+,如:Fe+S FeS,Fe+2Fe3+=3Fe2+。
(2)与强氧化剂反应Fe能被Cl2、HNO3等强氧化剂氧化为Fe3+,如:2Fe+3Cl22FeCl3。
2.Fe2+既具有氧化性又具有还原性(1)与氧化剂反应当Fe2+遇到强氧化剂(如Cl2、HNO3、KMnO4)时,被氧化为Fe3+,如:2Fe2++Cl2=2Fe3++2Cl -(2)与还原剂反应当Fe2+遇到C、Al、Zn、CO等还原剂时,可以被还原为Fe,如:Fe2++Zn=Zn2++Fe,FeO +CO Fe+CO23.Fe3+具有较强氧化性,可被还原为Fe2+或Fe(1)Fe3+被C、CO、Al等还原为Fe,如Fe2O3+3CO2Fe+3CO2,Fe2O3+2Al2Fe+Al2O3(2)Fe3+被Fe、Cu、I-等还原为Fe2+,如2Fe3++Cu=2Fe2++Cu2+【温馨提示】(1)不同价态的铁及铁的化合物在相互转化时,注意所用氧化剂和还原剂的强弱不同。
(2)亚铁盐保存时,为了防止被氧化为铁盐,通常在溶液中加少量还原铁粉或铁钉。
【重难点指数】★★★★【重难点考向一】Fe和Fe3+的反应【例1】将1.12g铁粉加入25mL 2mol•L-1的氯化铁溶液中,充分反应后,其结果是( ) A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变B.往溶液中滴入无色KSCN溶液,显黄色C.Fe2+和Fe3+的物质的量之比为6:1D.氧化产物与还原产物的物质的量之比为2:5【答案】C【名师点睛】先根据2Fe3++Fe=3Fe2+进行计算,确定溶液的成分,再结合Fe2+、Fe3+的性质结合选项进行判断。
【重难点考向二】Fe2+转化为Fe3+【例2】向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )A.无变化 B.颜色变浅 C.变为棕黄色 D.变为红褐色【答案】C【解析】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H20,三价铁离子为棕黄色,故选C。
高考化学复习专题课件★★第讲非金属及其化合物PPT

2 0 2 1 年高考 化学复 习专题 课件 ★ ★ 第1 3讲非金 属及其 化合物
2 0 2 1 年高考 化学复 习专题 课件 ★ ★ 第1 3讲非金 属及其 化合物
2 0 2 1 年高考 化学复 习专题 课件 ★ ★ 第1 3讲非金 属及其 化合物
(中(32))可A在2以B一的循定化环条学使件式用下为的,_物_由_质_S_iH有_4_和M____Cg__2H__S_4_i反___N。应_H_反生_3,_应成_N_②H_H_2的和4_C_必一l__备种__条固。件体是耐_磨__材__料_熔____融____,____电__。_解_上(写图
2 0 2 1 年高考 化学复 习专题 课件 ★ ★ 第1 3讲非金 属及其 化合物
所需醛的可能结构简式:
2 0 2 1 年高考 化学复 习专题 课件 ★ ★ 第1 3讲非金 属及其 化合物
[解析] (1)H+没有电子;Mg2+和 N3-都有 2 个电子层、10 电子,但 Mg2+比 N3-核电荷数大;Cl-有 3 个电子层。核外电子层数越多,离子半径越大,电子层 数相同时,核电荷数越大的离子半径越小,故离子半径由小到大的顺序为
Mg 原子核外有 3 个电子层,最外层有 2 个电子,故 Mg 位于周期表中第三 周期ⅡA 族。
Mg(OH)2 是 由 Mg2 + 和 OH - 构 成 的 离 子 化 合 物 , 其 电 子 式 为 。
(2)根据质量守恒定律,A2B 的化学式是 Mg2Si。电解熔融的 MgCl2 生成 Mg 和 Cl2。NH3 和 NH4Cl 既是副产物又是起始原料。
1.(2019·江苏,6)下列有关化学反应的叙述正确的是( C) A.Fe在稀硝酸中发生钝化 B.MnO2和稀盐酸反应制取Cl2 C.SO2与过量氨水反应生成(NH4)2SO3 D.室温下Na与空气中O2反应制取Na2O2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[归纳· 助学] 1.硅及其化合物之间的转化关系
2.硅及其化合物的特性 (1)Si 的还原性强于 C,但 C 却能在高温下还原出 Si:SiO2 高温 +2C=====Si+2CO↑。 (2)非金属单质跟碱作用一般无 H2 放出, Si 能跟强碱溶液 但 作用放出 H2:Si+2NaOH+H2O===Na2SiO3+2H2↑。
-
解析:因忽视题目中“过量铁粉”的含义而造成错误;
过量铁与硝酸反应时得到的是Fe2+而不是Fe3+。
3.用铜与稀硝酸反应制取NO2气体(2012· 广东高考) ( × ) 解析:因混淆铜与浓、稀硝酸反应的产物而造成错误;
铜与稀HNO3反应生成NO而不是NO2
返回
[思考· 回顾] 1.盛放NaOH溶液的试剂瓶为什么不用玻璃塞而 使用橡胶塞? 提示:玻璃的成分中含有 SiO2,而 SiO2 能与 NaOH 溶液
返回
[归纳· 助学] 1.氮及其化合物之间的转化关系
2.氮及其化合物的重要性质 (1)NH3 极易溶于水,凡涉及 NH3 的制取与性质的实 验,均需增加防倒吸装置。 (2)涉及氮元素氧化转化关系: O2 O2 ①NH3―――→NO――→NO2, 催化剂 O2 O2 ②N2――→NO――→NO2。 放电
返回
[鉴赏· 领悟]
判断下列描述的正误(正确的打“√”,错误的打“×”)。 1.向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白 色沉淀,证明H2SiO3的酸性比H2CO3的酸性强(2012· 江苏 高考) (× )
解析:因不熟悉相对强的酸制取相对弱的酸的反应原理而
造成错误;通过该反应证明H2CO3的酸性强于H2SiO3。
2 有还原性,能被 HClO 氧化成 SO4 ,正确的离子方程式
-
为:SO2+ClO +2OH ===SO2 +Cl +H2O。 4
-
-
-
-
返回
[思考· 回顾] 1.用下图装置验证木炭与浓硫酸反应的产物,请指出
各装置中试剂的作用。
提示:A.验证产物中有水蒸气 B.验证产物中有SO2气体 C.除去SO2气体 D.检验SO2是否除尽 E.验证产物中有CO2气体
返回
(3)足量的铜与一定量的浓 HNO3 反应时, 得到的是 NO 和 NO2 的混合气体,而不只是 NO2 气体。
- (4)NO3 在酸性溶液中具有强氧化性,能将 Fe2+、I-、
S2-、SO2-等氧化而不能大量共存。 3
返回
[鉴赏· 领悟] 判断下列描述的正误(正确的打“√”,错误的打“×”)。
发生反应:SiO2+2NaOH===Na2SiO3+H2O,Na2SiO3 水溶液 的粘性很强,若使用玻璃塞,则发生粘结,不易打开瓶塞。
2.如何通过实验证明碳酸的酸性强于硅酸? 提示:向硅酸钠溶液中通入CO2气体,得到白色沉淀,
证明酸性:H2CO3>H2SiO3,反应的化学方程式为:
Na2SiO3+H2O+CO2===H2SiO3↓+Na2CO3。 返回
返回
返回
[思考· 回顾]
1.氯水的成分有哪些?将氯水长期放置后,其化学性
质有哪些变化?
提示:氯水的成分中有三种分子(Cl2、H2O、HClO),
四种离子(Cl-、ClO-、H+、OH-),久置的氯水与新制氯 水相比较,其酸性增强,氧化性降低。
返回
2.漂白粉的成分是什么?为什么漂白粉长期露置于
空气中会失效?最终转化为什么物质?
返回3.含2 mol HCl浓盐酸与足量的MnO2充分反应, 能制得11.2 L(标准状况)Cl2吗?
△ 提示:实验室制 Cl2 的反应为:MnO2+4HCl(浓)=====
MnCl2+Cl2↑+2H2O,随着反应的进行,盐酸的浓度降低, 而 MnO2 与稀盐酸不反应,故制得的 Cl2 一定小于 0.5 mol。
解析:因忽视次氯酸的漂白性而造成错误;Cl2与水反应 生成的HClO具有强氧化性,能漂白酸碱指示剂。 返回
3.二氧化硫通入次氯酸钠溶液的离子方程式:SO2+2ClO
2 +H2O===SO3-+2HClO(2012· 海南高考)
-
(× )
解析: 因忽视次氯酸的强氧化性而造成判断错误; 2-具 SO3
返回
- - - +
-
[鉴赏· 领悟] 判断下列描述的正误(正确的打“√”,错误的打“×”)。 1.常温下,干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
(2011· 海南高考)
(× )
解析:因忽视反应条件造成判断错误;氯气在加热条件 下能与Fe反应生成FeCl3。 2.氯气能使湿润的蓝色石蕊试纸先变红后褪色的原因是氯 气与水生成了酸性物质(2012· 上海高考) (× )
返回
2.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 (2012· 山东高考) (×)
解析:因混淆Cl2和SO2的漂白原理而造成判断错误;Cl2的漂
白是由于Cl2与水反应生成了具有强氧化性的HClO,而SO2 的漂白则是SO2与有色物质结合生成了不稳定的无色物质。
3.向溶液中滴加酸化的 Ba(NO3)2 溶液出现白色沉淀,说明该 溶液中一定有 SO2-(2012· 山东高考) 4
返回
2.设计实验证明SO2具有还原性。
提示:SO2能使酸性KMnO4溶液或溴水褪色,证明
SO2具有还原性。 3.足量的Zn与一定量的浓H2SO4反应产生的气体是 什么?其物质的量与消耗的Zn有什么关系? 提示:产生的是SO2和H2的混合气体,根据物质得失
电子守恒,产生H2和SO2的物质的量之和与消耗的Zn的物
4.设计实验证明氯酸钾中含有氯元素。 提示:
返回
[归纳· 助学]
1.氯及其化合物之间的相互转化
返回
2.卤素单质及其化合物的重要性质 (1)Fe 与 Cl2、Br2 反应生成高价的金属卤化物(FeCl3、 FeBr3),Fe 与 I2 反应生成低价的金属卤化物(FeI2)。 (2)次氯酸(HClO)的三种性质: 光照 ①不稳定性:2HClO=====2HCl+O2↑; ②弱酸性:酸性比碳酸的弱; ③强氧化性。
- - - -
(× )
-
解析:因未能排除 SO2 造成的干扰而失误;酸性条件下 3
2 2 NO3 具有强氧化性,能将 SO3 氧化成 SO4 而干扰 SO2 的 3
检验。
返回
[思考· 回顾] 1.二氧化氮和溴蒸气都是红棕色的气体,如何通过实 验鉴别二者?
提示:①用水鉴别。加水振荡后,水层无色的为NO2,
返回
(3)ClO 不论是在酸性条件还是在碱性条件下均能体现强 氧化性,如 ClO 与 SO2 、I 、Fe2 均不能大量共存。 3 (4)与卤素单质有关的置换反应: ①Cl2+2NaBr===Br2+2NaCl Cl2+2KI===I2+2KCl ②Br2+2KI===I2+2KBr ③2F2+2H2O===O2+4HF ④Cl2+H2S===S↓+2HCl 3Cl2 + 2NH3===N2 + 6HCl( 或 3Cl2 + 8NH3===N2 + 6NH4Cl)
(3)Cl2 和 SO2 均具有漂白性,但将二者等体积混合,通 入品红溶液中,品红却不褪色,原因是二者正好反应生成硫 酸和盐酸。
2 (4)SO2-、SO3-的检验: 4
①SO2-先加入足量稀盐酸,无沉淀产生,再加入 BaCl2 4 溶液产生白色沉淀。 ②SO2-加入 BaCl2 溶液,产生白色沉淀,再加稀盐酸, 3 产生无色有刺激性气味能使品红溶液褪色的气体。
1.用湿润的蓝色石蕊试纸检验氨气(2012· 福建高考)
(× )
解析:因对NH3的检验方法不熟练而造成判断错误;能使
湿润的红色石蕊试纸变蓝的气体是NH3,而使湿润的蓝色
石蕊试纸变红的气体是酸性气体(如HCl等)。
返回
2.浓硝酸中加入过量铁粉并加热的离子方程式:Fe+3NO3 △ + + +6H =====Fe3 +3NO2↑+3H2O(2012· 四川高考)( × )
返回
(3)非金属单质一般不跟非氧化性酸作用,但 Si 能跟氢氟 酸作用:Si+4HF===SiF4↑+2H2↑。 (4)酸性氧化物一般不与酸作用, SiO2 能与氢氟酸作用。 但 (5)H2CO3 的酸性强于 H2SiO3,所以有 Na2SiO3+CO2+ H2O===H2SiO3↓ + Na2CO3 , 但 在 高 温 下 , Na2CO3 + 高温 SiO2=====Na2SiO3+CO2↑也能发生。
非金属元素及其化合物是历年高考命题的重点,新课 标选取了四种典型的非金属元素(氯、氮、硫和硅)及其重要 化合物为代表物,主要介绍了它们的重要性质及应用。常 见非金属性质的命题方式较为灵活,常结合氧化还原反应, 弱电解质的电离平衡,离子反应,实验设计等知识进行试 题设计,充分体现了新课程下三种能力的考查。
水层为橙红色的为溴蒸气; ②用AgNO3溶液鉴别。加入AgNO3溶液、振荡,有浅黄 色沉淀生成的为溴蒸气,无沉淀生成的为NO2; ③用热水鉴别。将容器浸入热水中,气体颜色加深的为
NO2,气体颜色不变的为溴蒸气。
返回
2.用浓氨水和生石灰混合能制取NH3吗?理由是什么?
提示:能;理由是:①生石灰能与水反应,消耗水有利 于 NH3 的逸出;②生石灰与水反应放热,加热有利于 NH3 的逸出;③生石灰与水反应生成 Ca(OH)2,增大了溶液中 c(OH ),使平衡 NH3+H2O 3· 2O 4 +OH , NH H NH 逆 向移动,有利于 NH3 的逸出。
质的量相等。
返回
[归纳· 助学] 1.硫及其化合物之间的相互转化
2.硫及其化合物的重要性质 (1)SO2具有还原性,能被卤素单质(Cl2、Br2、I2)的水溶 液氧化,但SO2不能被浓H2SO4氧化。
(2)CO2通入Ba(NO3)2溶液中无沉淀生成,但SO2通入
