铝三角及其图像
人教版高中化学必修1课件 “铝三角”的转化关系

“铝三角”的转化关系
(2 ) 沉淀Al(OH)3物质的量为: 3.12g/78g/mol=0.04mol Al3+为0.05mol 1)若Al3+过量,耗NaOH 0.04×3=0.12mol a=2.4mol.l-1 2)若Al3+完全沉淀, Al(OH)3为0.05mol ;耗NaOH 0.15mol, 溶解0.01mol Al(OH)3需NaOH 0.01mol, 共需NaOH 0.16mol ∴a=3.2mol.l-1 从上面的解题过程可以看出,关键是明确化学原理,掌握Al3+ 与OH- 、AlO2-与H+量的相互关系,再进行综合分析。 可见Al3+、Al(OH)3 、AlO2-之间的应用非常广泛,但无论题型 怎样变化,只要掌握了它们之间的相互关系讲就能迎仞而解。
“铝三角”的转化关系 2、 Al(OH)3的制取问题
从“铝三角”可知,制取Al(OH)3的较好途径有:
Al3++3NH3· H2O = Al(OH)3↓+3NH4+
注:不能用强碱
AlO2- +CO2(过量) +2H2O = Al(OH)3↓+HCO3-
注:不能用强酸
“铝三角”的转化关系
例:某无色溶液可能由Ba(NO3)2、MgCl2、KOH、 KHS、Al2(SO4)3中的一种或几种混合而成,在此溶液中 逐滴加入稀HNO3,先产生白色沉淀,而后白色沉淀又会溶 解,则该溶液中所含的溶质是上述物质中的 溶于水得到的。其相互反应的离子方程式 是 。 【解析】由“溶液中逐滴加入稀HNO3,先产生白色沉淀, 而后白色沉淀又会溶解”可得溶液中含AlO2-,并由Al3+和过 量OH-反应得到,因此溶液中所含的溶质为KOH(过量) Al2(SO4) 反应的离子方程式是Al3++4OH-= AlO2-+2H2O
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
第二讲“铝三角”及其图像
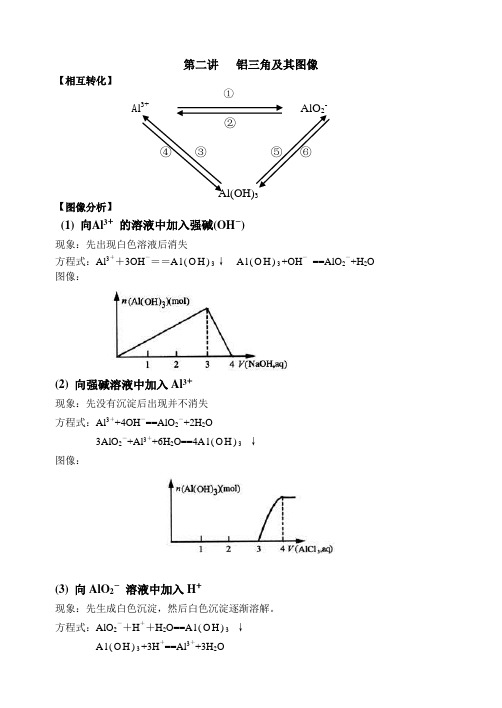
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
铝三角

元素化合物知识作为其他化学知识的载体,在中学化学中占有举足轻重的地位。
纵观近几年的高考试题,铝、氧化铝、氢氧化铝、常见的铝盐(如氯化铝、明矾等)一直是命题的热点。
Al3+、Al(OH)3、AlO2-的相互转化,应用在离子分离(如Mg2+、Al3+的分离)、共存及推断中的试题屡屡出现。
2001年开始高中化学教学采用了新教材。
不难发现铝这一节的内容与原教材相比,有了较大幅度的调整——将其改编在平衡章节之后,要求学生用平衡的理念来分析。
这势必对学生这一节的学习,提出了更高的要求。
而同为金属的镁、铁的章节却做了大幅度的删减。
因此,大胆假设今后几年试题仍将在Al与酸反应、Al3+与碱反应,AlO2-与酸反应的离子方程式书写以及计算、图象分析等方向作文章。
传统的教学方式中,往往习惯于采用“铝三角”来教学。
铝三角可以表明Al3+、Al(OH)3、AlO2-之间存在一定关联,三者之间可以通过加入酸或者碱相互转化。
然而关键的定量关系(Al3+与OH-相互滴加产物的讨论等)不能通过“铝三角”得以体现。
因为,铝三角忽略了最为关键的一点:AlO2-是Al(OH)3在OH-过量时产生的。
为了解决这一问题,笔者大胆提出“线型”学铝策略。
一.线型学铝概念的提出“线型学铝”策略中所谓的“铝线”,其实就是由H+ Al3+ Al(OH)3 AlO2- OH-五个粒子所构成的一条关系线。
出于H+、OH-与Al3+、Al(OH)3、AlO2-的紧密关系考虑,与“铝三角”不同,“铝线”中加入了H+、OH-这两种离子。
感觉上,粒子数的增加,使问题变的更为复杂;而实际上,只是将原本转换关系中隐藏的粒子更直观、更清晰表现出来。
二.线型学铝概念的剖析“线型学铝”基本内容可以由四句话来概括——相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键。
(一)相邻粒子不反应——解决粒子间共存问题有铝元素参加的粒子间共存问题的讨论一直是会考、高考的热点,2004年的浙江省会考试卷中就有两题(第4题、第23题)涉及这一内容。
铝三角讲义

“铝三角”的图像分析及计算【相互转化】①A l3+AlO2-②④③⑤⑥3离子方程式:①②③④⑤⑥一、图像分析AlCl3溶液中滴加NaOH溶液NaOH溶液中滴加AlCl3溶液AlCl3溶液中滴加氨水NaAlO2溶液中滴加盐酸盐酸中滴加NaAlO2溶液向NaAlO2溶液中通CO2气体例 1. 向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
二、公式分析铝及其化合物常见题型的计算公式如下:I. 与NaOH反应生成沉淀的质量①当时,。
②当时,。
③当时,。
II. 与强酸()反应生成沉淀的质量①当时,。
②当时,。
③当时,。
III. 的混合溶液与反应时,求的物质的量。
若与的反应关系如下图,则①②例2:将100mL 氯化铝溶液跟苛性钠溶液混合后,得到沉淀,此时消耗苛性钠溶液的体积是()A. 250mLB. 375mLC. 475mLD. 500mL解析:由I中公式①可得:由I中公式②可得:。
选B、C项。
三、守恒(电子守恒、质量守恒、电荷守恒)分析1.质量守恒例3. 向一定量的Fe、FeO和Fe2O3的混合物投入100 ml 1 mol/L的盐酸,恰好使混合物完全溶解,放出224 ml(标准状况)的气体,所得溶液中,加入KSCN溶液无血红色出现,若用过量的CO在高温下还原相同质量的混合物,能得铁的质量为()A 11.2 gB 5.6 gC 2.8 gD 无法计算2.电荷守恒例4:将K2SO4和Al2(SO4)3和KAl(SO4)2三种混合溶液加H2SO4酸化。
测得C(SO42- )=0.105 mol/L,C(Al3+)=0.055 mol,pH=2.0(假设H2SO4完全电离为H+和SO42- ) 则C(K+)为:A. 0.045 mol/LB. 0.035 mol/LC. 0.055 mol/LD. 0.040 mol/L四、终态分析例5 将10.2 g的镁和铝投入1000 ml 2 mol/L的盐酸中,金属完全溶解:再加入4 mol/L 的NaOH溶液,若要使生成的沉淀最多,则应加入NaOH溶液的体积是()A 100 mlB 700 mlC 600 mlD 500 ml五、得失电子守恒与终态法结合例6:将5.1 g镁和铝投入500 ml 2 mol/L的盐酸中,生成氢气0.5 g,金属完全溶解:再加入4 mol/L的NaOH溶液,(1)若要使生成的沉淀最多,则应加入NaOH溶液的体积是()A. 200 mlB. 250 mlC. 425 mlD. 560 ml(2)生成沉淀的质量最多是()A. 22.1 gB. 8.5 gC. 10.2 gD. 13.6 g作业1、Al2(SO4)3和MgSO4混和,加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是A. 2:1B. 1:2C. 1:1D. 1:32、一定量的Fe和Fe2O3的混合物投入250 ml 2mol/L的硝酸溶液,反应完全后,生成1.12L NO气体(标准状况下),再加入1 mol/L的NaOH溶液,要使铁元素完全沉淀下来,所加NaOH溶液的体积最少为()A 450 mlB 500 mlC 400 mlD 不能确定3、将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系(1)求Mg、Al的质量各是多少?(2)求盐酸的物质的量浓度为多少?。
金属及其 化合物 铝三角及图像

第三章 金属元素及其化合物 第6课时 “铝三角” 和铝的图像
复习重点: 1、铝三角。 2、有关铝的图像问题。 复习难点:有关铝的图像问题。
华美实验学校
曾维玲
一、铝三角的相互转化 Al
12
13
Al2O3
⑦
Al(OH)3
Al3+
⑥ ⑤
AlO2—
写出上图铝三角中转化的离子反应方程式:
13
F2>O2>Cl2 > Br2 >Fe3+> I2 > S
AlO2-、Al(OH)3、OH-、 CO32- OH-、AlO2-、CO32- 、HCO3- 、 Al(OH)3 B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+ I-、Fe2+ 、Br-
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:
KOH、Ba(OH)2、BaCO3 Ba(OH)2、KOH、 K2CO3、 BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉: Ag+、Cu2+、H+、Fe2+
K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag Pt Au 单质还原性越来越弱
K +Ca2+ Na +Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu 2+ Fe3+ Hg2+ Ag+ 离子氧化性越来越强
当堂训练
1.向AlCl3溶液中滴加NaOH溶液,加入的NaOH溶液的体积与沉 淀的质量之间的关系如右图所示: (1)图中A点表示的意义是
铝三角的图像分析及计算一课的教学课件 - PowerPoint 演示文稿

元素守恒 电荷守恒 得失电子守恒
【变式训练1】 Al2(SO4)3和MgSO4混和,加适量水溶解,再加 入KOH溶液,析出的沉淀量(W)与KOH溶液体 积(V)的关系如图,则Al2(SO4)3和MgSO4的物质
n[Al(OH)3](mol)
01 2 3 4 5 滴加NaAlO2溶液的体积(V)
二、相关图像
向NaAlO2溶液中 通入CO2气体
AlO2- +CO2 + 2H2O = Al(OH)3 + HCO32AlO2- +CO2 + 3H2O = 2Al(OH)3 + CO32-
n[Al(OH)3](mol)
谢 谢!
用图象法会更直观:
0.39
V1
V2
mAl(OH)3(max)=0.78g.78
V1=7.5mL
20-V2 20-15
=
0.39 0.78
V2=17.5mL
向AlCl3溶液中 滴加NaOH溶液
Al3+ +3OH-=Al(OH)3 Al(OH)3+OH- = AlO2- + 2H2O
n[Al(OH)3](mol)
01 2 3 4 5 滴加NaOH溶液的体积(V)
二、相关图像
向NaOH溶液中 滴加AlCl3溶液
Al3+ +4OH-= AlO2- + 2H2O 3AlO2- + Al3+ + 6H2O=4Al(OH)3
(3)上述两步总反应用总的离子方程式可表示为: Al3++4OH-=AlO2-+2H2O
氢氧化铝、铝三角、图像

铝三角复习Al(OH)3的性质:两性氢氧化物Al(OH)3 + HCl === ;Al(OH)3 + NaOH === 。
一、Al(OH)3的两性电离方程式:()()由电离方程式可推出:二、铝三角(Al3+、Al(OH)3、AlO2-之间的转化关系)涉及到的四个离子方程式:① Al3+ + 3OH- === ② Al(OH)3 + OH- === ③ AlO2- + H+ + H2O === ④ Al(OH)3 + 3H+ ===(1) Al(OH)3 (2) Al(OH)3Al3+ AlO2- Al3+ AlO2-离子方程式:离子方程式:(1)(2)联合推出Al(OH)3Al3+ AlO2-三、与生成Al(OH)3沉淀有关的图像:1.把强碱溶液逐滴加到铝盐(Al3+)溶液中至过量 2. 把铝盐(Al3+)溶液逐滴加到强碱溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:3.把强酸溶液逐滴加到AlO2- 溶液中至过量 4. 把AlO2- 溶液逐滴加到强酸溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:5.把氨水逐滴加到铝盐(Al3+)溶液中至过量 6. 把CO2通入到AlO2- 溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:7.往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量①现象:③图像:②有关反应:四、制备Al(OH)3的方法:方法1:向铝盐溶液中加入化学方程式:离子方程式:方法2:向NaAlO2溶液中通入足量化学方程式:离子方程式:方法3:溶液和溶液混合化学方程式:离子方程式:课堂练习:1.已知某溶液中可能有Mg2+、Al3+、NH4+中的一种或几种,向其中加入NaOH溶液至过量,得到的图像可能如下:由图像分析溶液中的成分:①②③④2.向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
【练习】
1.有Mg、Al粉末10.2 g,将它溶于500 mL 4 mol· L-1的盐酸中,要使 得到的沉淀最多,则加入2 mol· L-1的NaOH溶液的体积为 A.1000 mL C.100 mL B.500 mL D.1500 mL
2或 1
0 n[Al(OH)3] ↓ 1
1
n(CO2)
10.往AlCl3和HCl混合溶液中加NaOH至过量 Al3+ + 3OH— = Al(OH)3 ↓
2 3 4
Al(OH)3 + OH— = AlO2— + 2H2O
5 n(NaOH)
OH—+H+ = H2O 1
11. 往Al3+、Mg2+、H+各1mol的混合溶液中加 NaOH溶液至过量
2 3 4 n(NaAlO-2)
5.往NaAlO2和NaOH混合溶液中加入HCl溶液至过量
n[Al(OH)3] ↓ 1
AlO2—+H++H2O=Al(OH)3↓ OH—+H+=H2O
n[Al(OH)3] ↓ 1
Al(OH)3+3H+=Al3++3H2O
n(HCl)
2
3
4
5
6.往AlCl3溶液中滴加入氨水至过量
其中的定量关系。
分析综合问题时,要用顺序法把化学反应按先后排列出来,便于思考, 否则思维易混乱。用假设法分析多个反应中哪个优先发生(至少可以这样思
考问题,不影响解题结果),优先发生反应的产物必须不与溶液中其他成分反
应,否则不能共存。 【变式】 向20 mL 2 mol/L的AlCl3溶液中,加入30 mL烧碱溶液,充分以 Al3+与OH-反应生成Al(OH)3的计算有三种类型: ? b a 知Al3+和OH-,求Al(OH)3 知Al3+和Al(OH)3,求OH- 知OH-和Al(OH)3,求Al3+ 【答案】 1 mol·L-1 或5 mol·L-1
(2)、当a、b满足________条件时,无沉淀产生。
(3)、当a、b满足________条件时,先有沉淀生成,后又有部分沉淀 溶解,此时Al(OH)3的质量为________g。 【解析】 依题意知在AlCl3溶液中加入NaOH溶液有如下两个反应发生: ① AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl ,② AlCl3 + 4NaOH = NaAlO2 + 3NaCl + 2H2O 。据此可以看出: (1)、当 a ≤ 3b 时只发生反应① ,此时NaOH不足量,产生沉淀的量取决于 NaOH。n[Al(OH)3]= n(NaOH)/3。所以答案为:0.05a/3 mol。 (2)、如果无沉淀生成,Al 元素全部以AlO2—形式存在。此时,有: n(AlCl3)∶n(NaOH) ≤ 1∶4 ,即 a∶b ≥ 4∶1,故答案为:a ≥ 4b。 (3)、此种情况应当是两个反应均发生,铝元素以Al(OH)3和AlO2—两种形式 存在。则符合关系: 整理:
n[沉淀] 2 1
Al(OH)3 + 3H+ = Al3+ + 3H2O Mg(OH)2+2H+ = Mg2+ +2H2O
1
2
3
4
5
6
7
n(HCl)
将一定质量的镁、铝合金投入一 定浓度的100 mL盐酸中,使合金全部溶解,向 所得溶液中滴加5.00 mol· L-1的NaOH溶液至 过量,生成沉淀的质量与加入NaOH溶液的体 积的关系如图所示。试求:(1)、原合金中铝的 质量分数。(2)、盐酸的物质的量浓度。
n[沉淀] 2
Mg2++2OH—=Mg(OH)2↓ Al3++3OH—=Al(OH)3↓
1
Al(OH)3+OH—= AlO2—+2H2O
n(NaOH)
1
2
3
4
5
6
7
OH—+H+ = H2O
12. 往OH—、AlO2— 、 Mg(OH)2各1mol的混合 溶液中加入盐酸至过量
OH— + H+ = H2O AlO2— + H+ + H2O = Al(OH)3↓
A
2. 向30mL1mol/L的AlCl3溶液中逐滴加入4mol/L的NaOH溶液,若产 生0.78g白色沉淀,则加入的NaOH溶液的体积可能为 A. 3mL 【析解】 B. 7.5mL C. 15mL D. 17.5mL
B
因n(AlCl3)= 0.03mol>n(Al(OH)3) = 0.01mol,可知有两种
Al3++4OH-=AlO2-+2H2O
(13)AlO2-+4H+=Al3++2H2O
3.“铝三角”的应用 (1)、鉴别(利用滴加顺序不同,现象不同)
AlCl3溶液中滴加NaOH溶液现象为:先生成白色沉淀,后沉淀又
溶解。而NaOH溶液中滴加AlCl3溶液现象为:开始无明显现象,后产
生白色沉淀,不溶解。
4
n(NaOH)
2.往NaOH溶液中加入AlCl3溶液至过量
n[Al(OH)3] ↓ 4
Al3+
Al3+ + 3AlO2— +6H2O = 4Al(OH)3↓ + 4OH— = AlO2— + 2H2O
0 1 2 3 4 n(AlCl3)
3.往NaAlO2溶液中加入稀盐酸至过量
n[Al(OH)3] ↓
3、铝三角的计算
因 AlCl3 与 NaOH 反应生成的 Al(OH)3 能和 NaOH 继续反应,其计 算方法类似于CO2与澄清石灰水的反应,其规律如下:
(1).求产物Al(OH)3的物质的量
当 n(OH-) ≤ 3n(Al3+) 时,n[Al(OH)3]= 1∕3 n(OH-) 当3n(Al3+)<n(OH-)<4n(Al3+)时,n[Al(OH)3]=4n(Al3+)-n(OH-)当
求沉淀的量的方法很多。 【解法1:代数法】 设反应①中,AlCl3物质的量为x,则Al(OH)3的物
质 的 量 为 x , NaOH 的物质的量为 3x 。 反 应 ② 中 AlCl3 物质的量为 y ,
NaOH的物质的量为4y。有 x .05a mpl
1
Al(OH)3 + 3H+ = Al3+ + 3H2O
AlO2— + H+ + H2O =Al(OH)3↓
1 n[Al(OH)3] ↓ 4 2 3 4 n(HCl)
4.往稀盐酸溶液中加入 NaAlO2至过量
Al3++3AlO2—+6H2O=4Al(OH)3↓ AlO2— + 4H+ = Al3+ + 2H2O 1
⑤ 2Al+2OH-+2H2O=2AlO2-+3H2↑
⑥ Al2O3+6H+=2Al3++3H2O
⑦ Al2O3+2OH-+=2AlO2-+H2O
⑧ Al3++3OH-=Al(OH)3↓
⑨ Al(OH)3+3H+=Al3++3H2O
⑩ Al(OH)3 +OH-= AlO2-+2H2O ⑾ AlO2-+H++H2O=Al(OH)3↓ ⑿
例4
(2) 、由图示可知完全沉淀时消耗 NaOH溶液160mL,最终溶液中只 【析解】 观察图象可知:(1)、镁、铝溶于 含NaCl ,相当于中和剩余盐酸和溶解Mg、Al 所消耗的盐酸的总量。故 盐酸后,盐酸过量,中和过量盐酸消耗的 NaOH 溶液20 mL。 有: (2)、当沉淀质量不变时,此时沉淀 HCl —————— NaOH (11.6 g)只有Mg(OH)2,则沉淀达到最 (1)36% 0.800mol 0.16L × 5.00mol/L 大量时,Al(OH) 的质量为 (19.4 - 11.6) g ,沉淀减少的过程中,消耗的 NaOH 3 -1
