铝三角及其铝图像问题
铝三角及其图像

Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
铝三角习题分析

①过量OH— ②过量H + ③H + ④OH — ⑤H + ⑥OH — “铝三角”的图像分析及计算知识点一、铝三角1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系2、铝三角的应用①制取Al(OH)3常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32-知识点二、铝的化合物的有关图象1、基本图象①向铝盐溶液中逐滴滴加强碱性溶液直至过量 如若将强碱性溶液换成氨水又是怎样的图像?现象:先产生沉淀,后沉淀消失。
现象:Al 3+ + 3OH -= Al(OH)3↓ 离子方程式:Al(OH)3 + OH - = AlO 2-+2H 2O如若将强碱性溶液换成氨水又是怎样的图像?③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 将强酸溶液换成弱酸(如通入CO 2)又是怎样的图像?现象: 现象:离子方程式: 离子方程式:Al 3+ Al(OH)3AlO 2—2、基本图象的拓展①若AlCl3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?现象:开始产生沉淀,之后沉淀部分溶解写出涉及的离子方程式:Mg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O②若AlCl3溶液中除混有外MgCl2,还混有盐酸,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应有何不同,图象有什么样的变化?现象:开始无沉淀,之后产生沉淀,之后沉淀部分溶解H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O③若AlCl3溶液中除混有MgCl2和盐酸外,还混有NH4Cl,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应又有何不同,图象又有什么样的变化?现象:离子方程式:H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓NH4++ OH-NH3·H2OAl(OH)3 + OH - = AlO 2-+2H 2O【变式训练1】Al 2(SO 4)3和MgSO 4混和,加适量水溶解,再加入KOH 溶液,析出的沉淀量(W)与KOH 溶液体积(V)的关系如图,则Al 2(SO 4)3和MgSO 4的物质的量之比是A . 2:1B . 1:2C . 1:1D . 1:3 【典型例题】例1 向30 mL 1 mol·L -1的AlCl 3溶液中逐渐加入浓度为4 mol ·L -1的NaOH 溶液,若产生0.78 g 白色沉淀,则加入的NaOH 溶液的体积可能为 ( )A .3 mLB . mLC .15 mLD . mL例2某无色溶液中,已知含有H +、Mg 2+、Al 3+等阳离子,逐滴加入NaOH(溶液),则消耗NaOH(溶液)体积(x 轴)和生成沉淀量(y 轴)之间的函数关系,可用下图表示,则下列图中正确的是 ( )例3 将0.1 mol 的镁、铝混合物溶于100 mL 2 mol ·L -1的H 2SO 4溶液中,然后再滴加1 mol ·L -1的NaOH 溶液。
【原创】 铝三角及图像专题

将0.1 mol的镁、铝混合物溶于100 mL2mol/LH2SO4溶液中,然后再滴加
1 mol/LNaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量
m随加入NaOH溶液的体积V变化如右图所示。
当V1=160mL时,则金属中n(Mg)=_____mol, V2=______mL。 (2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入
同步练习: 0.1molAl3+
0.05molAl(OH)3
向50 mL1 mol·L-1的Al2(SO4)3溶液中加入100 mLKOH溶液,充
分反应得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( CD )
A. 1 mol·L-1 B. 3 mol·L-1 C. 1.5 mol·L-1 D. 3.5 mol·L-1
Al(OH)3 + 3 H+ =Al3+ + 3H2O n (Al(OH)3 )
0 1
3
n (NaAlO2)
7.向 AlCl3、MgCl2 溶液中滴加 NaOH溶液至过量
Mg2+ + 2OH- =Mg(OH)2↓ Al3+ + 3OH-= Al(OH)3↓ Al(OH)3 + OH- =AlO2- + 2H2O
铝三角及其图 像专题
Al(OH)3
Al3+
强碱 OH强酸 H+
Al3++3OH- =Al(OH)3↓ Al(OH)3 + OH- = AlO2- + 2H2O
Al3++4OH- = AlO2 -+ 2H2O
《铝三角及其图像》课件

为何称为“铝”三角?
“铝”表示“两者之一”,因为铝三角有两条边长相等的特点。
铝三角的性质和特点
1 直角性质
2 边长关系
铝三角的其中一个角度是直角(90°),使得 它在几何推理中具有特殊意义。
铝三角的两个铝腿边长度相等,与铝基边分 别满足勾股定理的关系。
铝三角的实例和案例
铝三角桥梁
铝三角雕塑
铝三角结构常用于构建大型桥梁, 如海湾大桥和天堂大桥,以保证 结构的稳定性。
铝三角被艺术家用于创作抽象的 雕塑作品,探索形态和空间之间 的关系。
铝三角机器人
工程师和科学家使用铝三角结构 设计机器人,以实现高强度和灵 活性的机械运动。
总结和要点
1 铝三角定义
铝三角是具有两条边长相 等的直角三角形,稳定性 好。
科技领域中的铝三角
铝三角在工程计算、电子器件和 机器人技术等领域中具有重要应 用。
铝三角在几何推理中的作用
1
勾股定理的证明
铝三角的特性使得它成为勾股定理的重要元素,用于证明数学中的几何关系。
2
角度关系推导
通过研究铝三角的角度关系,可以推导出更复杂的三角形和多边形之间的角度性 质。
3
图形相似性判断
铝三角的比例关系可以用于判断两个图形是否相似,为模型设计和工程规划提供 依据。
《铝三角及其图像》
本课件将介绍铝三角的定义、性质和特点,以及铝三角的图像及其应用。探 讨铝三角在几何推理中的作用,并通过实例和案例加深理解。最后进行总结 和要?
铝三角是指一个具有两条边长相等的直角三角形。其中一条边称为铝基,另外两条边分别称 为铝腿。
如何确定铝三角?
铝的图像

高二化学秋季班(教师版)教师日期学生课程编号03 课型复习课题铝的图像及铝三角教学目标1、数量掌握与铝的化合物有关的基础图像问题,能够知道解题图像题的一般思路。
2、掌握铝三角中涉及到的相关方程式以及应用。
教学重点1.与铝的化合物有关的基础图像问题;2.解图像题的一般解题思路。
3.铝三角的转化。
教学安排版块时长1 知识梳理60mins2 课堂小憩5mins3 典例解析50mins4 师生总结5mins5 课后作业40mins铝的图像及铝三角知识梳理一、铝的相关图像汇总实验操作实验现象反应原理坐标图像1.往AlCl3 溶液中先产生白色沉逐滴加入NaOH 淀,后溶解溶液至过量2.往NaOH 溶液先无明显现中加入 AlCl3 溶液象,后产生沉至过量淀3.往NaAlO2 溶液先产生沉淀,中加入稀盐酸至后溶解过量4.往稀盐酸溶液先无现象,后中加入NaAlO2 至产生沉淀过量5.往NaAlO2 和无现象,产生NaOH 混合溶液中沉淀,后溶解加入HCl 溶液至过量6.往AlCl3 溶液中产生沉淀,后滴加入氨水至过沉淀的量不变量高二化学秋季课程铝的图像及铝三角2/ 228.往NaAlO2 溶液产生沉淀,后中加入 AlCl3 溶液沉淀的量不变9.往NaAlO2 溶液产生沉淀,后中通入CO2(或过沉淀的量不变量)10.往AlCl3 和HCl先无明显现混合溶液中加象,后产生沉NaOH 至过量淀,最后沉淀溶解11.往Al3+、Mg2+、先无明显现H+各 1mol 的混合象,再产生沉溶液中加NaOH 淀,后部分溶溶液至过量解。
12.往OH-、AlO2-、开始沉淀量不Mg(OH)2 各1mol变,再增加,的混合溶液中加后完全溶解入盐酸至过量【答案】实验操作实验现象反应原理坐标图像1.往AlCl3 溶液中逐滴加入NaOH 溶液至过量先产生白色沉淀,后溶解Al3+ + 3OH-→Al(OH)3↓Al(OH)3+OH-→AlO-2 + 2H2O2.往NaOH 溶液中加入AlCl3 溶液至过量先无明显现象,后产生沉淀Al3+ + 4OH-→AlO-2 + 2H2OAl3++3AlO2- +6H2O→4Al(OH)3↓3.往NaAlO2 溶液高二化学秋季课程铝的图像及铝三角3/ 224.往稀盐酸溶液先无现象,后中加入NaAlO2 至产生沉淀AlO-2 +4H+→Al3+ +2H2O过量Al3++3AlO-2+6H2O→4Al(OH)3↓5.往NaAlO2 和NaOH 混合溶液中加入HCl 溶液至过量无现象,产生沉淀,后溶解OH-+H+→H2OAlO-2+ H+ + H2O→Al(OH)3↓Al(OH)3 + 3H+→Al3+ + 3H2O6.往AlCl3 溶液中产生沉淀,后滴加入氨水至过沉淀的量不变Al3++3NH3·H2O→Al(OH)3↓+量3NH4+7.往AlCl3 溶液中产生沉淀,后加入 NaAlO2 溶液沉淀的量不变Al3++3AlO-2 +6H2O→4Al(OH)3↓8.往NaAlO2 溶液产生沉淀,后中加入 AlCl3 溶液沉淀的量不变Al3++3AlO-2+6H2O→4Al(OH)3↓9.往NaAlO2 溶液产生沉淀,后2AlO-2+CO2+3H2O→2Al(OH)3↓中通入CO2(或过沉淀的量不变+CO32-量) 或 AlO-2+CO2 +2H2O→Al(OH)3↓+HCO32-10.往AlCl3 和HCl OH-+H+→H2O先无明显现混合溶液中加象,后产生沉Al3+ + 3OH-→Al(OH)3 ↓NaOH 至过量淀,最后沉淀Al(OH)3 + OH-→AlO-2溶解+ 2H2O11.往Al3+、Mg2+、OH-+H+→H2O先无明显现H+各 1mol 的混合Al3+ + 3OH-→Al(OH)3 ↓高二化学秋季课程铝的图像及铝三角4/ 2212.往OH-、AlO2-、OH-+H+→H2O开始沉淀量不Mg(OH)2 各1mol变,再增加,AlO-2+ + H2O→Al(OH)3↓的混合溶液中加后完全溶解Al(OH)3 + 3H+ →Al3+ + 3H2O入盐酸至过量Mg(OH)2+2H+→Mg2+ +2H2O【练一练】1.将物质 X 逐渐加入(或通入)Y 溶液中,生成沉淀的量与加入 X 的物质的量关系如图所示,符合图示情况的是()A B C DX CO2 HCl NaOH AlCl3Y Ca(OH)2 NaAlO2 AlCl3 NaOH【答案】C2.向物质的量浓度均为 1 mol·L-1 的 AlCl3 和盐酸的混合溶液中逐滴滴入 NaOH 溶液,下图[n 表示 Al(OH)3 的物质的量、V 表示 NaOH 溶液的体积]能正确表示这个反应过程的是()【答案】D二、铝三角的转换完成上述的离子方程式:(1)①____________________________________________________②____________________________________________________③____________________________________________________(2)____________________________________________________(3)____________________________________________________(4)____________________________________________________(5)①____________________________________________________②____________________________________________________(6)____________________________________________________【答案】(1)①Al3++3NH3·H2O→Al(OH)3↓+3NH++3AlO-+③Al3++3OH-→Al(OH)3↓(2)Al(OH)3+3H+→Al3 ++3H2O(3)Al3++4OH-→AlO-+→Al3++2H2O-(5)①AlO--++H2O→Al(OH)3↓-(6)Al(OH)3+OH-→AlO-三、铝三角的应用1.判断离子共存Al3+只能存在于强酸性溶液中,不能与显碱性的物质大量共存,如____________________ __________________________等;AlO-2.判断离子先后顺序当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH++、Al3+的混合溶液中逐滴加入 NaOH 溶液,NaOH 先与_______反应,再与______________反应生成沉淀,再与________反应,最后才溶解______________沉淀。
全面剖析“铝三角”及其图像

说 明: 由图3 和图4 不难 看出 ,l H, 淀 A( ) 0 沉 是不溶于弱碱 (H ・2) 。 N , 0 H 4 . 向偏铝酸盐溶液中滴人强酸或向强酸中
注 :I — A (H 的必须 是强 AO一 IO ) 加 酸 过量 因 ̄A0- + 生成AfH 沉 淀 , 12 与H先 l 0 A(H 强酸 才生 成A 而HC I ) O 与 l , 2O等一 些弱 酸则不 能
2AP+ 0H =AO-2 2 . +4 一 l2 H0 +
图6
①段:If4  ̄ 1 H0 AO +H=A 2 2 ②段 :AO- 1+H0 4 I H3 3 l2 A3 6 2= A( ) + + O
说 明 : 入 的 A0- 与 H 反 应 , 成 滴 12先 + 生 A(H I ) O 沉淀 . 马上被H 溶解 为A 而继 继而 + l, 续滴加 的m0一 又与A + , 则 p发生 了双水解 反应 生成 了沉淀 . 直到反应完A + P 达沉淀量最大。 5向偏铝酸盐溶液中缓慢通人至C , . O过量
注 :l A
1 AO j 的必须是强碱过量 , lf Ⅱ /
虽AfH提 两性物质, I H3 l l 0 但A( ) O 只溶解于N 0 aH 等强碱溶液中, H・2等弱碱则不能。 而N 0 H 3 I H3  ̄ 1 H0 . ( ) H A%3 2 AO + 4A *O - 1O )i 1 N 3 2= .P H= (H3 或A H ・ 0 + A %3 H A(H3 3 I ̄ I ) O +NG 5 f H+H0 A(H3 或A0-C 2 . +  ̄ 2= I ) MO 2 O 12 O+ +
滴加偏铝酸盐溶液至过量 ()向偏铝酸 盐溶液 中滴人 强酸至过量 1 ( 图5 。 如 )
第二讲“铝三角”及其图像
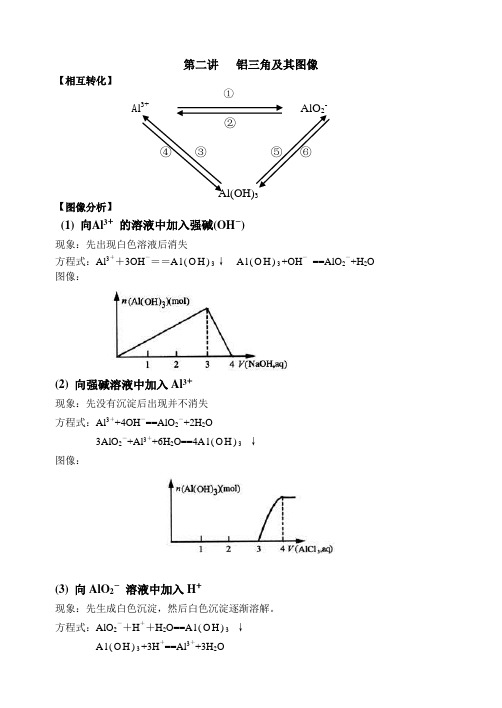
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
(完整版)铝三角及其铝图像问题

铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(OH)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4Al(OH)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(OH)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4Al(OH)3↓图像:具体应用:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加 5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)
现象:先出现白色溶液后消失
方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:
(2) 向强碱溶液中加入Al3+
现象:先没有沉淀后出现并不消失
方程式:Al3++4OH―==AlO2―+2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
(3) 向AlO2―溶液中加入H+
现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓
A l(O H)3+3H+==Al3++3H2O
图像:
(4) 向H+溶液中加入AlO2―
现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
具体应用:
例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?
解:(1) 设原合金中Mg的质量为X,Al的质量为y
Mg -----M g(O H)2Al-----A l(O H)3
24 58 27 78
x 11.6 y 19.4-11.6==7.8
x=4.8 g y == 2.7 g
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)
则c(HCl)== 5*160/100= 8 mol/L
[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )
A.78g
B.15.6g
C.7.8g
D.3.9g
2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
例2、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH 溶液。
请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入
NaOH溶液的体积V变化如右图所示。
当V1=160mL时,
则金属粉末中n(Mg)=mol,V2=mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,
则滴入NaOH溶液的体积V(NaOH)mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条
件的a的取值范围是:。
解:(1) n(H+)=2*0.1*2==0.4 mol
当V1=160mL时,中和过量H+消耗了OH―0.16 mol
则与金属反应用去H+0.4—0.16==0.24 mol
设Mg 的物质的量为x mol,Al的物质的量为y mol
Mg--2H+--Mg2+---2OH―--M g(O H)2Al---3H+---Al3+--3OH―-A l(O H)3
x 2x y 3y
2x+3y==0.24 x+y==0.1 解得,x==0.06 mol y= 0.04 mol
则镁的物质的量为0.06mol ,铝的物质的量为0.04mol
V2===(0.16+2*0.06+3*0.04)/1==0.44L==440 mL
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH) 则NaOH的体积为400 mL
(3) 若沉淀中无A l(O H)3则说明Al3+全部转化为NaAlO2,则
n(NaOH)≧n(NaCl)+n(NaAlO2)==n(HCl)+n(Al3+)
0.45≧0.4+0.1-a 解得,a≧0.05
1>a≧0.05
[点击试题]1.将溶液(或气体)X逐渐加入到(或通入到)一定量的Y溶液中,产生沉淀的量m与加入X物质的量n的关系如下图,符合图中情况的一组物质是
2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/l的盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
(a)混合物中NaOH的质量为,
(b)混合物中AlCl3质量为
(c)混合物中MgCl2质量为,
(d)P点表示盐酸的体积是。
