“铝三角”的图像分析及计算
铝三角及其图像

Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
高中化学铝三角优秀课件

3.向等物质的量浓度的 HCl、AlCl3、NH4Cl、MgCl2 混合溶液中逐滴加入 1 mol·L-1 的 NaOH 溶液,生成沉淀的物质的量与加入 NaOH 溶液的体积关系如图所示。 下列有关说法正确的是( D )
A.在 0~a 段加入的 NaOH 溶液与 NH4Cl 反应 B.在 b~c 段加入 NaOH 溶液发生反应的离子方程式为 Al3++3OH-===Al(OH)3↓ C.在 d~e 段加入 NaOH 溶液发生反应的离子方程式为 Al3++4OH-===AlO- 2 + 2H2O D.在滴加 NaOH 溶液全过程中主要粒子参与反应的先后顺序是 H+、Al3+、 Mg2+、NH+ 4 、Al(OH)3
2
2.应用 (1)判断离子共存问题: ①Al3+与 OH-及 AlO-2 、CO23-、S2-等弱酸根阴离子因生成沉淀或发生相互促进 的水解反应而不能共存。 ②AlO-2 与 H+、HCO-3 以及弱碱阳离子 Al3+、Fe3+等因生成沉淀或发生相互促进 的水解反应而不能大量共存。
3
(2)判断铝元素的存在形式: 可溶性铝盐与强碱(如 NaOH)溶液反应,铝元素的存在形式:
13
2.向含 Na2CO3、NaAlO2 的混合溶液中逐滴加入 150 mL 1 mol·L-1 HCl 溶液, 测得溶液中的某几种离子的物质的量的变化如图所示,则下列说法不正确的是( D )
A.a 曲线表示的离子方程式为 AlO-2 +H++H2O===Al(OH)3↓ B.b 和 c 曲线表示的离子反应是相同的 C.M 点时,溶液中沉淀的质量为 3.9 g D.原混合溶液中的 CO23-与 AlO-2 的物质的量之比为 1∶2
4
(3)进行 Al3+、AlO- 2 的鉴别 ①Al3+―N―H―3·H―2O→白色沉淀(胶状)―过―量―N―H―3―·H―2O→ 沉 说淀明不不消是失Ag+―O―H→- 沉淀消失(证明原溶液含 Al3+)
镁铝图像计算技巧

一、必备知识“铝线法”的基本方法可以由四句话来概括——“相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键”1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:Al3++3OH-(少量)===Al(OH)3↓(2)可溶性铝盐与氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+2.Al(OH)3―→Al3+Al(OH)3溶于强酸溶液:Al(OH)3+3H+===Al3++3H2O3.Al3+―→AlO2-可溶性铝盐与过量的强碱反应:Al3++4OH-(过量)===AlO2-+2H2O4.AlO2-―→Al3+偏铝酸盐溶液与足量的盐酸反应:AlO2-+4H+===Al3++2H2O5.AlO2-―→Al(OH)3 (1)偏铝酸盐溶液中加少量盐酸:AlO2-+H+(少量)+H2O===Al(OH)3↓(2)偏铝酸盐溶液中通入CO2:2AlO2-+CO2(少量)+3H2O==2Al(OH)3↓+CO32-AlO2-+CO2(过量)+2H2O===Al(OH)3↓+HCO3-6.Al(OH)3―→AlO2-Al(OH)3溶于强碱溶液:--二、铝的图像分析1.铝盐溶液和氨水的反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ n沉淀n NH33 .H2O2.向AlCl3溶液中滴加NaOH溶液至过量⑴Al3++3OH-=Al(OH)3↓⑵Al(OH)3+OH-=AlO2-+2H2On沉淀VNaOH3.向NaOH溶液中滴加AlCl3溶液至过量⑴Al3++4OH-= AlO2-+2H2O⑵Al3++ 3AlO2-+6H2O =4Al(OH)3↓n沉淀0 1 2 3 4V AlCl3离子方程式:⑴AlO2-+H++H2O =Al(OH)3↓⑵Al(OH)3+3H+=Al3+ +3H2O图像:n沉淀V0 1 2 3 495.向HCl溶液中滴加NaAlO 2溶液至过量图像:n沉淀VNaAlO20 1 2 3 4⑴AlO 2-+4H + =Al 3+ +2H2O ⑵Al 3++3AlO 2-+6H 2O =4Al(OH)3↓离子方程式看面看线看点跟铝有关的图像分析典例分析1.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )B.向1 L浓度分别为0.1 mol·L-1和0.3mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液D.向AlCl3溶液中滴加过量氨水跟铝有关的图像分析解析 Ba(OH)2和NaAlO2中加入H2SO4,发生的反应依次为,所以加1 L H2SO4时,Ba(OH)2反应完,再加0.5 L H2SO4时,AlO2(-)反应完全,再加1.5 L H2SO4时,Al(OH)3全部溶解,A正确;向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH4+===NH3·H2O、Al(OH)3+OH-===+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH的量之比为3∶1,而图像上看到的是1∶1,B错误;向烧碱溶液中滴加明矾溶液,发生的反应依次是Al3++4OH-==+2H2O、Al3++3+6H2O===4Al(OH)3↓,C错误;AlCl3溶液中滴加过量氨水,沉淀不会溶解,D错误。
高一化学-必修1-铝三角图象问题省优质课赛课获奖课件市赛课一等奖课件

讨论以上反应量与产物关系
Al3+ ---- 3OH- ----Al(OH)3 Al3+ ---- 4OH- ----AlO2-
AlO2- ---- H+ ----Al(OH)3 AlO2- ---- 4H+ ----Al3+
有关铝化合物旳图像问题
1.往AlCl3溶液逐滴加入NaOH溶液至过 量Al3+ + 3OH- = Al(OH)3↓
④△
Al2O3 Fe2O3
过量 盐酸
SiO2 过滤①
SiO2除去
过量
FAHelCCClll33
NaO H 溶液
NaAlO2 NaCl NaOH 溶液
过量 CO2
过滤③
溶液
过滤② Fe(OH)3除去
Al(OH)3
滤液 除去
酸碱(弱)酸
措施2
碱溶法
Al2O3
过量 NaOH
Fe2O3 溶液
SiO2 过滤①
n(NaAlO2)
8.往NaAlO2溶液中加入AlCl3溶液
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
n[Al(OH)3] ↓
4
12 3 4
n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量)
2AlO2- +CO2 +3H2O =2Al(OH)3↓+CO32或AlO2-+CO2 +2H2O =Al(OH)3↓+HCO3-
OH-+H+ = H2O
AlO2- + H+ + H2O =Al(OH)3↓
Al(OH)3 + 3H+ = Al3+ + 3H2O
“铝三角”的图像分析及计算

“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
第二讲“铝三角”及其图像
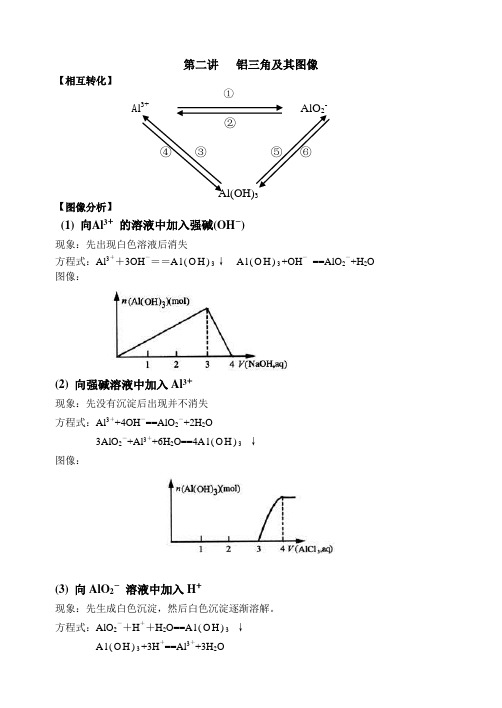
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
第三章第第二节铝三角及其图像高一化学人教版必修第一册

应的离子方程式为H++OH-===H2O。(2)沉淀量最大时所用OH-的 物质的量与200 mL强酸中H+的物质的量相等,n(OH-)=1.0 mol·L- 1×0.52 L=0.52 mol,故n(H+)也为0.52 mol,盐酸的浓度为2.6 mol·L -1。(3)反应Al(OH)3+OH-===AlOtempPic+2H2O用去的n(NaOH) =1.0 mol·L-1×(0.62-0.52) L=0.10 mol,故Al(OH)3的物质的量为 0.10 mol,而Al2O3的物质的量为0.050 mol。根据Al3++3OH- ===Al(OH)3↓,生成Al(OH)3用去0.30 mol NaOH。而生成氢氧化镁用 去0.20 mol NaOH,氢氧化镁的物质的量为0.10 mol,氧化镁、氧化铝 的物质的量之比为2∶1。
达标训练
(2)将混合物中两种金属分离开的最简单的方法是 _________________________。 (3)D―→E的转化中,加入过量X可能是________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式:A―→C: _____________________________ H―→I:________________________________________________________。
A. 答案A B. 答案B C. 答案C D. 答案D
达标训练
4.在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的 体积。从下边图中选出选项:
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量____B______。 (2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量____B______。 (3)向氨水中逐滴滴入氯化铝溶液至过量__A________。 (4)向氯化铝溶液中滴加氢氧化钠至过量___C_______。 (5)向偏铝酸钠溶液滴加盐酸至过量___D___________。 (6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____E________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“铝三角”的图像分析及计算
教学设计
教学目标:1.使学生熟练掌握“铝三角”相关的离子反应方程式
2.学会有关“铝三角”的图像分析
3.学会进行关于“铝三角”的简单计算
教学重点、难点
“铝三角”的图像分析和计算
教学过程:
【学生活动】
①
A l3+AlO2-
②
④③⑤⑥
Al(OH)3
根据铝三角的转化关系图写出相应的离子方程式
【教师】从电荷守恒的角度来帮助学生理解记忆离子方程式
比如:Al3+ AlO2-Al3+带三个正电荷,而AlO2-带一个负电荷,从Al3+转变AlO2-必须要4个负电荷,也就是是4个OH-,因此该离子反应方程式为Al3++4OH-= AlO2-+2H2O 【学生活动】根据反应的不同情况画出图像
【教师活动】帮助学生分析题目的意思,解答相应的问题,并给出评价
反应顺序:
先:Al3++3OH-=Al(OH)3↓
后:Al(OH)3+OH-=AlO2-+2H2O
根据反应的先后和计量系数画出图像
AlCl3溶液中滴加NaOH溶液
【学生活动】根据相关知识解答问题
【典型例题】向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:
(1)图中A点表示的意义是
(2)图中B点表示的意义是
(3)上述两步反应用总的离子方程式可表示为:
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
【教师活动】指导学生用正确的方法解题,并且总结
方法要领:有关图像的问题,通常的解法是“三看、三守恒”
一看面:分析清楚横纵坐标的意义
二看线:图像的整体走势要分析清楚,特别是每段对应的反应情况
三看点:分析透彻各个拐点(开始沉淀、完全沉淀、沉淀溶解等等)
在解题中综合应用:元素守恒、电荷守恒、得失电子守恒
答案:A点表示得到Al(OH)3沉淀的最大值
B点表示Al(OH)3沉淀完全溶解
Al3++4OH-=AlO2-+2H2O
体积有两解V=7.5mL或者V=17.5mL
【学生活动】在对例题掌握到位的基础之上,进行强化的变式训练
【变式训练1】Al2(SO4)3和MgSO4混和,
加适量水溶解,再加入KOH溶液,析出
的沉淀量(W)与KOH溶液体积(V)的关系如图,
则Al2(SO4)3和MgSO4的物质的量之比是
A. 2:1
B. 1:2
C. 1:1
D. 1:3
答案:C
【变式训练2】
将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶
液,用1mol/LNaOH溶液滴定得下图关系
(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
答案:m(Mg)=1.44g
m(Al)=1.08g
c(HCl)=1.4mol/L
【教师活动】
总结方法、布置作业。
