(完整版)铝三角习题精选
铝三角页题

铝三角A组1.向NaAlO2浓溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是A NO2B CO2C NH3D CO2.将下列试剂加入或通入到偏铝酸钠溶液中最终可析出沉淀的是A 盐酸(过量)B 二氧化碳C 浓氨水D 氯化铝溶液3.在溶液中能与AlO2-大量共存的是A OH-B Al3+C Cu2+D NH4+4.能与AlO2-大量共存于同一溶液中的一组离子是A H+、SO42-、Na+B Mg2+、Na+、OH-C Fe2+、MnO4-、Cl-D Na+、S2-、OH-5.将0.2mol/L的偏铝酸钠溶液和0.4mol/L的盐酸溶液等体积混和,混和液中离子浓度由大到小的顺序正确的是A [Cl-]>[Al3+]>[Na+]>[H+]>[OH-]B [Cl-]>[Na+]>[Al3+]>[H+]>[OH-]C [Cl-]>[Al3+]>[Na+]>[OH-]>[H+]D [Na+]>[Cl-]>[Al3+]>[OH-]>[H+]6.实现Al3++3A1O2-+6H2O=Al(OH)3↓,正确的做法是A 向铝盐溶液中不断加入纯碱溶液B 向铝盐溶滚中不断加入小苏打溶液C 向烧碱溶液中不断滴人铝盐溶液D 向铝盐溶液中不断滴入烧碱溶液7.两份等体积、等浓度的NaOH溶液,分别与体积相等的MgCl2、AlCl3溶液混合,充分反应后,Mg2+、Al3+均恰好形成沉淀,则原MgCl2、AlCl3溶液中Cl-浓度之比为A 1︰1B 1︰2C 2︰3D 3︰28.Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的之比A 4︰6︰1B 8︰6︰1C 3︰3︰1D 2︰2︰19.2.3g钠投入100mL硫酸铝溶液中,Al3+全部变为AlO2-,再滴入一滴盐酸立即产生白色沉淀,则硫酸铝溶液的物质的量的浓度是A 0.5mol/LB 0.125mol/LC 0.25mol/LD 0.1mol/L10.m mL 0.25mol/L的AlCl3溶液中加入金属钾,完全反应后,恰好只形成KCl和KAlO2溶液,则加入钾的物质的量A 2.5×10-4mmolB 5.0×10-4mmolC 7.5×10-4mmolD 1×10-3mmol11.向50mL 1mol/L AlCl3溶液中加入1.5mol/L NaOH溶液amL,充分反应后,生成的沉淀为0.02mol,则a的数值可能是A 40B 65C 90D 12012.往100mL、1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液得沉淀3.9g,则加入溶液的体积可能是A 150 mLB 200 mLC 300 mLD 350 mL13.向含有amol AlCl3溶液中加入含有bmol KOH溶液,生成沉淀的物质的量可能是①amol ②bmol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b)molA ①③④⑤⑥B ①②③④⑤C ①④⑤⑥D ①④⑤14.将amL 0.1mol/L硫酸铝溶液与bmL 0.5mol/L氢氧化钠溶液混合,得到cmol氢氧化铝沉淀,若已知a、b、c中任意两个值,求另一个值,所求的值不止一个解的是(各选项中,单位均略去不写)A a=100 b=90 c=?B a=100 c=0.015 b=?C b=90 c=0.015 a=?D a=75 c=0.015 b=?15.现有100mL 3mol/L的NaOH溶液和100mL 1mol/L的氯化铝溶液。
高中化学高考总复习 微专题 大素养05 “铝三角”中的图像题

二、四个基本图像 1.可溶性铝盐溶液与NaOH溶液反应的图像:
操作 现象
向可溶性铝盐溶液中逐滴加 向NaOH溶液中逐滴加入可溶性
入NaOH溶液至过量
铝盐溶液至过量
立即产生白色沉淀→渐多→ 无沉淀(有但即溶)→出现沉淀→
最多→渐少→消失
渐多→最多→沉淀不消失
图像
离子方 程式
2.偏铝酸盐溶液与盐酸反应的图像:
微专题•大素养5“铝三角”中的图像题
知识基础 真题演练·素养通关
素养专练
知识基础
Al3++3OH-===Al(OH)3↓
(2) _A_l_(O__H_)3_+__3_H_+_=_=_=_A_l3_+_+__3_H_2O______________。 (3) ____________________________________。 (4) ____________________________________。 (5)① __________________________________。 ② ____________________________________。 (6) ____________________________________。
答案:A
真题演练·素养通关
答案:B
2.[2020·江苏卷,3]下列有关物质的性质与用途具有对应关系的是 ()
A.铝的金属活泼性强,可用于制作铝金属制品 B.氧化铝熔点高,可用作电解冶炼铝的原料 C.氢氧化铝受热分解,可用于中和过多的胃酸 D.明矾溶于水并水解形成胶体,可用于净水
答案:D
解析:本题考查物质的性质与用途,考查的化学学科核心素养是宏观辨识与微 观探析。铝具有很好的延展性,可以用于制作铝金属制品,与铝的活泼性无关, A项错误;电解氧化铝冶炼铝是因为氧化铝熔融状态下能导电,与熔点高无关, B项错误;氢氧化铝能与胃酸的主要成分盐酸发生反应,与氢氧化铝受热分解无 关,C项错误;明矾中的Al3+可以水解生成氢氧化铝胶体,胶体具有很强的吸附 能力,可以吸附水中的悬浮物,起到净水作用,D项正确。
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
“铝三角”-试题君之每日一题君2017-2018学年高一化学人教版(上学期期末复习)

1月15日“铝三角”高考频度:★★★★★难易程度:★★★★☆典例在线Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
(1)合金中镁的物质的量为_________。
(2)写出该合金溶于足量NaOH溶液的化学方程式:_________________。
同时产生H2的体积(标准状况下)为____________ 。
Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
(1)生成Mg(OH)2的质量为__________。
(2)X=_______;Y=_________。
【答案】Ⅰ.(1)0.1 mol(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 3.36 LⅡ.(1)5.8 g (2)0.5 0.6【解析】本题考查物质的量及物质的量浓度的有关计算,注意根据图像和化学方程式的比例关系计算。
Ⅰ.(1)设合金中Mg的物质的量为x mol,铝的物质的量为y mol,根据得失电子守恒可列方程2x+3y=5.6 ÷22.4 ×2,根据两者的质量和为5.1 g可列方程24x+27y=5.1,解得:x=0.1,y=0.1。
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,根据化学方程式可知,0.1 mol铝完全反应产生0.15 mol氢气,0.15 mol氢气在标准状况下的体积为0.15 mol×22.4 L/mol=3.36 L。
Ⅱ.(1)由图像可知,氢氧化镁和氢氧化铝沉淀的物质的量和为0.2 mol,向沉淀中加入NaOH溶液后,只有氢氧化铝和NaOH反应导致沉淀物质的量减少,不溶的0.1 mol是氢氧化镁,所以生成氢氧化镁的质量为0.1mol×58 g/mol=5.8 g。
人教版高考化学专题精练及详解19 铝三角及铁三角

1.下列各组物质,不能按a、b、c(“→”表示反应一步完成)关系转化的是()选项 a b cA Al2O3NaAlO2Al(OH)3B AlCl 3Al(OH)3NaAlO2C Al Al(OH)3Al2O3D MgCl2Mg(OH)2MgO2.(2015·江西新八校一联)常温下取金属钠、铝、铁各1 g,加入1 mol·L-1的硫酸V L,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是()A.V≥118B.V≤123C.V<118D.V≤1563.(2015·天门月考)A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下,下列分析不正确的是()A.当m1>m2时,溶液a中阴离子只有1种B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+C.要确定混合物中是否含Al,可取A加入适量稀HClD.当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g4.(2015·衡阳四中冲刺)由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是()A.锌B.铁C.铝D.镁5.(2015·青岛质检)下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是()A B C DX FeCl2溶液FeCl3溶液Fe Na2SO4溶液Y FeCl3CuCl2Al Na2CO3Z Cl2Fe NaOH溶液HCl溶液6.(2015·青岛下学期二模)常温时,将0.1 mol Fe(NO3)3和2 mol HCl溶于水得2 L混合溶液,然后向该溶液投入m g铁粉使其充分反应后,滴加KSCN溶液不变血红色。
下列有关说法正确的是()A.由于氧化性Fe3+>H+,首先发生的反应是Fe+2Fe3+===3Fe2+B.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体C.在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在D.m至少等于28 g,反应过程中溶液的质量一直在减小7.(2015·衡阳四中冲刺)向一定量Fe3O4和Fe的混合物中加入50 mL 2 mol·L-1 H2SO4溶液,恰好使混合物完全溶解,放出448 mL(标准状况下)的气体。
高中化学复习知识点:铝三角转化

高中化学复习知识点:铝三角转化一、单选题1 •在给定条件下,下列选项所示的物质间转化均能实现的是A . H 2SQ 3 ASiO 2 盐酸 SiCl 4rc 稀硝酸B. CUACu(NO 3)2(aq)ACu(NO 3)2(S )C . CICH2-CH 2CINaOl 溶 液A HOCH 2CH 2OH C U (OH )2AHOOC-COOHFe3^4AI 2O 3NaOl 溶液NaAIO 2(aq)D. Al 高温A2 . ( 3分)1L 某混合溶液中,溶质 X 、Y 的浓度都为 0.1moI?L ',向混合溶液中滴加某 溶液Z (0.1mol?L <氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,贝U X 、Y 、Z 分别是()C . CA .氯化铝、氯化铁、氢氧化钠C .偏铝酸钠、氢氧化钡、硫酸B .氯化铝、氯化镁、氢氧化钠 D .偏铝酸钠、氯化钡、硫酸4 .室温下,对于 0.10mol?L 「1的氨水,下列判断正确的是 A •与AlCl 3溶液反应发生的离子方程式为 Al 3++3OH 「一Al (OH ) 3 JB .用HNO 3溶液完全中和后,溶液不显中性C .加水稀释后,溶液中 c ( NH 4+) ?c (OH 「)变大D . 1L0.1mol?L 一1 的氨水中有 6.02 >1022个 NH 4+ 5•下列实验过程中,始终无明显现象的是( )A . NO 2通入FeSO 4溶液中B . SO 2通入已酸化的Ba (NO 3)2溶液中C . NH 3通入AlCl 3溶液中D . CO 2通入CaCl 2溶液中6.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是 ( )A . AB . BC . CD . D7 .单质及其化合物的转化关系是化学学习的重要内容之一.下列各组物质的转化关系 中能通过一步反应完成的是() A . Si T SiQ ^H 2SQ 3T Na 2SiO 3B . Fe T Fe (OH ) 3T Fe s O 3^ Fe ( NO 3) 3C . HCl T Cl 2T HCIO T NaClOD . Al T Al 2O 3T Al(OH) 3T AlCl 3⑤ AlCl 3 ⑥ Na 2CO 38 .中学常见物质 A 、B 、C 、D 存在下图转化关系 (部分生成物和反应条件略去)。
高考化学一轮复习 专题“铝三角”及其应用每日一题
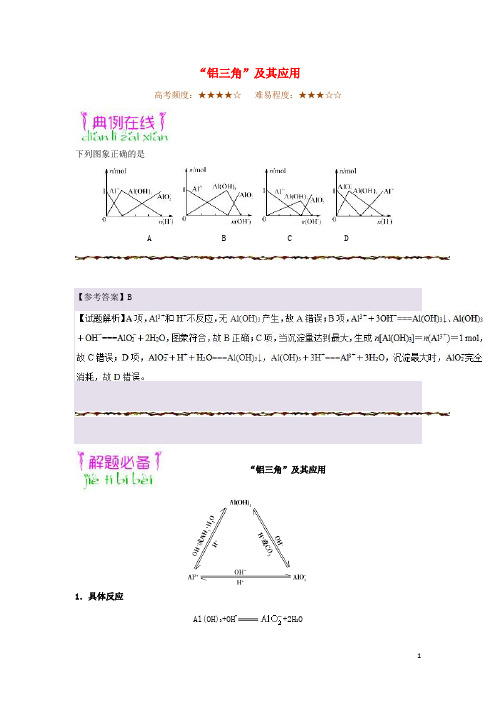
“铝三角”及其应用高考频度:★★★★☆难易程度:★★★☆☆下列图象正确的是A B C D 【参考答案】B“铝三角”及其应用1.具体反应Al(OH)3+OH−+2H2OAl(OH)3+3H+Al3++3H2OAl3++3OH−Al(OH)3↓+H++H 2O Al(OH)3↓+4H+Al3++2H 2OAl3++4OH−+2H 2OAl3++3+6H 2O4Al(OH)3↓2.应用(1)判断离子共存问题Al3+与OH−及、、S2−等弱酸根阴离子或与H+、以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
(3)分离提纯①利用Al能溶于强碱溶液,分离Al与其他金属的混合物。
②利用Al2O3,能与强碱溶液反应,分离Al2O3与其他金属氧化物。
③利用Al(OH)3能与强碱溶液反应,分离Al3+与其他金属阳离子。
1.下列除杂质的方法不正确的是A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.FeCl3溶液中混有少量AlCl3:加入过量的氨水,过滤洗涤沉淀,将沉淀再用适量盐酸溶解C.Fe2O3中混有少量Al2O3:加入过量NaOH溶液充分反应,过滤、洗涤、干燥D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤2.甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。
下列说法正确的是A.若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2B.若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3C.若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3D.若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO23.用下列两种方案制备氢氧化铝:Ⅰ.2.7 g Al X溶液氢氧化铝Ⅱ.2.7 g Al Y溶液氢氧化铝已知所用的稀盐酸与氢氧化钠溶液的浓度均为3 mol·L−1。
高中化学最困难考点系列考点铝三角的应用新人教必修

考点6 铝三角的应用【考点定位】本考点考查铝三角的应用,涉及铝盐、偏铝酸盐及氢氧化铝之间的转化条件,特别注意铝盐与碱性溶液及偏铝酸盐与酸之间的反应,以及反应物的物质的量对反应原理的影响。
【精确解读】Al3+、Al(OH)3、AlO2-之间的转化关系1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:AlCl3+3NaOH =Al(OH)3↓+3NaCl(2)可溶性铝盐与氨水反应:AlCl3+3NH3·H2O =Al(OH)3↓+3NH4Cl2.Al(OH)3―→Al3+:Al(OH)3溶于强酸溶液:Al(OH)3+3HCl=AlCl3+3H2O3.Al3+―→AlO2-:可溶性铝盐与过量的强碱反应:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O4.AlO2-―→Al3+:偏铝酸盐溶液与足量的盐酸反应:NaAlO2+4HCl=AlCl3+NaCl+2H2O5.AlO2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl6.Al(OH)3―→ AlO2-:Al(OH)3溶于强碱溶液:Al(OH)3+NaOH=NaAlO2+2H2O特别注意:三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【精细剖析】1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO2-→Al(OH)3最好通入CO2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.突破Al(OH)3沉淀图像三个秘诀(1)明晰横、纵坐标含义,然后通过曲线变化特点分析反应原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“铝三角”的图像分析及计算
知识点一、铝三角
1、三角关系:AI 3+、AI(OH) 3与AIO2 —相互转化的关系
2、铝三角的应用
①制取AI(OH) 3
常用弱碱与可溶的铝盐反应:
也可以用偏铝酸盐与弱酸反应:
AI 3+ + 3NH 3 • H2O == AI(OH) 3 J +3NH 4+
AIO 2- + CO2 + 2H 20 == AI(OH) 3 J + CO32-
知识点二、铝的化合物的有关图象
1、基本图象
①向铝盐溶液中逐滴滴加强碱性溶液直至过量如若将强碱性溶液换成氨水又是怎样的图像?
现象:先产生沉淀,后沉淀消失。
AI 3+ + 3OH 一= AI(OH) 3 J
AI(OH) 3 + OH = AIO2 +2H2O
如若将强碱性溶液换成氨水又是怎样的图像?
③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量
现象:
离子方程式:
将强酸溶液换成弱酸(如通入CO2)又是怎样的图像?
现象:
离子方程式:
现象:
离子方程式:
2、基本图象的拓展
①若AlCl 3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?
现象:
离子方程式:
③若AlCl 3溶液中除混有MgCl2和盐酸外,还混有NH4CI,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应又有何不同,图象又有什么样的变化?
柯(沉淀)
【变式训练1】Al2(SO4)3和MgSO4混和,
加适量水溶解,再加入KOH溶液,析出
的沉淀量(W)与KOH溶液体积(V)的关系如图
则Al 2(SO4)3和MgSO4的物质的量之比是
A. 2: 1
B. 1: 2
C. 1: 1
D. 1:3
现象:
离子方程式:
同,图象有什么样的变化?
【典型例题】
_ 1 __________________________
例1向30 mL 1 mol •L 的AlCl 3溶液中逐渐加入浓度为
则加入的NaOH溶液的体积可能为()
A. 3 mL
B. 7.5 mL
C. 15 mL
_ 1
4 mol •L 的NaOH溶液,若产生0.78 g白色沉淀,
D. 17.5 mL
H、Mg+、Al3+等阳离子,逐滴加入NaOH溶液),则消耗NaOH溶液)体积(x轴)
和生成沉淀量(y轴)之间的函数关系,可用下图表示,则下列图中正确的是
例3将0. 1 mol的镁、铝混合物溶于100 mL 2 mol • L-1的H b SQ溶液中,然后再滴加
1 mol • L-1的NaOH溶液。
请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如上
图所示。
当V1= 160 mL时,则金属粉末中n(Mg) = ______________ mol , *= __________ mL。
上升
1.在10mL含有AIO 2-离子的溶液中逐滴加入
1mol / L的盐酸,所得AI(OH) 3沉淀质量和所加盐
酸的体积关系如图所示。
问:
(1) 此溶液中同时含有_____ mol ___离子;
(2) 线段AM 表示的意义是__________________________ ,
MN表示的意义是____________________________________ ;
(3) 点M表示的意义是_______________________________ ,
点N表示的意义是___________________________________ ;
(4) C(或M)点的纵坐标为0.78,贝U c(AIO 2-)= _____________
⑸点B的横坐标为30,则到点N处滴入的HCI溶液体积为
___________________________________________________________________________
mL
例4由铝和某种金属A组成的混合物,将它分成两等份。
一份放入过量的盐酸中,混合
物完全溶解放出
C I)
⑵若在滴加NaOH溶液过程中,欲使Mg+、AI3+刚好沉淀完全, 则滴入NaOH溶液的体积V(NaOH)= _________ mL。
例2某无色溶液中,已知含有
20 30滴人盐酸的侔积Gal
12.32
升氢气(标准状况下同),溶液质量增加了9.7克,另一份放入过量的烧碱溶液中,充分反应后放出8.96升氢气, 溶液质量增加了6.4克,而金属A不反应,试通过计算判断A可能是什么金属?(取原子量较小的一种金属)。
