铝三角图像专题
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
【原创】 铝三角及图像专题

将0.1 mol的镁、铝混合物溶于100 mL2mol/LH2SO4溶液中,然后再滴加
1 mol/LNaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量
m随加入NaOH溶液的体积V变化如右图所示。
当V1=160mL时,则金属中n(Mg)=_____mol, V2=______mL。 (2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入
同步练习: 0.1molAl3+
0.05molAl(OH)3
向50 mL1 mol·L-1的Al2(SO4)3溶液中加入100 mLKOH溶液,充
分反应得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( CD )
A. 1 mol·L-1 B. 3 mol·L-1 C. 1.5 mol·L-1 D. 3.5 mol·L-1
Al(OH)3 + 3 H+ =Al3+ + 3H2O n (Al(OH)3 )
0 1
3
n (NaAlO2)
7.向 AlCl3、MgCl2 溶液中滴加 NaOH溶液至过量
Mg2+ + 2OH- =Mg(OH)2↓ Al3+ + 3OH-= Al(OH)3↓ Al(OH)3 + OH- =AlO2- + 2H2O
铝三角及其图 像专题
Al(OH)3
Al3+
强碱 OH强酸 H+
Al3++3OH- =Al(OH)3↓ Al(OH)3 + OH- = AlO2- + 2H2O
Al3++4OH- = AlO2 -+ 2H2O
铝的化合物

计算:
1.在100mL 1mol/L的AlCl3溶液加入 60mL 6mol/L的KOH溶液,生成沉淀 多少克? 2.若在200mL 0.5mol/L的Al2(SO4)3溶 液中,加入2mol/L的NaOH溶液,可生 成沉淀7.8g,则加入NaOH溶液的体积 是多少?
“铝三角”及相应的图像
Al3+
Al(OH)3
AlO2 ¯
“铝三角”及相应的图像
1.向一定量AlCl3溶液中逐滴加入NaOH溶液 现象:先生成白色沉淀,然后白色沉淀溶解 Al3+ + 3OH¯ →Al(OH)3↓ Al(OH)3 + OH¯ →AlO2¯ + 2H2O
n(Al(OH)3(mol)
0 1 2 3 4 V(NaOHaq)
写出上变化的离子反应方程式
5.硫酸铝钾
俗名:明矾(晶体) 化学式: KAl(SO4)2· 12H2O
或K2SO4· 2(SO4)3· 2O Al 24H 复盐:由两种或两种以上不同的金属 离子和一种酸根离子组成的盐
物理性质与用途:无色晶体,易溶于水 (溶于水时,因水解而显酸性)。 电离方程式: KAl(SO4)2 = K+ + Al3+ + 2SO42 ¯ 常作净水剂 原理:Al3+ + 3H2O Al(OH)3(胶体) + 3H+
可溶性的铝盐加氨水 Al3+ + 3NH3· 2O =Al(OH)3↓+3NH4+ H 可溶性的偏铝酸盐通入CO2 AlO2¯+CO2 +2H2O =Al(OH)3↓+HCO3¯ (CO2过量) 2AlO2¯+CO2+3H2O =2Al(OH)3↓+CO32¯ (CO2少量) 向偏铝酸钠溶液中加入氯化铝溶液 3AlO2 ¯ + 6H2O + Al3+ →4 Al(OH)3↓
高三化学一轮复习 专题12 突破铝三角的图像和计算 提升练习

专题12突破铝三角的图像和计算提升练习高考化学一轮复习微专题一、单选题,共13小题1.(2022·浙江·金华市曙光学校模拟预测)下列反应的方程式不正确...的是 A .石灰石与醋酸反应:CO 23-+2CH 3COOH=2CH 3COO - +CO 2↑+H 2OB .铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):Ag(阳极)通电Ag(阴极)C .铜与稀硝酸反应:3Cu+2NO 3-+8H +=3Cu 2+ +2NO↑+4H 2OD .明矾溶液中加入少量氢氧化钡溶液:2Al 3+ +3SO 24-+ 3Ba 2++6OH -=2Al(OH)3↓+ 3BaSO 4↓2.(模拟)下列物质之间通过一步反应不能实现如图所示转化的是(部分反应中的2H O 已略去)选项 WX Y Z A2OCCO2COB 2CONaOH23Na CO3Na HCOCNaOH 3AlCl()3Al OH2NaAlOD 2Cl Fe2FeCl3FeClA .AB .BC .CD .D3.(2022·陕西·汉中市龙岗学校高三阶段练习)下列实验对应的离子方程式正确的是A .氢氧化钠溶液中滴入少量硫酸铝溶液:333OH Al Al(OH)-++=↓B .硫化钠溶液中通入过量2222SO :2S SO 2H O 3S 4OH --++=↓+C .次氯酸钙溶液中通入少量的2223CO :ClO H O CO HCO HClO --++=+D .水杨酸溶液中加入足量的碳酸氢钠溶液:+ HCO -3−−→+CO 2↑+H 2O4.(模拟)能正确表示下列变化的离子方程式是A .向次氯酸钙中通入过量的二氧化碳气体:Ca 2++2ClO -+CO 2+H 2O=2HClO+CaCO 3↓B .向硝酸铝溶液中滴加足量氢氧化钡溶液:Al 3+ +4OH -=AlO 2-+2H 2OC .向氯化铜溶液中通入硫化氢气体:S 2- +Cu 2+= CuS↓D .碳酸镁与稀硫酸反应:CO 23-+2H +=CO 2↑+H 2O5.(模拟)为探究Al 2(SO 4)3溶液与Ba(OH)2溶液的反应,取0.1mol·L -1的溶液进行如下实验:下列分析错误的是A .试管1中,当硫酸根离子恰好完全沉淀时,沉淀的质量最大B .试管2中,当钡离子恰好完全沉淀时,铝元素也完全转变为沉淀C .试管l 、2中,沉淀均会先增多后减少D .试管l 、2中,沉淀均含BaSO 46.(模拟)铵明矾()4422NH Al SO 12H O ⎡⎤⋅⎣⎦常用于发酵粉加工、油炸食品、粉条加工等食品工业,其实验室制备流程如图所示,已知:铵明矾的溶解度随温度升高明显增大。
“铝三角”的图像分析及计算

“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
铝的图形

0 V1
Hale Waihona Puke V2 V/mL(3) 若混合物仍为 ) 若混合物仍为0.1mol,其中 , 其中Mg 粉 的 物 质 的 量 分 数 为 a, 用 1 0 0 mL , 的硫酸溶解此混合物后, 2mol/L的硫酸溶解此混合物后 , 再加入 的硫酸溶解此混合物后 450mL 1mol/L 的 NaOH溶液, 所得沉 溶液, 溶液 淀中无Al(OH)3。 满足此条件的 的取值 满足此条件的a的取值 淀中无 ≤ < 范围是 1/2≤a<1 。 0 V V2 V/mL 方法一: 方法一:根据方程式计算 1 加入450mL 1mol/L 的NaOH 加入 方法二:守恒法当所得沉淀中无 溶液,完全反应后NaOH过量 过量: 溶液,完全反应后 过量 Al(OH)3 时 , 溶液中的溶质一定含有 0.45mol—0.40mol=0.05mol Na2SO4、NaAlO2, 可 能 含 有 NaOH 过量) 根据Na 守恒, ( 过量 ) , 根据 + 守恒 , 有下列关 若要完全溶解Al(OH)3,则 若要完全溶解 系式: 系式: 2n(H2SO4)+n(Al)≤n(NaOH) n Al(OH)3 ≤ 0.05mol, , 即 : 2 × 0 . 1 mol//L+0.1(1— + 1—a ≤ 0.05mol a)≤0.45L×1mol/L, × , 解得: 解得:a≥1/2 解得: 解得:a≥1/2
Al3+ + 3OH—(少量 → Al(OH)3↓ 少量) 少量 Al(OH)3 + OH—
n[Al(OH)3]
→ AlO2—+2H2O
n(NaOH)
的混合溶液中滴加NaOH溶液直至过量 ④向含Mg2+、Al3+的混合溶液中滴加 向含 溶液直至过量
第二讲“铝三角”及其图像
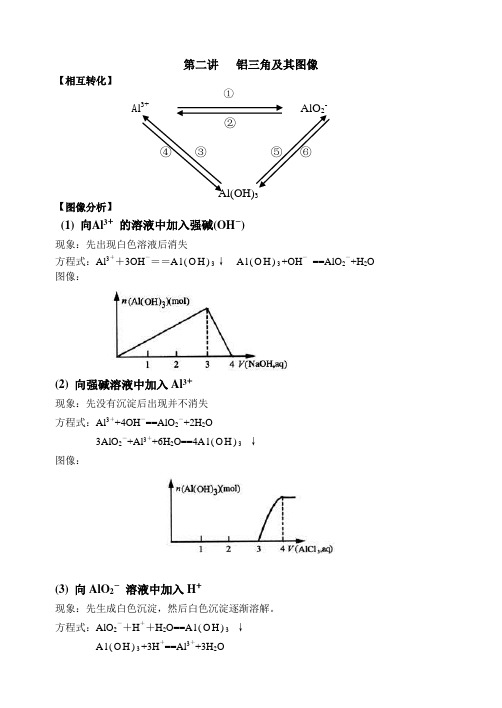
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
金属及其 化合物 铝三角及图像

第三章 金属元素及其化合物 第6课时 “铝三角” 和铝的图像
复习重点: 1、铝三角。 2、有关铝的图像问题。 复习难点:有关铝的图像问题。
华美实验学校
曾维玲
一、铝三角的相互转化 Al
12
13
Al2O3
⑦
Al(OH)3
Al3+
⑥ ⑤
AlO2—
写出上图铝三角中转化的离子反应方程式:
13
F2>O2>Cl2 > Br2 >Fe3+> I2 > S
AlO2-、Al(OH)3、OH-、 CO32- OH-、AlO2-、CO32- 、HCO3- 、 Al(OH)3 B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+ I-、Fe2+ 、Br-
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:
KOH、Ba(OH)2、BaCO3 Ba(OH)2、KOH、 K2CO3、 BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉: Ag+、Cu2+、H+、Fe2+
K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag Pt Au 单质还原性越来越弱
K +Ca2+ Na +Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu 2+ Fe3+ Hg2+ Ag+ 离子氧化性越来越强
当堂训练
1.向AlCl3溶液中滴加NaOH溶液,加入的NaOH溶液的体积与沉 淀的质量之间的关系如右图所示: (1)图中A点表示的意义是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“铝三角”的图像及有关计算
【“铝三角”】
写出有关转化离子方程式。
【图像分析】“铝三角”转化关系中的图象问题
①向AlCl3溶液中滴加NaOH溶液直到过量
②向NaOH溶液中滴加AlCl3溶液直至过量
③向NaAlO2溶液中滴加稀盐酸直至过量
④向AlCl3溶液中滴加稀氨水直至过量
⑤向稀盐酸中滴加NaAlO2溶液直至过量
⑥向NaAlO2溶液中通入CO2气体直至过量
例1向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到
的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回
答下列问题:
(1)图中A点表示的意义是
(2)图中B点表示的意义是
(3)上述两步反应用总的离子方程式可表示为:
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(1)生成Al(OH)3沉淀的最大值 (2)Al(OH)3沉淀完全溶解于NaOH溶液成为NaAlO2溶液
(3)Al3++4OH-=AlO2-+2H2O (4)7.5 mL或17.5 mL
例2某研究学习小组对铝热反应实验展开研究。
高中教材必修2(人教
版)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发
出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅
《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质Al Al2O3Fe Fe2O3
熔点/℃660205415351462
沸点/℃246729802750-
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。
理由是:该
反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔
合形成铁铝合金。
你认为他的解释是否合理?答:
_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属
铝。
该实验所用试剂是_______________,反应的离子方程式为
_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应
还原产物中氮元素的化合价越低。
某同学取一定量上述的熔融物与一定
量很稀的硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液
中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积
(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
试回答下列问
题:
⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
___________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
__________;
上述现象说明溶液中_________________结合OH-的能力比_______强
(填离子符号)。
B与A的差值为_________mol。
B点对应的沉淀的物质的量为
________mol,C点对
应的氢氧化钠溶液的体积为___________mL
Ⅰ⑴合理 ⑵NaOH溶液 2Al+2NaOH+H2O=2NaAlO2+3H2↑ ⑶B
Ⅱ⑴H++OH-=H2O ⑵ NH4++OH-=NH3·H2O Al3+、Fe3+、 H+ , NH4+; (3)0.008 0.032mol 7mL
【巩固练习】
1.已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。
向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
2.在含1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4 D.最后的沉淀为2mol BaSO4、1mol
Al(OH)3
3.Al2(SO4)3和MgSO4混和,加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是( )
A. 2:1
B. 1:2
C. 1:1
D. 1:3
4.向10mL 0.1mol·溶液中,滴加等浓度溶液x mL,下列叙述正确的是()
A.x=10时,溶液中有、、,且
B.x=10时,溶液中有、、,且
C.x=30时,溶液中有、、,且
D.x=30时,溶液中有、、,且
5.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
______.
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B______;沉淀D______;溶液E______和_______.
(3)写出①、②、④三个反应的离子方程式,不是离子反应的写出其化学方程式.
①______;②______;④______.
(1)过滤;(2)Al2O3;Fe2O3;K2SO4;(NH4)2SO4、NH3.H2O;
(3)Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;Al(OH3 = Al2O3+3H2O
6.将一定质量的镁铝合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得如图关系
(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
(1)3.6g、2.7g (2)1.4mol/L
7.在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问:
(1)此溶液中同时含有____ mol____离子;
(2)用离子方程式表示MN段发生的反应是 ;
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)= ;
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL (1)0.02mol;OH- (2)Al(OH)3+3H+=Al3++3H2O (3)1mol (4)60ml
8.现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为
0.10mol,在此溶液中加入90mL 4.0mol/L的NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算x =0.4时,溶液中产生的沉淀是什么?物质的量是多少?
(2)计算沉淀中只有Fe(OH)3时x的取值范围,请在下图中画出沉淀总量(mol)随x(0 →1.0)变化的曲线。
0.10
沉淀总量/mol
1.0 x
(3)若Al3+和Fe3+的物质的量之和为nmol(n为合理值),其它条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
(1)0.06 mol Fe(OH)3 (2)0≤x≤0.6 (3)(0.36/n)-3<x<1。
