铝三角及其转化关系
高考化学一轮复习(第二辑)考点26 铝的冶炼及含铝化合物之间的转化(含解析)
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
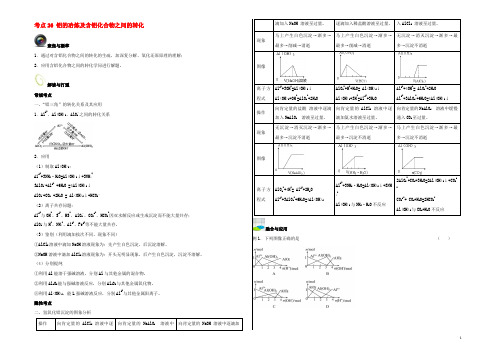
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。
镁和铝重要知识点总结
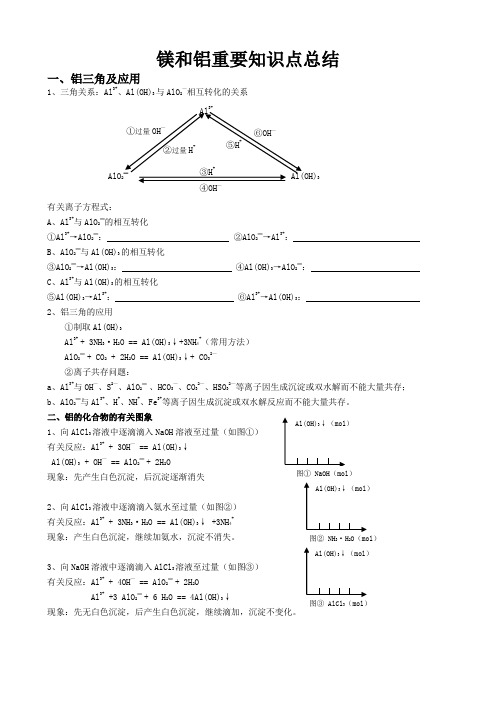
①过量OH —②过量H +③H +④OH —⑤H +⑥OH —镁和铝重要知识点总结一、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式: A 、Al3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+: B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3++ 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存; b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
二、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3++ 3OH —== Al(OH)3↓ Al(OH)3 + OH —== AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3++ 3NH 3·H 2O == Al(OH)3↓ +3NH 4+现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3++ 4OH —== AlO 2—+ 2H 2OAl 3++3 AlO 2—+ 6 H 2O == 4Al(OH)3↓Al 3+Al(OH)3AlO 2—4、向AlCl 3溶液中逐滴滴入NaAlO 2有关反应: Al 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓ 现象:产生白色沉淀,继续滴加,沉淀不变化。
人教版高中化学必修1课件 “铝三角”的转化关系

“铝三角”的转化关系
(2 ) 沉淀Al(OH)3物质的量为: 3.12g/78g/mol=0.04mol Al3+为0.05mol 1)若Al3+过量,耗NaOH 0.04×3=0.12mol a=2.4mol.l-1 2)若Al3+完全沉淀, Al(OH)3为0.05mol ;耗NaOH 0.15mol, 溶解0.01mol Al(OH)3需NaOH 0.01mol, 共需NaOH 0.16mol ∴a=3.2mol.l-1 从上面的解题过程可以看出,关键是明确化学原理,掌握Al3+ 与OH- 、AlO2-与H+量的相互关系,再进行综合分析。 可见Al3+、Al(OH)3 、AlO2-之间的应用非常广泛,但无论题型 怎样变化,只要掌握了它们之间的相互关系讲就能迎仞而解。
“铝三角”的转化关系 2、 Al(OH)3的制取问题
从“铝三角”可知,制取Al(OH)3的较好途径有:
Al3++3NH3· H2O = Al(OH)3↓+3NH4+
注:不能用强碱
AlO2- +CO2(过量) +2H2O = Al(OH)3↓+HCO3-
注:不能用强酸
“铝三角”的转化关系
例:某无色溶液可能由Ba(NO3)2、MgCl2、KOH、 KHS、Al2(SO4)3中的一种或几种混合而成,在此溶液中 逐滴加入稀HNO3,先产生白色沉淀,而后白色沉淀又会溶 解,则该溶液中所含的溶质是上述物质中的 溶于水得到的。其相互反应的离子方程式 是 。 【解析】由“溶液中逐滴加入稀HNO3,先产生白色沉淀, 而后白色沉淀又会溶解”可得溶液中含AlO2-,并由Al3+和过 量OH-反应得到,因此溶液中所含的溶质为KOH(过量) Al2(SO4) 反应的离子方程式是Al3++4OH-= AlO2-+2H2O
重难点九 铝的化合物之间的相互转化—“铝三角”

重难点九 铝的化合物之间的相互转化----“铝三角”【要点解读】 1.Al 3+―→Al(OH)3(1)可溶性铝盐与少量NaOH 溶液反应: (2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al 3+:Al(OH)3溶于强酸溶液: 3.Al 3+―→AlO 2-:可溶性铝盐与过量的强碱反应: 4.AlO 2-―→Al 3+:偏铝酸盐溶液与足量的盐酸反应: 5.AlO 2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸: 6.Al(OH)3―→ AlO 2- :Al(OH)3溶于强碱溶液: 【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】 1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO 2-→Al(OH)3最好通入CO 2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质 (1)金属单质:Al 等; (2)两性氧化物:Al 2O 3等; (3)两性氢氧化物:Al(OH)3 等;(4)弱酸的铵盐:(NH 4)2CO 3、CH 3COONH 4、(NH 4)2S 等; (5)弱酸的酸式盐:NaHCO 3、KHS 、NaHSO 3等。
【重难点指数】★★★★【重难点考向一】氢氧化铝的制取和性质探究【例1】实验室制取氢氧化铝的最佳方案是( )A.Al+H2O B.Al2O3+H2O C.AlCl3+NaOH D.Al2(SO4)3+NH3•H2O【重难点考向二】铝及其化合物性质探究【例2】某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的是( ) A.向氯化铝溶液中滴加过氨水,最终得到澄清溶液B.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气C.常温下铝与浓硝酸反应制得大量的NO2D.AlCl3溶液加热蒸干得到无水氯化铝晶体【重难点考向三】铝三角之间的转化【例3】A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)(1)写出化学式:A______,B________,C________,D________,E________;(2)写出下列反应的离子方程式:A→B:___________________________________________________;A→D:___________________________________________________。
人教版必修一化学铝三角的转化关系

有关AI(OH)3沉淀的图像分析
高一化学
铝三角
一、教学目标
1、正确理解和掌握铝三角之间的转化关系; 2、学会用数形结合思想解决化学问题; 3、运用电荷守恒配平离子方程式。
二、教学重、难点
“铝三角”转化关系以及离子方程式的书写
人教版 化学 必修一
铝三角
一、铝三角
AI3+ AI
O2
电解
AI2O3
△
AI(OH)3
4OH
4H+
AIO2
人教版 化学 必修一
有关AI(OH)3沉淀的图像分析
二、有关AI(OH)3沉淀的图像分析
1.往AlCl3溶液中逐滴加入NaOH溶液至过量 现象: 立即产生白色沉淀——渐多——最多——减少——消失 反应: Al3++3OH-===Al(OH)3↓ Al(OH)3+OH-===AlO2-+2H2O
总 结
一、铝三角的实质
1、定性:铝三角的转化依溶液的酸碱性不同而进行;
2、定量:铝三角的转化依电荷数或酸碱用量配平。
二、数形结合去理解铝三角之间的反应关系
人教版 化学 必修一
有关AI(OH)3沉淀的图像分析
作 业
学业分层测评十五
人教版 化学 必修一
思考:
往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量
现象:开始出现白色沉淀⇒后沉淀量增多⇒沉淀部分溶解 反应: Al3++3OH-===Al(OH)3↓, Mg2++2OH-===Mg(OH)2↓ Al(OH)3+OH-===AlO2-+2H2O
人教版 化学 必修一
有关AI(OH)3沉淀的图像分析
人教版 化学 必修一
有关AI(OH)3沉淀的图像分析
3-3 “铝三角”的转化关系及有关氢氧化铝沉淀的图像分析(人教版2019)(解析版)

第三章铁金属材料考点3 “铝三角”的转化关系及有关氢氧化铝沉淀的图像分析学业测评1.(2021·广东·深圳第二外国语学校高一期末)下列关于铝及其化合物的性质、用途的说法不正确的是A.铝粉和氢氧化钠混合物可用作下水道疏通剂B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3C.铝的氧化膜致密且熔点高,从而能保护内部金属D.铝制品廉价易得,适用于厨房制作和长期存放各类食物【答案】D【解析】A.铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,所以铝粉和氢氧化钠混合物可用作下水道疏通剂,故A正确;B.Al2O3和NaOH溶液反应生成可溶性偏铝酸钠,所以可用NaOH溶液除去Fe2O3粉末中少量的Al2O3,故B正确;C.铝和氧气反应生成的氧化膜致密且熔点高,从而能保护内部金属,故C正确;D.铝能够与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,故D错误;选D。
2.下列关于金属铝及其化合物的叙述不正确的是A.Al2O3不能跟所有的酸碱溶液反应B.铝是活泼的金属,在化学反应中容易失去电子,表现出还原性C.铝箔徃空气中用酒精灯加热可以融化,且发生剧烈燃烧D.铝箔在空气中用酒精灯加热可以观察到铝融化了但并不滴落【答案】C【解析】A.氧化铝和强酸、强碱反应,不能和弱酸弱碱反应,A正确;B.铝是比较活泼的金属,最外层有3个电子,在化学反应中易失去3个电子而达8电子的稳定结构,表现还原性,B正确;C.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,不会出现发生剧烈的燃烧,C错误;D.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,D正确;故选C。
3.现有MgO、Al2O3、Fe2O3、CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂A.氨水B.浓NaOH溶液C.NaCl溶液D.稀H2SO4【答案】B【解析】A.MgO、Al2O3、Fe2O3、CuO与氨水都不反应,故A不符合题意;B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3、CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;C.MgO、Al2O3、Fe2O3、CuO与NaCl溶液都不反应,故C不符合题意;D.MgO、Al2O3、Fe2O3、CuO与稀H2SO4都反应,故D不符合题意;故答案为B。
第二讲“铝三角”及其图像
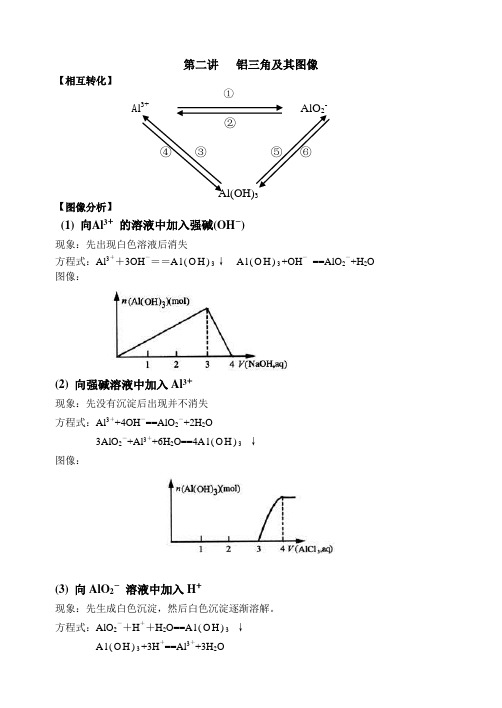
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
7 专题突破7 “铝三角”转化关系及其应用

现象
多→渐少→消失多→沉淀不消失Fra bibliotek上一页
下一页
第3章 金属及其重要化合物
7
图像
离子方程 AB:(5)② 式序号 BC:(2)
AB:(4) BC:(1)②
上一页
下一页
第3章 金属及其重要化合物
8
1.下列各组物质的无色溶液,不用其他试剂即可鉴别的是_______(填序号)。
①NaOH、AlCl3 ③NaAlO2、NaHSO4
②NaHCO3、H2SO4 ④Na2CO3、HCl
⑤Na2CO3、NaHCO3、Ca(OH)2
答案:①③④
上一页
下一页
第3章 金属及其重要化合物
9
2.[Al(OH)3 沉淀的图像分析]室温下,向 0.2 mol/L Al2(SO4)3 溶液中逐滴加
入 1.0 mol/L NaOH 溶液,实验测得溶液 pH 随 NaOH 溶液体积变化曲线如
A.溶液中的阳离子只有 H+、Mg2+、Al3+
√B.溶液中 n(NH+ 4 )=0.2 mol
C.溶液中一定不含 CO23-,可能含有 SO24-和 NO- 3
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
上一页
下一页
第3章 金属及其重要化合物
12
解析:由①可知,溶液中一定含有 H+,一定没有 CO23-、NO-3 ,由电荷守 恒知一定含有 SO24-;由②可知,溶液中一定含有 Mg2+、Al3+,一定没有 Fe3+;由图像可知,溶液中还一定含有 NH4+,且 n(NH+4 )=0.7 mol-0.5 mol =0.2 mol,n(H+)=0.1 mol,n(Al3+)=0.8mol-0.7mol=0.1 mol;沉淀 Al3+、 Mg2+共消耗 0.4 mol OH-,其中沉淀 Al3+消耗 0.3 mol OH-,沉淀 Mg2+消 耗 0.1 mol OH-,根据 Mg2+~2OH-,可得 n(Mg2+)=0.05 mol,故只有选 项 B 正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[例 1] A、B、C、D、E 五种化合物,均含有某种常见元素,它们的转化关系如图 所示,其中 A 为澄清溶液,若取 A 溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
请回答下列问题: (1)写出化学式:B.____________,D.____________。 (2)五种化合物中难溶于水的是________(填化学式)。 (3)写出下列反应的离子方程式:
“铝三角”转化关系及其应用
Al3+、Al(OH)3、AlO2之间的转化关系
实现上述各步转化的离子方程式: (1)①__A__l3_+_+__3_N_H__3_·__H_2_O_=_=_=__A_l_(O__H_)_3_↓__+__3_N_H__+ 4 _ ②_____A_l_3+_+__3_A__lO__2-_+__6_H_2_O__=_=_=_4_A_l_(_O_H__)3_↓____ ③______A_l_3_+_+__3_O_H__-_=_=_=_A__l(_O_H__)_3↓___________ (2) ____A_l_(O__H__)3_+__3_H_+_=_=__=_A_l_3+_+__3_H__2_O_________ (3) _____A_l_3+_+__4_O__H_-_=__=_=_A_l_O_2-_+__2_H__2_O_________
B.AlCl3 D.NaOH
中应填写的是( )
解析:由 Al3+转变为 Al(OH)3,再转变为 AlO-2 ,是通过加入 OH-实现的,故由 AlO-2 再转变为 Al3+,应加入 H+,AlO2-首先转化为 Al(OH)3,然后转化为 Al3+,A 项符合 题意。
答案:A
2.下列各组物质能相互反应得到 Al(OH)3 的是( ) A.Al 跟 NaOH 溶液共热 B.少量 Al(NO3)3 跟大量的 NaOH 溶液 C.Al2O3 和水共热 D.Al2(SO4)3 和过量的氨水
[答案] (1)Al(OH)3 AlCl3 (2)Al(OH)3 和 Al2O3 (3)Al(OH)3+OH-===AlO-2 +2H2O Al2O3+2OH-===2AlO-2 +H2O
1.由 Al3+→Al(OH)3→AlO- 2 → A.Al(OH)3 C.HCl
课堂练习 →Al3+系列变化中,
(4) __A_l_O__-2 _+__4_H_+_=_=_=__A_l_3+_+__2_H__2_O_____________ (5)①_A_l_O__- 2 _+__C_O__2+__2_H__2O__=_=_=_A__l(_O__H_)_3↓__+__H__C_O__- 3_
②___A__lO__- 2_+__H_+_+__H__2_O_=_=_=__A_l_(O__H_)_3_↓_________ ③_2_A__lO__2_- __+_C__O_2_+_3_H_2_O__=_2_A_l_(O__H__)3_↓__+_C_O__3_2-__ (6) _A__l(_O__H_)_3_+__O_H__-_=_=_=_A_l_O__2-_+__2_H_2_O__________
2.氢氧化铝两性的应用 (1)用过量的 NaOH 溶液检验 Al3+的存在。 (2)用过量的 NaOH 溶液鉴别 Al3+、Mg2+。 (3)采用互滴法鉴别 Al3+与 OH-,AlO- 2 与 H+。 (4)用过量 NaOH 溶液和相应酸分离 Al3+与 Mg2+(或 Fe3+)。 (5)用过量的 NaOH 溶液除杂:如 Fe(Al)、Fe2O3(Al2O3)等。
B→E:_________________________; C→E:_________________________。
[解析] 以物质 B 作为突破口,B 既能与 NaOH 反应,又能与盐酸反应,且能受热 分解,B 为 Al(OH)3,C 为 Al2O3,则 D 为 AlCl3,E 为 NaAlO2,A 与过量 CO2 反应 生成 B,且焰色反应为浅紫色,则 A 为 KAlO2。
解析:A
项
:ห้องสมุดไป่ตู้
Al
―N― aO―H―溶―液→ △
NaAlO2
;
B
项:
Al(NO3)3― 大―量―N― aO―H―溶―液 →NaAlO2;C 项:Al2O3 与水不反应;D 过量氨水
项:Al2(SO4)3――――→Al(OH)3。
答案:D
