铝三角及其图像
【原创】 铝三角及图像专题

将0.1 mol的镁、铝混合物溶于100 mL2mol/LH2SO4溶液中,然后再滴加
1 mol/LNaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量
m随加入NaOH溶液的体积V变化如右图所示。
当V1=160mL时,则金属中n(Mg)=_____mol, V2=______mL。 (2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入
同步练习: 0.1molAl3+
0.05molAl(OH)3
向50 mL1 mol·L-1的Al2(SO4)3溶液中加入100 mLKOH溶液,充
分反应得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( CD )
A. 1 mol·L-1 B. 3 mol·L-1 C. 1.5 mol·L-1 D. 3.5 mol·L-1
Al(OH)3 + 3 H+ =Al3+ + 3H2O n (Al(OH)3 )
0 1
3
n (NaAlO2)
7.向 AlCl3、MgCl2 溶液中滴加 NaOH溶液至过量
Mg2+ + 2OH- =Mg(OH)2↓ Al3+ + 3OH-= Al(OH)3↓ Al(OH)3 + OH- =AlO2- + 2H2O
铝三角及其图 像专题
Al(OH)3
Al3+
强碱 OH强酸 H+
Al3++3OH- =Al(OH)3↓ Al(OH)3 + OH- = AlO2- + 2H2O
Al3++4OH- = AlO2 -+ 2H2O
《铝三角及其图像》课件

为何称为“铝”三角?
“铝”表示“两者之一”,因为铝三角有两条边长相等的特点。
铝三角的性质和特点
1 直角性质
2 边长关系
铝三角的其中一个角度是直角(90°),使得 它在几何推理中具有特殊意义。
铝三角的两个铝腿边长度相等,与铝基边分 别满足勾股定理的关系。
铝三角的实例和案例
铝三角桥梁
铝三角雕塑
铝三角结构常用于构建大型桥梁, 如海湾大桥和天堂大桥,以保证 结构的稳定性。
铝三角被艺术家用于创作抽象的 雕塑作品,探索形态和空间之间 的关系。
铝三角机器人
工程师和科学家使用铝三角结构 设计机器人,以实现高强度和灵 活性的机械运动。
总结和要点
1 铝三角定义
铝三角是具有两条边长相 等的直角三角形,稳定性 好。
科技领域中的铝三角
铝三角在工程计算、电子器件和 机器人技术等领域中具有重要应 用。
铝三角在几何推理中的作用
1
勾股定理的证明
铝三角的特性使得它成为勾股定理的重要元素,用于证明数学中的几何关系。
2
角度关系推导
通过研究铝三角的角度关系,可以推导出更复杂的三角形和多边形之间的角度性 质。
3
图形相似性判断
铝三角的比例关系可以用于判断两个图形是否相似,为模型设计和工程规划提供 依据。
《铝三角及其图像》
本课件将介绍铝三角的定义、性质和特点,以及铝三角的图像及其应用。探 讨铝三角在几何推理中的作用,并通过实例和案例加深理解。最后进行总结 和要?
铝三角是指一个具有两条边长相等的直角三角形。其中一条边称为铝基,另外两条边分别称 为铝腿。
如何确定铝三角?
20版:铝三角课件

→渐少→消失
多→最多→沉淀不消失
图像
方程式序号 AB:_(_1_)③___ BD:__(6_)_
AB:_(_3_) _
BC:_(_1_)_②__
(2)偏铝酸盐溶液与盐酸反应的图像
操作
偏铝酸盐溶液中逐滴加入稀盐 稀盐酸中逐滴加入偏铝酸盐溶
酸至过量
液至过量
现象
立即产生白色沉淀→渐多→最 无沉淀→出现沉淀→渐多→最
解析 铝与NaOH反应生成NaAlO2和H2,得不到Al(OH)3,故A错误; Al(NO3)3与过量的NaOH反应生成NaAlO2,得不到Al(OH)3,故B错误; Al2O3不溶于水,与热水不反应,得不到Al(OH)3,故C错误; Al2(SO4)3与氨水反应生成Al(OH)3和(NH4)2SO4,故D正确。
(2017·海南,6C)
√B.泡沫灭火器灭火是利用了Al2(SO4)3和小苏打的反应(2016·全国卷Ⅲ,7A)
C.铝与Fe2O3发生铝热反应,反应后固体物质增重(2014·新课标全国卷Ⅱ,9C) D.氯化铝溶液滴入浓NaOH溶液中,产生大量白色沉淀(2015·全国卷Ⅱ,13C)
12345
3.(高考选项组合)下列说法或性质对应用途正确的是________。
12345
课堂检测
1.下列各组物质的无色溶液,不用其他试剂即可鉴别的是_①__③__④___(填序号)。 ①NaOH、AlCl3 ②NaHCO3、H2SO4 ③NaAlO2、NaHSO4 ④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2
2.(高考选项组合)下列说法正确的是 A.向硫酸铝溶液中滴加碳酸钠溶液的离子方程式:2Al3++ 3CO32-===Al2(CO3)3↓
A.1∶3
人教版高中化学必修一课件高一化学铝三角

(3)图象
例 3 向 30 mL 1 mol/L 的 AlCl3 溶液中逐 渐加入浓度为 4 mol/L 的 NaOH 溶液,若产生
B―→C:Al3++3AlO2-+6H2O===4Al(OH)3↓ (3)图象
3.在 AlO2-溶液中逐滴加入强酸至过量 (1)现象:先生成白色沉淀,随后沉淀逐渐溶解。 (2)有关反应: A―→B:AlO-2 +H++H2O===Al(OH)3↓ B―→D:Al(OH)3+3H+===Al3++3H2O
(3)图象
4.在强酸溶液中逐滴加入 AlO-2 溶液至过量 (1)现象:先无明显现象,反应一段时间后逐渐产 生白色沉淀。
(2)有关反应: A―→B:4H++AlO-2 ===Al3++2H2O B―→C:Al3++3AlO-2 +6H2O===4Al(OH)3↓ (3)图象
5.向 Mg2+与 Al3+的酸性溶液中逐滴加入强碱溶液 (1)现象:无明显现象―→出现沉淀―→渐多―→最 多―→减少―→不变 (2)反应 O―→A:H++OH-===H2O A―→B:Al3++3OH-===Al(OH)3↓ Mg2++2OH-===Mg(OH)2↓ B―→C:Al(OH)3+OH-===AlO2-+2H2O
(3)图象
高中化学课件
灿若寒星整理制作
课前方程式练习
1.钠与水反应 2.铝与氢氧化钠反应 3.过氧化钠与二氧化碳反应 4.向碳酸钠溶液中加入少量盐酸 5.向碳酸钠溶液中加入过量盐酸 6.碳酸氢钠受热分解 7.向碳酸钠溶液中通入二氧化碳
“铝三角”的图像分析及计算

“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
第二讲“铝三角”及其图像
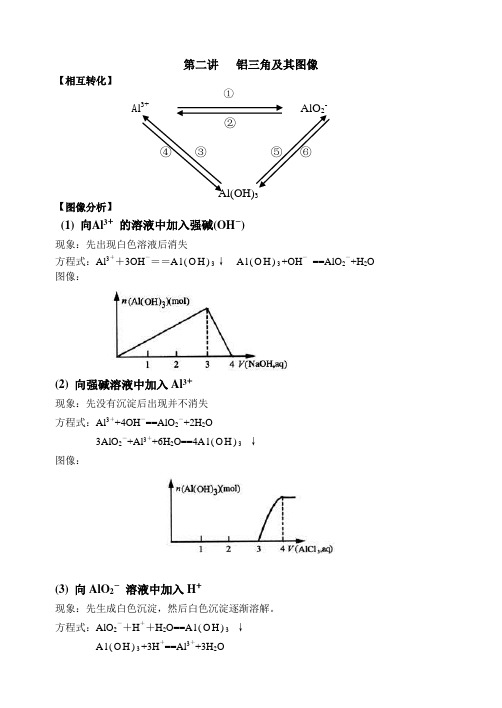
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
金属及其 化合物 铝三角及图像

第三章 金属元素及其化合物 第6课时 “铝三角” 和铝的图像
复习重点: 1、铝三角。 2、有关铝的图像问题。 复习难点:有关铝的图像问题。
华美实验学校
曾维玲
一、铝三角的相互转化 Al
12
13
Al2O3
⑦
Al(OH)3
Al3+
⑥ ⑤
AlO2—
写出上图铝三角中转化的离子反应方程式:
13
F2>O2>Cl2 > Br2 >Fe3+> I2 > S
AlO2-、Al(OH)3、OH-、 CO32- OH-、AlO2-、CO32- 、HCO3- 、 Al(OH)3 B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+ I-、Fe2+ 、Br-
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:
KOH、Ba(OH)2、BaCO3 Ba(OH)2、KOH、 K2CO3、 BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉: Ag+、Cu2+、H+、Fe2+
K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag Pt Au 单质还原性越来越弱
K +Ca2+ Na +Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu 2+ Fe3+ Hg2+ Ag+ 离子氧化性越来越强
当堂训练
1.向AlCl3溶液中滴加NaOH溶液,加入的NaOH溶液的体积与沉 淀的质量之间的关系如右图所示: (1)图中A点表示的意义是
铝三角及图像关系 完整版课件PPT

D.AlCl3和氨水
3、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀
出来,适宜用的试剂是( D)
A.NaOH溶液 B.Ba(OH)2 溶液 C.盐 D.氨水
3.在200mL氯化镁和氯化铝的混合液中,Mg2+的物质 的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。 要使Mg2+全部转化为沉淀分离出来,至少需要加入 4
B 1 2 3 4 VHCl
类型四:向MgCl2和AlCl3的混合溶液中加足量的氢氧化钠
原理:NaOH先与MgCl2和AlCl3反应,生成Mg(OH)2和 Al(OH)3沉淀,然后Al(OH)3溶解,但Mg(OH)2不溶。
n沉淀
Mg(OH)2 Al(OH)3
图像:
n NaOH
例:某无色溶液中,已知含有 H+、Mg2+、Al3+等阳 离子,逐滴加入 NaOH(溶液),则消耗 NaOH(溶液) 体积(x 轴)和生成沉淀量(y 轴)之间的函数关系,可用
下图表示,则下列图中正确的是(B )
练习
1、不能只用NaOH溶液除去括号中杂质的是( )
A. Mg(Al2O3) B.MgCl2(AlCl3)
B
C.Fe(Al)
D.Fe2O3(Al2O3)
2、实验室制备Al(OH)3最好用( D)
A.Al2O3和稀盐酸
B.Al2O3和水Fra bibliotekC.Al2(SO4)3和KOH
C、D
A. MgCl2和NaOH
B. NaCl和AgNO3
C. Na2CO3和HCl
D. AlCl3和KOH
类型三:向NaAlO2溶液中滴加HCl溶液至过量
现象:
图像:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
∴ x = (0.2b-0.05a) mol = 0.05(4b-a) mol
故 m[Al(OH)3] = 78 g·mol-1×0.05(4b-a) mol = 3.9(4b-a) g
【解法2:守恒法】
此时溶液中的离子有Na+、Cl-、 AlO2— 。则
n(AlO2—)=n(Na+)-n(Cl-) = 0.05a mol-0.05×3b mol
(1)、由题意可知m[Al(OH)3]=(19.4—11.6)g =7.8g,m[Mg(OH)2] =11.6g,则铝的质量分数为:
【练习】
1.有Mg、Al粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸中,要使
得到的沉淀最多,则加入2 mol·L-1的NaOH溶液的体积为
A.1000 mL
则Al3+ + 3OH- = Al(OH)3↓
1 mol
3 mol 78 g
0.04 mol
ቤተ መጻሕፍቲ ባይዱ
x
y
∴
x = 0.12 mol
y = 3.12 g
②、设溶解(3.12-0.78) g Al(OH)3消耗n mol NaOH,则 Al(OH)3 + OH- = AlO2— +2H2O
78 g
1 mol
(3.12-0.78 ) g n
分析综合问题时,要用顺序法把化学反应按先后排列出来,便于思考, 否则思维易混乱。用假设法分析多个反应中哪个优先发生(至少可以这样思 考问题,不影响解题结果),优先发生反应的产物必须不与溶液中其他成分反 应,否则不能共存。 【变式】 向20 mL 2 mol/L的AlCl3溶液中,加入30 mL烧碱溶液,充分以
3、铝三角的计算
因AlCl3与NaOH反应生成的Al(OH)3能和NaOH继续反应,其计 算方法类似于CO2与澄清石灰水的反应,其规律如下:
(1).求产物Al(OH)3的物质的量 当 n(OH-) ≤ 3n(Al3+) 时,n[Al(OH)3]= 1∕3 n(OH-) 当3n(Al3+)<n(OH-)<4n(Al3+)时,n[Al(OH)3]=4n(Al3+)-n(OH-)当
n[Al(OH)3]=n(Al3+)总-n(AlO2— )=0.05b mol-(0.05a mol-0.15b mol)
=(0.2b-0.05a) mol=0.05(4b-a) mol
m[Al(OH)3]=78 g·mol-1×0.05(4b-a) mol= 3.9(4b-a) g
解化学计算题,最关键的是要搞清各个变化的化学过程,其次才是分析 其中的定量关系。
过量,生成沉淀的质量与加入NaOH溶液的体
积的关系如图所示。试求:(1)、原合金中铝的
质量分数。(2)、盐酸的物质的量浓度。
(2【)、析由解图】示可观知察完图全象可沉知淀:时(1消)、耗镁N、aO铝H溶溶于液160mL,最终溶液中只 含NaC盐l,酸后相,当盐于酸中过和量剩,余中盐和酸过和量盐溶酸解消M耗g、的ANal所OH消溶耗液的20盐m酸L。的总量。故
Al3+ +3NH3.H2O = Al(OH)3↓+3NH4+
0
1
2
3
n( NH3.H2O )
7.往AlCl3溶液中加入NaAlO2溶液
n[Al(OH)3] ↓ 4
Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0
1
2
3
8.往NaAlO2溶液中加入AlCl3溶液
n[Al(OH)3] ↓ 4
应后,得0.78 g沉淀,求烧碱溶液的物质的量浓度是多少?
【析解】 Al3+与OH-反应生成Al(OH)3的计算有三种类型:
Al3++3OH-===Al(OH)3↓
a
b
? 知Al3+和OH-,求Al(OH)3
【答案】
a
?
b
?b
a
本题属于第二种类型
知Al3+和Al(OH)3,求OH- 知OH-和Al(OH)3,求Al3+
1 mol·L-1 或5 mol·L-1
【解析】 (1)、 设Al3+过量(一般Al3+过量最易求解)
Al3+ + 3OH- = 3 mol
Al(OH)3↓ 78 g
0.030 L·c
0.78 g
∴
c = 1 mol·L-1
(2) 、设OH-过量,按反应历程求解
①、设Al3+完全反应时消耗x mol NaOH,生成y g沉淀。
n(NaAlO2)
Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0
1
2
3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) n[Al(OH)3] ↓ 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3—
2或1 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
(1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。 (2)、当a、b满足________条件时,无沉淀产生。
(3)、当a、b满足________条件时,先有沉淀生成,后又有部分沉淀
溶解,此时Al(OH)3的质量为________g。 【解析】 依题意知在AlCl3溶液中加入NaOH溶液有如下两个反应发生: ① AlCl3+3NaOH = Al(OH)3↓+3NaCl ,② AlCl3+4NaOH = NaAlO2+ 3NaCl + 2H2O 。据此可以看出: (1)、当 a ≤ 3b 时只发生反应① ,此时NaOH不足量,产生沉淀的量取决于 NaOH。n[Al(OH)3]= n(NaOH)/3。所以答案为:0.05a/3 mol。 (2)、如果无沉淀生成,Al 元素全部以AlO2—形式存在。此时,有: n(AlCl3)∶n(NaOH) ≤ 1∶4 ,即 a∶b ≥ 4∶1,故答案为:a ≥ 4b。 (3)、此种情况应当是两个反应均发生,铝元素以Al(OH)3和AlO2—两种形式 存在。则符合关系:
n[沉淀]
2 Mg2++2OH—=Mg(OH)2↓ Al3++3OH—=Al(OH)3↓
1
Al(OH)3+OH—= AlO2—+2H2O
1234 5 67
OH—+H+ = H2O
n(NaOH)
12. 往OH—、AlO2— 、 Mg(OH)2各1mol的混合 溶液中加入盐酸至过量
OH— + H+ = H2O
1
Al(OH)3 + 3H+ = Al3+ + 3H2O
AlO2— + H+ + H2O =Al(OH)3↓
1
2
3
4
4.往稀盐酸溶液中加入 NaAlO2至过量
n[Al(OH)3] ↓
4
n(HCl)
Al3++3AlO2—+6H2O=4Al(OH)3↓
AlO2— + 4H+
= Al3+ + 2H2O1
2
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量
若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3 在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。
有∴大溶:液量用时(2c)(于,、H溶AC当0ll解(.H沉)O80=ACH淀0lnl)m(3质O/的—VoH量l质=—)3不。量0—.变8为—0时0(1—m,90.o.4—此1l-/60时L1.N11×沉0a.6LO淀5) .H=0g(10,81m..沉06o0l淀gm/)L只减ol有/少LM的g过(((O12程))H38中)6.20%,,0 则m消沉o耗l淀·的L达N-a到1O最H
整理:
求沉淀的量的方法很多。
【解法1:代数法】 设反应①中,AlCl3物质的量为x,则Al(OH)3的物 质 的 量 为 x, NaOH的 物质 的 量 为 3x。 反 应 ② 中 AlCl3物 质 的量 为 y, NaOH的物质的量为4y。有
x + y = 0.05b mol
和 3x + 4y = 0.05a mpl
3
4
n(NaAlO-2)
5.往NaAlO2和NaOH混合溶液中加入HCl溶液至过量
n[Al(OH)3] ↓
1
AlO2—+H++H2O=Al(OH)3↓
Al(OH)3+3H+=Al3++3H2O
OH—+H+=H2O 1 2
34
5
6.往AlCl3溶液中滴加入氨水至过量
n[Al(OH)3] ↓ 1
n(HCl)
铝及其重要化合 Al
物之间的转化
①②
⑤
Al2O3
④ ⑥
⑦ ③
Al3+
⑨ Al(OH)3 ⑩
⑧
⑾
⑿
⒀
AlO2
点燃
① 4Al+3O2 === 2 Al2O3
②
电解
2Al2O3 =4Al+ 3O2 ↑
③
△
④
2Al(OH)3=Al2O3+3H2O
2Al+6H+=2Al3++3H2↑
⑤ 2Al+2OH-+2H2O=2AlO2-+3H2↑
AlO2— + H+ + H2O = Al(OH)3↓
