同位素__专题练习
同位素(6页41题)

同位素A组1.有五种微粒分别是4019X、4018Z、4019Q+、4020R2+、4120M,它们属于几种元素A 2种B 3种C 4种D 5种2.下列各组物质中,互为同位素的是A 重氢、超重氢B 氧、臭氧C 红磷、白磷D 乙酸、丙酸3.下列各组粒子中,互为同位素的是A O2和O3B SO2和SO3C 12C和13CD D2O和T2O4.下列各组中,互为同位素的是A 金刚石石墨BC H2O D2OD 白磷红磷5.下列属于同位素的是A 金刚石和石墨B 和CaC C和 CD O2和O36.若用M代替任意一种元素的符号,那么,在①、②、③、④四种原子中,可互称同位素的是A ①和③B ②和③C ①和②D ②和④7.甲、乙两种微粒都只含有一个原子核,且核内具有相同数目的质子,这两种微粒定是A 同种原子B 同种元素C 互为同位素D 具有相同的核外电子排布89.钛是21世纪广泛使用的一种金属,它有多种同位素,如22Ti、4722Ti、4822Ti、4922Ti、5022Ti,在以上这些同位素原子中,其中子数不可能可能为A 24B 26C 28D 3010.元素X的一种同位素为,元素y的一种同位素为,已知a>c,b>d,则元素X与元素Y的中子数大小的关系是A X>YB X<YC X=YD 不能确定11.a X和b Y分别是元素X和Y的一种同位素,已知a>b,元素X和元素Y的原子量A 大于B 等于C 小于D 不能确定12.32He在热核反应堆中,没有中子辐射,这就意味着有32He生产能源时不会污染环境。
地球上32He含量很少,而在月球上却有充足的32He。
根据科学家介绍,月球上的32He储量足够人类使用1000年。
32He和42He两者是A 同系物B 同位素C 同素异形体D 同分异构体13.据最新科技报道,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是A 10B和10B20互为同位素B 10B20是一种高熔点硬度大的物质C 10B和10B20互为同分异构体D 10B中子数与核外电子数相同14.Se是人体必需微量元素,下列关于的说法正确的是A 互为同素异形体B 互为同位素C 分别含有44和46个质子D 都含有34个中子15.136C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关136C的说法不正确的是A 该粒子不显电性B 核外有13个电子,其中4个能参与成健C 在周期表中与126C占同一位置 D 相对原子质量约等于1316.136C-NMR(核磁共振)可以用于含碳化合物的结构分析。
同位素的判别和应用练习题

同位素的判别和应用练习题1. 介绍同位素是指具有相同原子序数但不同质量数的元素。
同位素的存在使得我们能够进行同位素的判别和应用。
本文将通过练习题的形式来深入探讨同位素的判别和应用。
2. 练习题一:同位素的判别a. 下列元素中,哪个元素具有不同的同位素?b. 如何判别两个同位素的不同?c. 为什么同位素的判别对于科学研究和应用具有重要意义?3. 练习题二:同位素的应用a. 同位素在生物医学中的应用有哪些?b. 同位素在环境监测中的应用有哪些?c. 同位素在能源开发中的应用有哪些?d. 同位素在考古学和地质学中的应用有哪些?4. 练习题三:同位素的实验技术a. 描述同位素标记的实验技术及其原理。
b. 简述同位素分离技术的应用。
c. 解释同位素示踪法在化学研究中的应用。
5. 练习题四:同位素的影响因素a. 影响同位素稳定性的因素有哪些?b. 同位素分析中,如何保证数据的准确性和可靠性?c. 同位素的使用是否会对环境和生物造成影响?请说明原因。
6. 练习题五:同位素的前景和挑战a. 同位素技术在未来的发展趋势是什么?b. 同位素技术面临的挑战有哪些?c. 如何解决同位素技术发展中遇到的挑战?7. 总结通过本文的练习题,我们了解了同位素的判别和应用。
同位素的判别对于科学研究和应用具有重要意义。
同位素的应用广泛涉及生物医学、环境监测、能源开发、考古学和地质学等领域。
同位素的实验技术包括同位素标记、同位素分离和同位素示踪法等。
同位素的稳定性、数据准确性和环境生物影响是同位素研究中需要考虑的因素。
同位素技术在未来有着广阔的前景,但也面临着挑战。
解决这些挑战需要进一步的研究和技术创新。
同位素技术的发展将为科学研究和工业应用提供更多的可能性。
同位素例题——精选推荐

《同位素》习题1.钛(Ti )金属常被称为未来钢铁。
)金属常被称为未来钢铁。
钛元素的同位素钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti 5022中,中子数不可能为(中子数不可能为( )A .30 B .28 C .26 D .24 2.填表。
.填表。
微粒微粒 电子数电子数 质子数质子数 中子数中子数 质量数质量数 最外层电子数最外层电子数1737Cl 818O 1327Al 1634S 2-3.O 元素有16O 、17O 、18O ,H 元素有1H 、2H 、3H 。
则过氧化氢分子有则过氧化氢分子有 种;用仪器测它们的相对分子质量,不同的值有用仪器测它们的相对分子质量,不同的值有 种。
种。
4.已知镁有三种同位素,各同位素的原子个数含量如下:2412Mg (占78.70%), 2512Mg(占10.13%), 2612Mg (占11.17%)。
请计算镁元素的近似相对原子质量。
请计算镁元素的近似相对原子质量。
5.氯只有3517Cl 和3717Cl 两各稳定同位素,它们在氯气中的原子数之比3517Cl ∶3717Cl 为3∶1。
则分子量为70、72、74的氯气分子数之比可能是(的氯气分子数之比可能是( )A .5∶2∶1 B .5∶2∶2 C .9∶3∶1 D .9∶3∶2 6.已知X 元素能形成相对分子质量分别为a 、b 、c 的三种双原子分子,其分子个数之比为m :n :q ,且a>b>c ,则X 元素存在元素存在 种同位素,其质量数分别为其质量数分别为 ; 其中质量数大的同位素原子占该元素原子总数的百分比为其中质量数大的同位素原子占该元素原子总数的百分比为 。
7.将某文献资料上记载的相对原子质量的数据摘录如下:.将某文献资料上记载的相对原子质量的数据摘录如下:35Cl 34.969 75.77% 35Cl 35 75.77% 37Cl 36.966 24.23% 37Cl 37 24.23% 平均平均35.453 平均平均35.485 试回答下列问题:试回答下列问题: (1)34.969是表示:是表示: (2)35.453是表示:是表示: (3)35是表示:是表示: (4)35.485是表示:是表示: (5) 24.23%是表示:是表示:8.已知:KClO3+6HCl=KCl+3Cl2↑+3H2O,现用K37ClO3和H35Cl反应,求制备的Cl2的摩尔质量。
同位素习题

1.下列各组物质中,互为同位素的是()A重氢、超重氢 B 氧、臭氧 C 红磷、白磷 D 乙酸、丙酸2.下列各组粒子中,互为同位素的是()A O2和O3B SO2和SO3C12C和13C D D2O和T2O3.甲乙两种微粒都只含有一个原子核,且核内具有相同数目的质子,这两种微粒定是()A 同种原子B同种元素C 互为同位素D 具有相同的核外电子排布4.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,发明人为此获得2002年诺贝尔化学奖。
下面有关13C、15N叙述正确的是()A 13C与15N有相同的中子数B 13C与C60互为同素异形体C15N与14N互为同位素 D 15N的核外电子数与中子数相同5.最近,医学家们通过用放射性14C原子标记的C60示踪发现,C60的一种羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)病毒。
其中,关于放射性14C 的叙述中正确的是()A 与C60中普通碳原子的化学性质不同 B 与14N中所含中子数相同C 与C60互为同素异形体D与12C互为同位素6.14C是宇宙射线与大气中的氮通过核反应产生的,它和12C以一定比例混合存在于空气中的二氧化碳里。
14C随生物体的吸收代谢,经过食物链进入活的生物体中。
当生物死亡之后新陈代谢停止,在以后年代里,12C通常不再发生变化,其数量固定下来,而14C具有放射性,仍不断衰变减少。
与其有关的说法中不正确的是()A 14C与12C互为同位素B 等物质的量的14C与12C所含的中子数不同C 0.012kg的14C中含有NA 个碳原子数(NA表示阿伏加德罗常数)D 可根据14C在生物体内的含量来计算生物体的死亡年代7.某金属元素的一种同位素R的质量数为52,已知R离子含有28个中子、21个电子、由这种离子组成的化合物的化学式正确的是( )A .RCl2B. R(OH)3C.RO28.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )A.R(OH)3B.R2O7C.HRO3D.H2R9.溴有两种同位素,原子个数比约为1:1,已知溴的近似原子量为80,这两种同位素的中子数分别为( )A.44和 45 B.45和 46 C.44和 46 D.79和8110.原子序数为47的银元素有两种同位素,它们的原子百分比近似相等。
同位素标记法专项练习
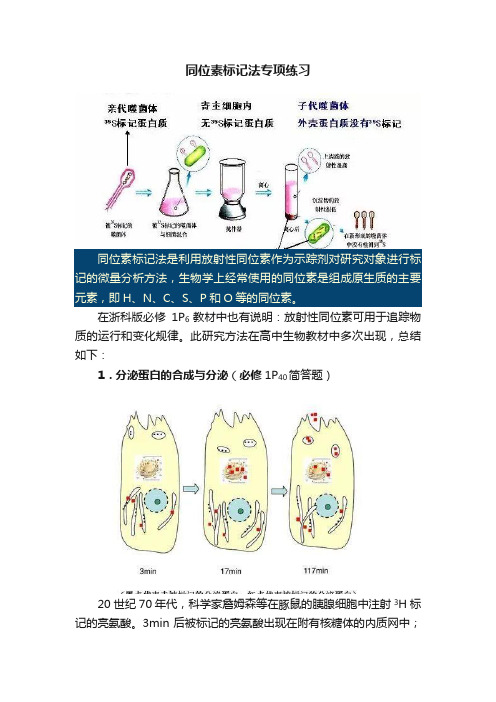
同位素标记法专项练习同位素标记法是利用放射性同位素作为示踪剂对研究对象进行标记的微量分析方法,生物学上经常使用的同位素是组成原生质的主要元素,即H、N、C、S、P和O等的同位素。
在浙科版必修1P6教材中也有说明:放射性同位素可用于追踪物质的运行和变化规律。
此研究方法在高中生物教材中多次出现,总结如下:1.分泌蛋白的合成与分泌(必修1P40简答题)20世纪70年代,科学家詹姆森等在豚鼠的胰腺细胞中注射3H标记的亮氨酸。
3min后被标记的亮氨酸出现在附有核糖体的内质网中;17min后,出现在高尔基体中;117min后,出现在靠近细胞膜内侧的囊泡中及释放到细胞外的分泌物中。
由此发现了分泌蛋白的合成与分泌途径:核糖体→内质网→高尔基体→囊泡→细胞膜→外排。
(2019·全国高一月考)下列关于分泌蛋白的合成与分泌,叙述错误的是()A.线粒体参与分泌蛋白的合成和运输B.高尔基体在该过程中起着重要的交通枢纽作用C.分泌蛋白从合成到分泌至细胞外共穿过5层生物膜D.科学家常用同位素标记法研究分泌蛋白的合成和分泌【答案】C【解析】分泌蛋白合成与分泌过程:核糖体合成蛋白质→内质网进行粗加工→内质网“出芽”形成囊泡→高尔基体进行再加工形成成熟的蛋白质→高尔基体“出芽”形成囊泡→细胞膜,整个过程还需要线粒体提供能量。
【详解】A、线粒体为分泌蛋白的合成和运输提供能量,A正确;B、高尔基体在该过程中起着重要的加工和运输作用,B正确;C、分泌蛋白在内质网上的核糖体中合成,核糖体无膜结构,进入内质网后以出芽的形式通过囊泡在内质网膜、高尔基体膜、细胞膜互相融合,此过程并没有穿过磷脂双分子层,所以此过程分泌蛋白通过了1层生物膜,C错误;D、科学家用同位素标记法研究分泌蛋白的合成和分泌,D正确。
【点睛】解答此题要求考生识记细胞中各种细胞器结构、分布和功能,掌握分泌蛋白的合成与分泌过程,能结合所学的知识准确判断各选项。
2.光合作用中氧气的来源1939年,鲁宾和卡门用18O分别标记H2O和CO2,然后进行两组对比实验:一组提供H2O和C18O2,另一组提供H218O和CO2。
同位素习题

同位素习题1.某金属元素的一种同位素R 的质量数为52,已知R 离子含有28个中子、21个电子、由这种离子组成的化合物的化学式正确的是( )A .RCl 2 B. R(OH)3 C.RO 2 D.K 2R 2O 72.非金属元素R 其质量数为127,又知R 离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )A .R(OH)3B .R 2O 7C .HRO 3D .H 2R3.溴有两种同位素,原子个数比约为1:1,已知溴的近似原子量为80,这两种同位素的中子数分别为 ( )A .44和 45B .45和 46C .44和 46D .79和814.原子序数为47的银元素有两种同位素,它们的原子百分比近似相等。
已知银元素的近似原子量为108,则每种同位素原子里的中子数分别为( )A .110和106B .57和63C .53和73D .60和625..已知自然界氧的同位素有16O 、17O 、18O ,氢的同位素有H 、D ,从水分子的原子组成来看,自然界的水一共有()A 3种 B 6种 C 9种 D 12种 6.氢的三种同位素:H 、D 、T ,氯有两种同位素: 35Cl 、37Cl ;当组成氯化氢分子时,其分子量所得的数值有()A 5种B 6种C 7种D 8种7.已知氢元素有1H 、2H 、3H 三种同位素,氧元素也有16O 、18O 二种同位素。
它们之间形成化合物的种类有()A 30种B 18种C 21种D 33种8.某元素构成的双原子单质分子有3种,其分子量分别为158、160、162。
在天然单质中,此三种单质的物质的量之比为1︰1︰1,由此推断的以下结论中正确的是()A 此元素有三种同位素B 其中质量数为79的同位素原子占原子总数的1/2C 其中一种同位素的质量数为80D 此元素的单质的平均分子量为1609.氯气只有35Cl 、37Cl 两种稳定的同位素,他们在氯气中的原子个数之比为3:1则相对分子质量为70、72、74的氯气分子数之比为( )A 、5:2:1B 、5:2:2C 、9:3:1D 、9:3:210..氯元素构成的双原子分子有三种,其相对分子质量分别为70、72、74。
高三化学同位素复习试题(含答案)

1、下列有关说法中正确的是()A.16O、17O、18O互为同位素B.金刚石和石墨互为同分异构体C.CH3CH2CH2CH3和CH3CH(CH3)CH2CH3互为同分异构体D.甲醇(CH3OH)、乙二醇()、丙三醇()互为同系物答案A2、下列说法正确的是()A.H2、D2、T2互称为同位素B.漂白粉、氯水是混合物,水银、明矾是纯净物C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质D.水能、风能、煤、石油、天然气都是可再生能源答案A.H2、D2、T2是氢元素形成的结构相同的单质,为同一物质,故A错误;B.漂白粉是氯化钙、次氯酸钙的混合物、氯水是氯气的水溶液是混合物,水银、明矾是纯净物,故B正确;C.HCl、BaSO4是电解质,CO2、NH3、CH3CH2OH是非电解质,Cl2既不是电解质又不是非电解质,故C错误;D.煤、石油、天然气是不可再生能源,故D错误.故选B.3、下列有关说法正确的是()A.和4互为同位素B.和是两种核素C.和4的中子数相等D.和的质量数相等答案B4、下列各组中属于同位素关系的是()A.与 B.T2O与H2OC.与 D.金刚石与石墨答案C5、下列各组的两种微粒间互为同位素的是()A.质子数12,中子数12与质子数12,中子数13 B.Mg2+与MgC.Cl-与ClD.质量数均为40的K与Ca答案A6、下列说法正确的是()A.二氧化硫、三氧化硫互为同素异形体B.氕、氘、氚互为氢元素的同位素C.碘晶体、碘蒸气是同素异形体D.H2O和D2O互为同位素答案B7、四组微粒或物质.互为同位素的是(填序号)______;互为同素异形体的是(填序号)______;有①和④的微粒可组成______种相对分子质量不同的三原子化合物.答案同位素指同一元素的不同原子,同分异构体指同一元素的不同单质;水分子是由1个氧原子和2个氢原子构成,从氢的三种同位素中选两个氢原子,两个氢原子可以相同也可不同,所以相对分子质量的和分别为2、3、4、5、6;氧原子相对分子质量分别为16、17、18,所以相对分子质量的种类数为7,故答案为:①④;③;7.8、下列互称为同位素的是()A.202Pt和198Pt B.CO和CO2C.O2和O3 D.H2O和D2O答案A9、下列说法正确的是()A.14C与14N互为同位素B.葡萄糖与果糖互为同分异构体C.H2与CH4互为同系物D.SO2与SO3互为同素异形体答案B。
同位素__专题练习

同位素 专题练习1、有六种微粒分别就是4019X,4020Y,4018Z,4019Q +,4020K 2+,4020M,它们隶属元素的种类 ( )A.2种B.3种C.4 种D.5种2、4018Ar 、4019K 、4020Ca 三种原子, 它们具有相同的 ( )A.电子数B.中子数C.电子层数D.质量数3、下列各组物质中,互为同位素的就是 ( )A.O 2、、O 3 、O 4B.H 2、D 2、T 2C.H 2O 、D 2O 、 T 2OD.6329Cu 与6529Cu4、下列关于原子的几种描述中,不正确的就是 ( )A.18O 与19F 具有相同的中子数B.16O 与17O 具有相同的电子数C.12C 与13C 具有相同的质量数D.15N 与14N 具有相同的质子数5、分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数就是 ( )A.12B.14C.16D.186、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可作为今后核聚变的重要原料之一。
氦的这种同位素应表示为 ( )A.He 43B.He 32C.He 42D.He 337、(2004上海)据报道,月球上有大量3He 存在,以下关于3He 的说法正确的就是 ( )A.就是4He 的同素异形体B.比4He 多一个中子C.就是4He 的同位素D.比4He 少一个质子8、(1994上海)某微粒用R A Z n +表示,下列关于该微粒的叙述中正确的就是 ( ) A.所含质子数=A -n B.所含中子数=A -ZC.所含电子数=Z +nD.质子数=Z +A9、(1998上海)钛(Ti)金属常被称为未来钢铁。
钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti5022中,中子数不可能为 ( )A.30B.28C.26D.2410、(1999上海)据报道,上海某医院正在研究用放射性同位素碘12553I 治疗肿瘤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同位素 专题练习1、有六种微粒分别是4019X ,4020Y ,4018Z ,4019Q +,4020K 2+,4020M ,它们隶属元素的种类 ( )A .2种B .3种C .4 种D .5种2、4018Ar 、4019K 、4020Ca 三种原子, 它们具有相同的 ( )A .电子数B .中子数C .电子层数D .质量数3、下列各组物质中,互为同位素的是 ( )A .O 2、、O 3 、O 4B .H 2、D 2、T 2C .H 2O 、D 2O 、 T 2O D .6329Cu 和6529Cu4、下列关于原子的几种描述中,不正确的是 ( )A .18O 与19F 具有相同的中子数B .16O 与17O 具有相同的电子数C .12C 与13C 具有相同的质量数D .15N 与14N 具有相同的质子数5、分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg ,该同位素的原子核内的中子数是 ( )A .12B .14C .16D .186、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可作为今后核聚变的重要原料之一。
氦的这种同位素应表示为 ( )A .He 43B .He 32C .He 42D .He 337、2004上海据报道,月球上有大量3He 存在,以下关于3He 的说法正确的是 ( )A .是4He 的同素异形体B .比4He 多一个中子C .是4He 的同位素D .比4He 少一个质子8、(1994上海)某微粒用R A Z n +表示,下列关于该微粒的叙述中正确的是 ( ) A .所含质子数=A -n B .所含中子数=A -ZC .所含电子数=Z +nD .质子数=Z +A9、(1998上海)钛(Ti )金属常被称为未来钢铁。
钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti 5022中,中子数不可能为 ( ) A .30 B .28 C .26 D .2410、(1999上海)据报道,上海某医院正在研究用放射性同位素碘12553I 治疗肿瘤。
该同位素原于核内的中子数与核外电子数之差是 ( )A .72B .19C .53D .12511、(2000上海)据报道,某些建筑材料会产生放射性同位素氡22286Rn ,从而对人体产生伤害。
该同位素原子的中子数和质子数之差是 ( )A .136B .50C .86D .22212、据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的原子序数为 ( )A .111B .161C .272D .43313、参阅下列有关元素E 两种同位素的资料元素E 的相对平均原子质量是 ( )A .B .103.6C .D .14、已知元素R 的某种同位素的氯化物RCl x 为离子化合物,其中该元素的阳离子的核内有y个中子,核外有z 个电子,则该同位素的组成可表示为 ( )A .z y RB .z y zR + C .x z y zx R +++ D .x z y z R ++15、科索沃战争期间,北约部队向南联盟投下大量的贫铀弹,其中含有放射性的铀-235(235U),造成当地的放射性污染. 关于235U 和238U 原子, 下列说法不正确的是 ( )A .它们的化学性质基本相同B .它们互称同位素C .它们的质子数相等D .它们的中子数相等16、(1995上海)11H 、21H 、31H 、H +、H 2是 ( )A .氢的五种同位素B .五种氢元素C .氢的五种同素异形体D .氢元素的五种不同微粒17、下列说法正确的是 ( )①氘和氚是质量数不同、质子数相同的氢的两种同位素②氢元素是指11H③11H 、21H 、31H 是氢的三种同位素,是同一元素的三种原子④21H 和31H 的化学性质几乎完全相同A .②③B .③④C .①③④D .②③④18、电子数相等的微粒叫等电子体,下列各微粒属等电子体的是 ( )A .N 2O 4和NOB .CH 4和NH 3C .CO 2和NO 2D .NO 和O 219、下列分子或离子中,与氖原子含有相同电子数的是 ( )①F - ②Na + ③HF ④NH 3 ⑤CH 4A .仅①②③B .仅②③④C .仅①②⑤D .①②③④⑤20、(2004广东下列各组物质中,互为同位素的是 ( )A .重氢、超重氢B .氧、臭氧C .红磷、白磷D .金刚石、和石墨21、已知硼元素有两种天然同位素10B 和11B ,硼元素的原子量为,则10B 和11B 的原子个数比为 ( )A .1∶4B .1∶3C .1∶1D .4∶122、(1999年全国高考题)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为,这两种同位素的原子个数比应为 ( )A .39∶61B .61∶39C .1∶1D .39∶1123、(1993上海)核内中子数为N 的R 2+的离子,质量数为A ,则n 克它的氧化物中所含质子 的物质的量为 ( )A .16+A n (A -N +8)B .16+A n (A -N +10)C .(A-N+2)D .An (A -N +6) 24、(04年天津理综)核磁共振(NMR )技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。
已知只有质子数或中子数为奇数的原子核有NMR 现象。
试判断下列哪组原子均可产生NMR 现象 ( )A .O 18 P 31 Sn 119B .Al 27 F 19C 12C .元素周期表中VA 族所有元素的原子D .元素周期表中第1周期所有元素的原子25、2003上海13C —NMR (核磁共振)、15N —NMR 可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich 等人为此获得2002年诺贝尔化学奖。
下面有关13C 、15N 叙述正确的是 ( )A .13C 与15N 有相同的中子数B .13C 与C 60互为同素异形体C .15N 与14N 互为同位素D .15N 的核外电子数与中子数相同26、136C -NMR (核磁共振)可以用于含碳化合物的结构分析。
136C 表示的碳原子 ( )A .核外有13个电子,其中4个能参与成键B .核内有6个质子,核外有7个电子C .质量数为13,原子序数为6,核内有7个质子D .质量数为13,原子序数为6,核内有7个中子27、Se (硒)是人体必需微量元素。
下列关于Se 7834和Se 8034的说法正确的是( )A .Se 7834和Se 8034互为同素异形体B .Se 7834和Se 8034互为同位素C .Se 7834和Se 8034分别含有44个和46个质子D .Se 7834和Se 8034都含有34个中子 28、非金属元素X 有两种同位素Z A X 和Z BX ,由X 元素形成的双原子单质分子有 ( )A .1种B .2种C .3种D .4种29、已知自然界氧的同位素有16O 、17O 、18O ,氢的同位素有 H 、D ,从水分子的原子组成来看,自然界的水一共有 ( )A .3种B .6种C .9种D .12种30、已知碳有两种常见的同位素12C 、13C ;氧也有常见的三种同位素16O 、17O 、18O 。
由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有 ( )A .6种B .10种C .11种D .12种31、科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子。
关于该新元素的下列叙述正确的是()A.其原子核内中子数和质子数都是112B.其原子核内中子数为277,核外电子数为112C.其原子质量是12C原子质量的277倍D.其原子质量与12C原子质量之比约为277∶1232、氯元素的天然同位素有3517Cl和3717Cl,氯元素的相对原子质量为。
则天然氯元素中,35 17Cl和3717Cl的原子数目之比约为()A.3∶1 B.1∶3 C.3∶2 D.4∶133、哈雷彗星上碳的两种同位素12C、13C原子个数之比为65∶1,而地球上12C和13C原子个数比为89∶1,地球上碳元素相对原子质量是,那么,哈雷彗星上碳元素相对原子质量应是()A. B.12.009 C. D.34、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。
如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。
下列说法中正确的是()A.34S原子核内的中子数为16 B.1H216O在相同条件下比1H218O更易蒸发C.13C 和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强35.某元素X构成的双原子单质分子有三种,其式量分别为70、72、74,在天然单质中,此三种单质的物质的量之比为9∶6∶1,由此推断以下结论中正确的是()A.元素X有三种同位素 B.其中一种同位素质量数为36 C.质量数为35的同位素原子的质量分数为75% D.元素单质X2的平均式量为7136、X元素组成三种气态单质都是双原子分子,它们的相对分子质量分别是32、34、36。
现有这三种单质的混合气体,分子数之比为15∶4∶1,下列说法正确的是()A.若该容器中的X2全部转化成同素异形体X3,则X3的分子有4种B.质量数为16的同位数的原子物质的量分数为85%C.此容器内混气体的平均相对分子质量为34D.该元素所含三种同位素的原子数之比为15∶4∶137、某元素构成的双原子单质分子有3种,其相对分子质量分别为158,160,162,在天然单质中,此三种单质的物质的量之比为1∶1∶1,由此推断以下结论中,正确的是()A.此元素有三种同位素B.其中一种同位素质量数80C.其中质量数为79的同位素原子占原子总数的1/2D.此元素的单质的平均相对分子质量为16038、下列叙述正确的是()A.质子数相同的微粒之间一定互称同位素B.属于同位素关系的原子一定为同种元素C.所有原子均包含质子、中子和电子等基本微粒D.16O,17O,18O之间互称同位素39、(2000年上海高考题)氯只有3517Cl和3717Cl两各稳定同位素,它们在氯气中的原子数之比35 17Cl∶3717Cl为3∶1。
则分子量为70、72、74的氯气分子数之比可能是()A.5∶2∶1 B.5∶2∶2 C.9∶3∶1 D.9∶3∶240、由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比不可能为()A.29∶8∶13 B.39∶24∶5C.13∶8∶29 D.26∶16∶57同位素专题练习参考答案。
