噻吩 嘧啶 吲哚性质对比
杂环化合物-全

共用杂原子编号 共用C 不编号
Ph
5 6 3
4 1 2
N
b a
3 c
3 2
N
b a
4 c d 4 5 3
N
7
S
1
2
O
1
N6 H
1 2
N5
5-苯基咪唑并[2,1-b]噻唑
6H-吡唑并[4,5-d]噁唑
杂环化合物的结构与芳香性
1. 五元单杂环(呋喃、噻吩、吡咯)的结构
富电子芳环
N H
N
π电子数=6 符合4n+2规则
A
A
E
A
反应相对活性
>
N H O
>
S
>
5 109 1
3
1018
6
1011
含一个杂原子的五元单杂环----亲电取代
对取代位置的解释
分析反应中间体的相对稳定性 i. 取代在α位
E
A A H E A H E A H E
− H+
A E
哪个共振式贡献最大? 中间体有三个主要共振式,较稳定
ii. 取代在β位
E H E H E −H A
吡咯和吡啶的比较 吡 咯 吡 啶
N H
N
N
结 构 性 质
N上的孤对电子 在p轨道上,参 与环内共轭 富电子芳杂环 弱酸性 易亲电取代
N上的孤对电子在sp2 轨道上,在环外,未 参与环内共轭 “缺电子芳杂环” 碱性 易亲核取代
杂环化合物的结构和芳香性
由于芳杂环中电子的离域作用,环中的单、双键与孤立的单、双键不 同, 因此,可用下列式子表示
含一个杂原子的单环杂环
主要内容 五元芳杂环的化学性质 亲电取代(活性比较,反应取向) 还原反应和DielsAlder反应 某些五元杂环的特殊性质 吡啶的化学性质 碱性、亲核性、吡啶的亲电及亲核取代、侧链反应 N-氧化吡啶的性质(亲电性和亲核性)
第十六章 杂环化合物

NH2
16.2 喹啉和异喹啉
亲电取代主要发生在5和8位
3、亲核加成——主要发生在2位
4、合成——Skraup反应
CH2 OH CH OH H 浓 H2SO4 - 2H2O C CH CH2
NH
O
NH2
O H C CH2 CH2
HO 烯醇化 H
HC CH CH2
CH2 OH
NH
- H2O, 关环 N H
二、化学性质
1、氮原子上的亲电加成
碱性:脂肪胺>吡啶>苯胺>吡咯
+
N
HCl
+
N H Cl
2、碳原子上的亲电取代——3位取代 反应慢
3、碳原子上的亲核取代——邻位
N
+ NaNH2
C6H5N(CH3)2 回流
N NHNa H2O
4、还原反应——比苯活泼
N
Na + C2H5OH N 或 H2, Pt, 乙 酸 N H
二、化学性质
1、亲电取代——2位
乙酰化
Ac2O S H3PO4 Ac2O O BF3 Ac2O N H 150-200℃ N H COCH3 O COCH3 S COCH3
亲电反应活性:吡咯>呋喃>噻吩>苯
2、Diels-Alder反应
O O
O
O O O
+
O O
3、衍生物-糠醛
O
CHO
硝基苯
-2H
N
4
16.3 嘧啶
无色结晶, m.p. 22oC, 溶于水.
碱性比吡啶弱, 不易发生亲电取代反应.
5 6
N3
2
N
1
吡啶衍生物存于自然界中, 是VB1主要成分.
五元含氮杂环天然产物

五元含氮杂环天然产物
含氮杂环天然产物是一类具有氮元素构建的环结构的天然有机化合物。
以下是一些常见的五元含氮杂环天然产物的代表性例子:
1.吡咯和噻吩类:
•吡咯(Pyrrole): 吡咯是一种五元杂环,存在于许多生物分子中,如色素、生物碱等。
•噻吩(Thiophene): 噻吩也是一种含氮的五元杂环,存在于一些天然化合物中,例如生物碱和一些含硫的生物分子。
2.吡嗪类:
•吡啶(Pyridine): 吡啶是一种六元杂环,但其氮原子构建了一个五元的含氮杂环。
它在天然产物中常见,如尼古丁等。
3.嘧啶类:
•嘧啶(Purine): 嘧啶是一种含有两个氮原子的六元杂环,但在生物学上,嘧啶和嘌呤经常与五元环的含氮杂环类似物一起讨论。
嘧啶是DNA和RNA的组成部分。
4.吲哚类:
•吲哚(Indole): 吲哚是一种具有含氮的五元环结构,常见于天然产物中,如色氨酸和多种生物碱。
5.异唑类:
•咪唑(Imidazole): 咪唑是一种含氮的五元环,存在于一些生物活性分子中。
例如,组氨酸脱羧酶的辅酶部分就含有咪唑结构。
这些含氮杂环在天然产物中发挥着重要的生物学功能,包括作为药物、生物碱、色素等。
它们的多样性和生物活性使得它们成为天然产物化学和药物发现研究的重要对象。
1 / 1。
吩噻嗪类抗精神病药物的分析

5. 红外光吸收特性 吩噻嗪类药物红外光吸收图谱的指纹特征随
取代基不同而不同, 可用于鉴别。
峰位 (cm-1) 1600~1450 1250 1100 950~700
归属
C=C (苯环) N-C (芳氨基) N-C (脂氨基) OOPC-H (苯环)
图11-1A 盐酸氯丙嗪的红外光吸收图谱
S
N
HCl
CH2CHN(CH3)2
CH3
盐酸异丙嗪
S
N
Cl
CH2CH2CH2 N
N CH2CH2OH
奋乃静
S
N
Cl
HCl
CH2CH2CH2N(CH3)2
盐酸氯丙嗪
S
N
CF3
CH2CH2CH2 N
N (CH2)2OCO(CH2)8CH3
癸氟奋乃静
S
N
CF3
2 HCl
CH2CH2CH2 N
N CH2CH2OH
R N 2 S
R′
+ PdCl2
R
N
R′
S
Pd2
2Cl
S
N
R′
R
【示例11-7 】 癸氟奋乃静及制剂 ChP(2010)
取本品约 50mg, 加甲醇2ml 溶解后, 加 0.1% 氯 化钯溶液 3ml, 即有沉淀生成, 并显红色, 再加过量的 氯化钯溶液, 颜色变深。
(四)含卤素取代基的反应 1.焰色反应 【示例11-8 】 奋乃静 ( JP15)
3. 与金属离子配合呈色
硫氮杂蒽母核的二价硫可与钯离子配合, 生成有色化合物, 可用于鉴别和 含量测定。
氧化产物亚砜和砜无此反应。
《有机化学》徐寿昌 第二版 第17章 杂环化合物

5.喹啉及衍生物反应特性有同环或异环取代、氧化之分。
⑥
⑦
解释吡咯为弱酸性、吡啶为弱碱性的原因?
Answer 4:
③
②
④
①
⑥
⑤
⑦
Answer 5: 五元杂环化合物吡咯环上N原子的孤对电子参与环共 轭体系,同时电负性N>H,导致N-H键电子云密度降低并向 N 原子偏转,相对易于离解出H离子而显酸性;吡啶环上N原子的 孤对电子未参与环共轭体系,易于接受质子,故显酸性。
(C)偶合反应
17.3.5 噻唑、吡唑及其衍生物
◆噻唑、吡唑的结构:
N N
N H N H
噻唑
衍生物: 青霉素 维生素B1
吡唑
咪唑
安替吡啉 安乃近
达克宁 阿司咪唑
磺胺噻唑
增白剂AD
甲巯咪唑
17.3.6 吲哚—苯并吡咯
CH2COOH
N H
NH
N H
吲哚 ⑴ 吲哚的制备:
CH3 HCHO NH2
异吲哚
(1)五元杂环化合物——呋喃、噻吩、吡咯的结构
◆五元杂环化合物中碳原子、杂原子均以sp2杂化,其
中杂原子未杂化的P轨道上的共用电子对参加了六电 子体系的形成。五个原子处于同一平面组成一个闭合 的共轭体系。体系符合4n+2休克尔规则,因此具有芳 香性.
◆芳香性程度的比较:
芳香性强弱的次序:
苯 > 噻吩 > 吡咯 > 呋喃 离域能:152 117 88 67 KJ/mol
位电子云密度:
-0.10 -0.03
-0.06
0
(2)六元杂环化合物——吡啶 氮原子与碳原子处在同一平面。吡啶的结构与苯相 似,符合休克尔规则,具有芳香性.
它易发生亲电取代反应-有机化学

• 实验室采用糠酸加热脱羧制得:
(2)化学性质 呋喃具有芳香性,较苯活泼,容易发生取代反应;还 有一定程度的不饱和化合物的性质(发生加成反应)。 (A)取代反应—— 位取代 溴代:
• 硝化(温和试剂):
• 磺化(温和试剂):
吡啶与SO3的络合物
傅-克酰基化反应
(使用缓和路易斯酸催化剂)
14.4.1 吡啶
1.碱性和亲核性— 吡啶环上氮原子有一对未共用电子没参加环上的共轭 体系,因此能与质子结合,具有弱碱性:
+ HCl N
+ N Cl H
苯胺 pKb=9.30 吡啶 pKb=8.81 氨 pKb=4.75 脂肪胺 pKb=3~5
• 吡 啶 容 易 和 SO3 结 合生成 N-磺酸吡啶, 作为温和的磺化剂。
• 呋喃、吡咯、噻吩环中的杂原子上的未共用电子对参与了环
的共轭体系,使环上的电子云密度增大,故比苯容易发生亲电 取代反应,取代通常发生在-位。
亲电取代反应活性的次序
位电子云密度
-0.10 -0.03
N H
O
S
-0.06
0
• 吡咯 > 呋喃 > 噻吩 > 苯
(2)六元杂环化合物——吡啶 氮原子与碳原子处在同一平面。 吡啶的结构与苯相似,符合休克尔规则,具有芳香性
Na + EtOH 或Pt /H2
N
N H
思考题
湿AgOH,Δ ?
α-甲基氢活泼
α-甲基吡啶和γ-甲基吡啶是吡啶的重要衍生物。 由于氮原子的吸电子诱导效应,使甲基上的氢原子 较活泼,可以和羰基化合物发生缩合反应
+ PhCHO
KOH, DMF 120℃, 72%
35个国际通用的稠环烃中文命名

35个国际通用的稠环烃中文命名一、引言稠环烃是一类含有多个环的有机化合物,其分子中至少有两个环相连或嵌套在一起。
它们的结构复杂多样,具有重要的生物学和化学活性,对于有机化学研究和应用有着重要的意义。
在国际通用的有机化学命名体系中,对于稠环烃的命名规则也有着特殊的要求和规定。
本文将详细介绍35个国际通用的稠环烃中文命名,帮助读者更全面地了解这一领域的知识。
二、35个国际通用的稠环烃中文命名1. 菲(Phenanthrene)2. 蒽(Anthracene)3. 芘(Fluorene)4. 芴(Indene)5. 苊(Azulene)6. 苓(Chrysen)7. 苊(Chrysene)8. 噻吩(Thiophene)9. 噻吩并[3,2-b]吲哚(Thieno[3,2-b]indole)10. 噻吩并[2,3-b]吲哚(Thieno[2,3-b]indole)11. 噻吩并[3,2-c]吡嗪(Thieno[3,2-c]pyridine)12. 噻吩并[2,3-c]吡嗪(Thieno[2,3-c]pyridine)13. 噻吩并[3,4-c]嘧啶(Thieno[3,4-c]pyrimidine)14. 噻吩并[2,3-c]嘧啶(Thieno[2,3-c]pyrimidine)15. 噻吩并[3,2-c]吲哚并[3,2-b]吲哚(Thieno[3,2-c]indole [3,2-b]indole)16. 噻吩并[2,3-c]吲哚并[3,2-b]吲哚(Thieno[2,3-c]indole [3,2-b]indole)17. 噻吩并[3,2-c]吡啶(Thieno[3,2-c]pyridine)18. 噻吩并[2,3-c]吡啶(Thieno[2,3-c]pyridine)19. 噻吩并[3,4-c]嘧啶(Thieno[3,4-c]pyrimidine)20. 噻吩并[2,3-c]嘧啶(Thieno[2,3-c]pyrimidine)21. 噻吩并[3,2-c]吡啶并[3,2-c]嘧啶(Thieno[3,2-c]pyridine [3,2-c]pyrimidine)22. 噻吩并[2,3-c]吡啶并[3,2-c]嘧啶(Thieno[2,3-c]pyridine [3,2-c]pyrimidine)23. 噻吩并[2,3-c]吡啶并[3,2-b]嘧啶(Thieno[2,3-c]pyridine [3,2-b]pyrimidine)24. 噻吩并[2,3-c]吡啶并[3,4-c]嘧啶(Thieno[2,3-c]pyridine [3,4-c]pyrimidine)25. 噻吩并[3,2-c]吲哚并[3,2-c]吲哚并[3,2-b]吲哚(Thieno[3,2-c]indole [3,2-c]indole [3,2-b]indole)26. 噻吩并[2,3-c]吲哚并[3,2-c]吲哚并[3,2-b]吲哚(Thieno[2,3-c]indole [3,2-c]indole [3,2-b]indole)27. 噻吩并[3,2-c]吡啶并[3,2-c]嘧啶并[3,4-c]嘧啶(Thieno[3,2-c]pyridine [3,2-c]pyrimidine [3,4-c]pyrimidine)28. 噻吩并[2,3-c]吡啶并[3,2-c]嘧啶并[3,4-c]嘧啶(Thieno[2,3-c]pyridine [3,2-c]pyrimidine [3,4-c]pyrimidine)29. 噻吩并[3,2-c]吲哚并[3,2-c]吲哚并[3,2-b]吲哚并[3,2-c]吡啶(Thieno[3,2-c]indole [3,2-c]indole [3,2-b]indole [3,2-c]pyridine)30. 噻吩并[2,3-c]吲哚并[3,2-c]吲哚并[3,2-b]吲哚并[3,2-c]吡啶(Thieno[2,3-c]indole [3,2-c]indole [3,2-b]indole [3,2-c]pyridine)31. 噻吩并[3,4-c]嘧啶并[2,3-c]吡嗪(Thieno[3,4-c]pyrimidine [2,3-c]pyridine)32. 噻吩并[2,3-c]嘧啶并[3,4-c]嘧啶(Thieno[2,3-c]pyrimidine [3,4-c]pyrimidine)33. 噻吩并[3,2-c]吲哚并[3,2-c]吡啶并[3,2-c]嘧啶(Thieno[3,2-c]indole [3,2-c]pyridine [3,2-c]pyrimidine)34. 噻吩并[2,3-c]吲哚并[3,2-c]吡啶并[3,2-c]嘧啶(Thieno[2,3-c]indole [3,2-c]pyridine [3,2-c]pyrimidine)35. 噻吩并[3,2-c]吲哚并[3,2-c]吲哚并[3,2-b]吲哚并[3,2-c]吡啶并[3,4-c]嘧啶(Thieno[3,2-c]indole [3,2-c]indole [3,2-b]indole [3,2-c]pyridine [3,4-c]pyrimidine)三、总结本文详细介绍了35个国际通用的稠环烃中文命名,包括常见的稠环烃命名以及复杂的稠环烃嵌套命名。
噻吩简介
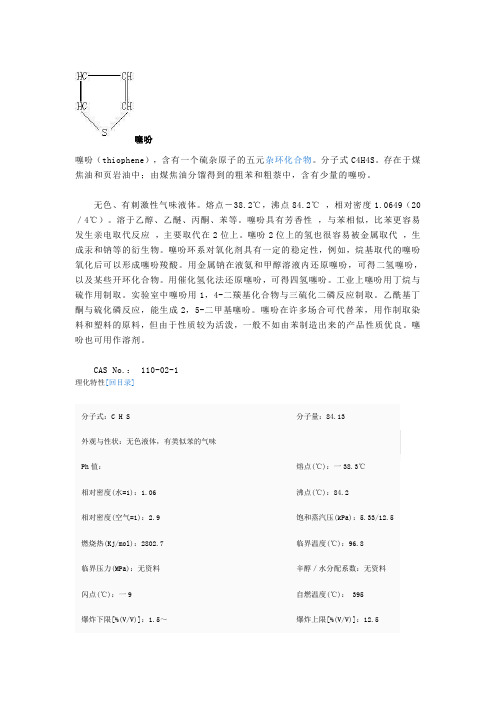
噻吩噻吩(thiophene),含有一个硫杂原子的五元杂环化合物。
分子式C4H4S。
存在于煤焦油和页岩油中;由煤焦油分馏得到的粗苯和粗萘中,含有少量的噻吩。
无色、有刺激性气味液体。
熔点-38.2℃,沸点84.2℃,相对密度1.0649(20/4℃)。
溶于乙醇、乙醚、丙酮、苯等。
噻吩具有芳香性,与苯相似,比苯更容易发生亲电取代反应,主要取代在2位上。
噻吩2位上的氢也很容易被金属取代,生成汞和钠等的衍生物。
噻吩环系对氧化剂具有一定的稳定性,例如,烷基取代的噻吩氧化后可以形成噻吩羧酸。
用金属钠在液氨和甲醇溶液内还原噻吩,可得二氢噻吩,以及某些开环化合物。
用催化氢化法还原噻吩,可得四氢噻吩。
工业上噻吩用丁烷与硫作用制取。
实验室中噻吩用1,4-二羰基化合物与三硫化二磷反应制取。
乙酰基丁酮与硫化磷反应,能生成2,5-二甲基噻吩。
噻吩在许多场合可代替苯,用作制取染料和塑料的原料,但由于性质较为活泼,一般不如由苯制造出来的产品性质优良。
噻吩也可用作溶剂。
CAS No.:110-02-1理化特性[回目录]分子式:C H S 分子量:84.13外观与性状:无色液体,有类似苯的气味Ph值:熔点(℃):一38.3℃相对密度(水=1):1.06 沸点(℃):84.2相对密度(空气=1):2.9 饱和蒸汽压(kPa):5.33/12.5燃烧热(Kj/mol):2802.7 临界温度(℃):96.8临界压力(MPa):无资料辛醇/水分配系数:无资料闪点(℃):一9 自燃温度(℃): 395爆炸下限[%(V/V)]:1.5~爆炸上限[%(V/V)]:12.5最小点火能(mJ):0.31 最大爆炸压力(MPa):0.843溶解性:本品不溶于水,可混溶于乙醇、乙醚等多种有机溶剂噻吩提取法[回目录]噻吩存在于炼焦生成的粗苯馏分中,为焦油杂质。
因噻吩与苯的沸点接近,难以用一般的分馏法将二者分开。
目前世界上的精馏提取方法主要是加氢精制法、硫酸精制法和溶剂萃取法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)水溶性。
呋喃、噻吩、吡咯分子中杂原子的未共用电子对因参与组成环状共轭体系,失去或减弱了与水分子形成氢键的可能性,致使它们都较难溶于水。
但吡咯因氮原子上的
氢还可与水形成氢键,故水溶性稍大。
三者水溶性顺序为:吡咯(1∶17)>呋喃(1∶35)>噻吩(1∶700)。
(2)环的稳定性。
呋喃、吡咯对氧化剂(甚至空气中的氧)不稳定,特别是呋喃可被氧化开环生成树脂状物;噻吩对氧化剂比较稳定,但在强氧化剂,如硝酸的作用下也可开环。
三种杂环化合物对碱都稳定,对酸的稳定性则不同。
噻吩对酸比较稳定,吡咯与浓酸
作用可聚合成树脂状物,呋喃对酸很不稳定,稀酸就可使环破坏,生成不稳定的二醛,并
聚合成树脂状物。
这是因为杂原子参与环系共轭的电子对能不同程度地与质子结合,从而
部分地破坏了环状大π键,导致环的稳定性下降。
(3)酸碱性。
三个化合物中,噻吩和呋喃既无酸性,也无碱性;吡咯从结构上看是一个仲胺,应具有碱性,但由于氮上的未共用电子对参与构成环状大π键,削弱了它与质子
的结合能力,因此吡咯的碱性极弱(p K=0.4),比一般脂肪仲胺(p K≈10)的碱性弱
得多,它不能与酸形成稳定的盐,可以认为无碱性。
另由于氮原子上的未共用电子对参与
环系的共轭,致使其电子云密度相对减小,氮原子上的氢能以质子的形式离解,所以吡咯
显弱酸性(p K=17.5)。
它可以看成是一种比苯酚酸性更弱的弱酸,能与固体氢氧化钾
作用生成盐,即吡咯钾。
这个钾盐不稳定,相对容易水解,但在一定条件下,它可以与许多试剂反应,生成一
系列氮取代产物。
例如:
吡咯的氢化产物──四氢吡咯不含有芳香共轭体系,氮上的未共用电子对可与质子结合,因此碱性大大增加,与一般脂肪仲胺碱性相当。
(4)化学性质。
呋喃、噻吩、吡咯均属多π芳杂环,环中π电子云密度大,亲电取
代反应活性比苯高,但由于它们对酸的稳定性不同,故反应条件和苯有差异。
另由于三个
化合物的芳香性比苯差,因而在一定条件下可发生加成反应,如催化加氢、Diels-Alder反
应等。
①磺化。
三个化合物中噻吩对酸较稳定,可直接用浓硫酸作磺化剂,反应在室温下就
可进行:
苯在相同的条件下很难发生反应,因此,常利用这个性质上的差异从粗苯中除掉噻吩。
其方法是在室温下反复用浓硫酸洗涤粗苯,磺化的噻吩可溶于浓硫酸,而苯不溶于浓硫酸,分离后即可得到无噻吩的苯。
这一方法同样可用于噻吩的提取、纯化。
因为噻吩-2-磺酸可经水解而去掉磺酸基。
呋喃、吡咯不能直接用浓硫酸磺化,需采用吡啶的SO加成物作磺化剂进行反应。
②硝化。
硝酸是强酸,又是强氧化剂,因此三个化合物都不能直接用硝酸硝化,而需
采用硝酸乙酰酯作硝化剂,这是一个温和的非质子硝化剂,反应应在低温下进行。
③卤代。
三个化合物都非常易于发生卤代反应,通常都得到多卤代产物,控制反应条
件也可使生成一卤代产物为主。
例如:
④付-克酰化反应。
呋喃、噻吩、吡咯均可发生付-克酰化反应,得到α位酰化产物。
例如:
从以上所举反应实例可以看到,呋喃、噻吩、吡咯发生亲电取代反应,取代基一般都
进入α位,而少进入β位,这是因为α位的π电子云密度较β位高,更易受到亲电试剂的
进攻。
这种现象也可以用共振论加以解释。
以吡咯的硝化为例,反应时,—NO可进攻β
也可进攻α位,进攻β位得到的正碳离子中间体是两个共振结构(Ⅰ与Ⅱ)的共振杂化体;进攻α位得到的正碳离子中间体是三个共振结构(Ⅲ、Ⅳ、Ⅴ)的共振杂化体,即有三个
共振式参加共振。
参加共振的共振式越多,说明正电荷的分散程度越大,共振杂化体就越
稳定。
所以在α位反应得到的中间体正碳离子比较稳定,稳定的中间体其过渡态能量低,
反应速度快。
因此这三种杂环化合物的亲电取代反应均容易在α-位发生:
⑤加成反应。
三个化合物在一定条件下都可发生加成,其中呋喃的反应活性较高,吡
咯次之。
例如:
噻吩含硫,易使催化剂中毒而失去活性,所以其催化加氢较困难,需使用特殊催化剂。
例如:
呋喃、吡咯还可作为双烯体,与亲双烯体,如丁烯二酸酐,发生Diels-Alder反应,生成相应的产物,噻吩不能发生这一反应。
例如:
⑥显色反应。
呋喃、噻吩、吡咯遇到酸浸润过的松木片,能够显示出不同的颜色。
例如,呋喃与吡咯遇到盐酸浸润过的松木片分别显深绿色和鲜红色;噻吩遇蘸有硫酸的松木
片则显蓝色。
这种反应非常灵敏,称为松片反应,可用于三种杂环化合物的鉴别。
