苯酚的显色反应
浅谈苯酚的检验实验方式方法

浅谈苯酚的检验实验方式方法作者:鄢嘉谟来源:《活力》2013年第08期[摘要]苯酚对皮肤、黏膜有强烈的腐蚀作用,对中枢神经有抑制作用,如果体内含有苯酚,则能损害肝、肾功能。
吸入高浓度苯酚蒸气可导致头痛、头晕、四肢乏力、视力模糊、肺水肿急性等中毒发生。
因此,怎样准确检测出苯酚?由于三氯化铁与苯酚反应,现象明显,反应迅速,因此,医学上常用该方法来检验苯酚的存在。
但该方法是否是检测苯酚的特效试剂呢?我尚存疑问。
本文从对此现象进行试验,找出准确检测苯酚的方法。
[关键词]检验;颜色反应;三氯化铁一、三氯化铁与酚类物质的颜色变化1.三氯化铁与酚类物质的变色原理:由于三氯化铁中的铁离子有空轨道,而酚类物质分子中由于羟基与苯环共同对电子的作用,使得酚类物质中的电子向羟基转移,使羟基一端聚集多余的电子,这样酚类物质与三氯化铁形成了络合物,呈现出颜色。
2.三氯化铁与不同酚类物质的显色现象:与苯酚显蓝紫色,与邻二苯酚显深绿色,与对二苯酚出现绿色结晶,对甲基苯酚显蓝色,偏三苯酚显蓝绿色,与连三苯酚显淡绿色。
由此可知,不同的酚类物质与三氯化铁反应呈现不同的颜色,因此可以用三氯化铁区分不同的份类物质。
但是如果是未知物,是否也能通过此方法判断是否有该物质存在?3.三氯化铁与苯酚反应的酸碱性。
苯酚与三氯化铁溶液混合,所得溶液显紫色,这也是一个平衡体系。
向溶液滴加稀硫酸后,紫色变浅,平衡向左移动;向溶液滴加浓的苯酚或三氯化铁溶液后,紫色加深,平衡向右移动;向溶液滴加NaOH 溶液后,紫色逐渐褪去,生成红褐色沉淀。
根据实验可知三氯化铁与苯酚反应显紫色的反应,与溶液的酸碱性是有关系的。
要想得到紫色的溶液,其酸碱性应保证弱酸性,即PH值在4.5—6.5范围内才能出现紫色现象。
如果酸(碱)度过高,应加碱(酸)调节PH值,以企达到实验效果。
其他酚类物质与三氯化铁反应所需的酸碱性通过实验发现,与苯酚的相同。
二、三氯化铁与酚类物质的显色实验三氯化铁的显色反应:由于三氯化铁与酚类物质的显色反应,本质上是由于烯醇式结构引起的电子偏移,使烯醇式结构物质与三氯化铁形成络合物所致,因此判断三氯化铁是否是苯酚的特效试剂,就是要通过试验验证与三氯化铁反应显紫色的是否只有苯酚这一种物质,而无其他物质。
苯酚知识点总结
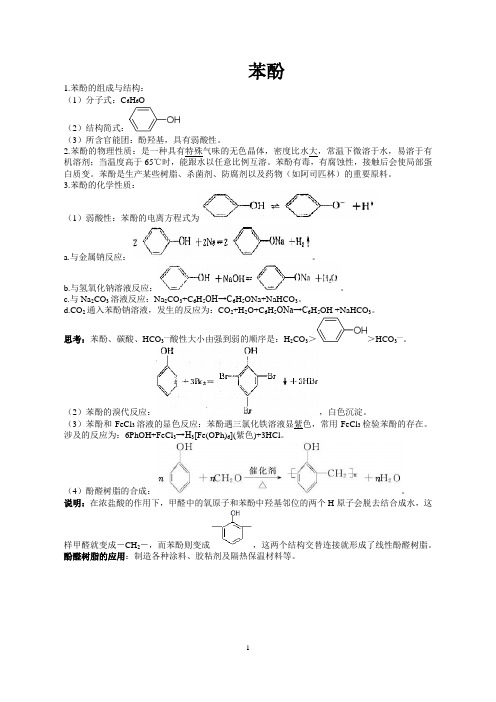
苯酚
1.苯酚的组成与结构:
(1)分子式:C6H6O
(2)结构简式:
(3)所含官能团:酚羟基,具有弱酸性。
2.苯酚的物理性质:是一种具有特殊气味的无色晶体,密度比水大,常温下微溶于水,易溶于有机溶剂;当温度高于65℃时,能跟水以任意比例互溶。
苯酚有毒,有腐蚀性,接触后会使局部蛋白质变。
苯酚是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
3.苯酚的化学性质:
(1)弱酸性:苯酚的电离方程式为
a.与金属钠反应:。
b.与氢氧化钠溶液反应:。
c.与Na2CO3溶液反应:Na2CO3+C6H5OH→C6H5ONa+NaHCO3。
d.CO2通入苯酚钠溶液,发生的反应为:CO2+H2O+C6H5ONa→C6H5OH +NaHCO3。
思考:苯酚、碳酸、HCO3—酸性大小由强到弱的顺序是:H2CO3>>HCO3—。
(2)苯酚的溴代反应:,白色沉淀。
(3)苯酚和FeCl3溶液的显色反应:苯酚遇三氯化铁溶液显紫色,常用FeCl3检验苯酚的存在。
涉及的反应为:6PhOH+FeCl3→H3[Fe(OPh)6](紫色)+3HCl。
(4)酚醛树脂的合成:。
说明:在浓盐酸的作用下,甲醛中的氧原子和苯酚中羟基邻位的两个H原子会脱去结合成水,这样甲醛就变成-CH2-,而苯酚则变成,这两个结构交替连接就形成了线性酚醛树脂。
酚醛树脂的应用:制造各种涂料、胶粘剂及隔热保温材料等。
1。
苯酚理化性质与质量指标

苯酚理化性质与质量指标1.1 苯酚的基本概况苯酚:又名石炭酸;酚;羟基苯;英文名:Phenol;Hydroxybenzene;分子式:C6H6O;C A S:108-95-2;结构式:图1.1苯酚分子结构式苯酚(俗称石炭酸)是一种常见的化学品,是重要的有机化工原料,是丙烯的重要衍生物之一,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
也是一种电解质。
苯酚用途广泛,产量大,工业上主要由异丙苯制得。
第一次世界大战前,苯酚的唯一来源是从煤焦油中提取。
目前绝大部分是通过合成方法得到。
有磺化法、氯苯法、异丙苯法等方法。
1.2 苯酚的物化性质苯酚又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
物理性质:常温下为一种无色或白色的晶体,有特殊气味(有令人作呕的甜和辣的气味)。
苯酚密度比水大,常温下微溶于水,可在水中形成白色混浊。
当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
易溶于醇、醚等有机溶剂;在乙醇、氯仿、乙醚、醋酸酯、甲苯、甘油中可溶解50%以上,在矿物油中的溶解度小。
苯酚为无色针状结晶或白色结晶,有特殊气味,遇空气和光变红,遇碱变色更快。
分子式C6H6O。
分子量94.11。
相对密度1.071。
熔点40.85℃(超纯,含杂质熔点提高)。
沸点181.9℃。
闪点79.44℃(闭杯),85℃(开杯)。
自燃点715℃。
蒸气密度3.24。
蒸气压0.13kPa(40.1℃)。
蒸气与空气混合物燃烧限1.7~8.6% 。
1克溶于约15ml水(0.67%,25℃加热后可以任何比例溶解),12ml苯。
易溶于醇、氯仿、乙醚、丙三醇、二硫化碳、凡士林、碱金属氢氧化物水溶液,几乎不溶于石油醚。
水溶液pH值约为6.0。
表1.1 苯酚基本物理性质表苯酚石炭酸外观与性状白色结晶,有特殊气味。
分子式C6H6O 分子量94.11pH值 6.0 熔点(℃) 40.6(超纯,含杂质熔点提高)沸点(℃) 181.9 闪点(℃) 79.44℃(闭杯) 85℃(开杯) 相对密度(水=1) 1.07 引燃温度715℃相对蒸气密度(空气=1) 3.24 饱和蒸气压0.13(40.1℃) (kPa)辛醇/水分配系数的对数值 1.46 临界压力 6.13(MPa)燃烧热(kJ/mol) 3050.6 临界温度(℃) 419.2爆炸上限%(V/V) 1.7 爆炸下限%(V/V) 8.6溶解性:可混溶于乙醇、醚、氯仿、甘油。
苯酚的基本性质

苯酚苯酚(Phenol,C6H5OH)[1] 是一种具有特殊气味的无色针状晶体,[2] 有毒,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
也可用于消毒外科器械和排泄物的处理[3] 皮肤杀菌、止痒及中耳炎。
熔点43℃,常温下微溶于水,易溶于有机溶剂;当温度高于65℃时,能跟水以任意比例互溶。
苯酚有腐蚀性,接触后会使局部蛋白质变性,其溶液沾到皮肤上可用酒精洗涤。
[4] 小部分苯酚暴露在空气中被氧气氧化为醌而呈粉红色。
遇三价铁离子变紫,通常用此方法来检验苯酚。
中文名苯酚英文名Phenol别称石炭酸、酚、羟基苯化学式C6H5OH分子量94.11熔点40-42℃沸点181.9℃水溶性微溶于冷水,在65℃与水混溶。
可混溶于乙醇、醚、氯仿、甘油密度1.071g/mL(25℃)外观无色或白色晶体,有特殊气味。
在空气中及光线下变为粉红色闪点:185℉/85℃应用:化工合成、油田工业、电镀、溶剂,医学安全性描述:S26,S28,S45,S24/S25,S36/S37/S39危险性符号:F(易燃),T(有毒),C(腐蚀性)危险性描述:R34,R68,R23/24/25,R48/20/21/22危险品运输编号:UN 2821 6.1/PG 2化学性质弱酸性,高毒类,突变原,还原性稳定性稳定禁配物强氧化剂、强酸、强碱储存方法阴凉通风,低温避光,注意泄漏物PSA20.23000 LogP1.39220 折射率n20/D 1.5418分子结构苯酚分子由一个羟基直接连在苯环上构成。
由于苯环的稳定性,这样的结构几乎不会转化为酮式结构[5]。
苯酚共振结构如右上图。
酚羟基的氧原子采用sp2杂化,提供一对孤电子与苯环的6个碳原子共同形成离域键。
大π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
苯酚盐负离子则有如右下图共振结构:摩尔折射率:28.13摩尔体积(m3/mol):87.8等张比容(90.2K):222.2表面张力(dyne/cm):40.9极化率:11.15[5]苯酚物理性质相对蒸气密度(空气=1):3.24折射率1.5418饱和蒸气压(kPa):0.13(40.1℃)燃烧热(kJ/mol):3050.6临界温度(℃):419.2临界压力(MPa):6.13辛醇/水分配系数的对数值:1.46 爆炸上限%(V/V):8.6引燃温度(℃):715爆炸下限%(V/V):1.7溶解性:可混溶于醚、氯仿、甘油、二硫化碳、凡士林、挥发油、强碱水溶液。
苯酚的显色反应方程式

苯酚的显色反应方程式
苯酚是一种有机化合物,化学式为C6H5OH,常温下为白色晶体,具有刺激性气味。
苯酚是一种重要的化学原料,在医药、染料、香料等领域有广泛的应用。
苯酚的显色反应是指在特定条件下,苯酚与某些试剂发生反应,产生明显的颜色变化。
这种反应常用于分析化学中,可以用来检测苯酚的存在或浓度。
下面介绍几种常见的苯酚显色反应:
1. 铁(Ⅲ)离子显色法
将少量苯酚溶液滴加到含铁离子的溶液中,出现深紫色沉淀即为阳性反应。
这是因为苯酚与铁(Ⅲ)离子形成络合物Fe(C6H5O)3,并沉淀下来。
反应方程式:3C6H5OH + FeCl3 → Fe(C6H5O)3↓ + 3HCl
2. 碘液显色法
将少量碘液滴加到苯酚溶液中,出现紫黑色沉淀即为阳性反应。
这是因为碘和苯酚发生氧化反应,生成紫黑色的碘苯。
反应方程式:C6H5OH + I2 → C6H5I + H2O
3. 氯仿显色法
将少量氯仿滴加到苯酚溶液中,出现深红色沉淀即为阳性反应。
这是因为氯仿和苯酚发生取代反应,生成红色的取代产物。
反应方程式:C6H5OH + CHCl3 → C6H4ClOH + HCl
以上三种方法都是常用的苯酚显色反应方法,可以根据需要选择合适的方法进行分析。
总之,苯酚显色反应是一种重要的化学分析方法,在实验室中有广泛的应用。
掌握这些方法不仅可以检测苯酚的存在或浓度,还可以为其他相关领域提供支持。
紫外可见苯酚实验报告(3篇)

第1篇一、实验目的1. 掌握紫外可见分光光度法的基本原理和应用。
2. 学习紫外可见分光光度计的使用方法。
3. 了解苯酚在紫外可见光区的吸收特性,并测定苯酚溶液的浓度。
二、实验原理苯酚是一种有机化合物,分子式为C6H5OH。
苯酚在紫外可见光区具有特征吸收,其最大吸收波长为270-295nm。
紫外可见分光光度法是利用苯酚在紫外可见光区吸收特定波长的光而进行定量分析的方法。
根据朗伯-比尔定律,苯酚溶液的吸光度与其浓度成正比,即A = εcl,其中A为吸光度,ε为摩尔吸光系数,c为苯酚溶液的浓度,l为光程。
三、实验仪器与试剂1. 仪器:- 紫外可见分光光度计- 10mL移液管- 50mL容量瓶- 100mL容量瓶- 烧杯- 玻璃棒- 酸式滴定管- pH计- 电子天平2. 试剂:- 苯酚标准溶液(0.1mg/mL)- 硫酸- 氢氧化钠- 水为二次蒸馏水四、实验步骤1. 标准曲线的绘制:1.1 准备标准溶液:准确移取0.1mg/mL苯酚标准溶液1.0、2.0、3.0、4.0、5.0mL于50mL容量瓶中,用二次蒸馏水定容至刻度,摇匀。
1.2 吸取各标准溶液2.0mL于10mL容量瓶中,用二次蒸馏水定容至刻度,摇匀。
1.3 在紫外可见分光光度计上,选择波长为270nm,以二次蒸馏水为参比溶液,测定各标准溶液的吸光度。
1.4 以苯酚浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:2.1 准确移取待测苯酚溶液2.0mL于10mL容量瓶中,用二次蒸馏水定容至刻度,摇匀。
2.2 在紫外可见分光光度计上,选择波长为270nm,以二次蒸馏水为参比溶液,测定样品溶液的吸光度。
2.3 根据标准曲线,计算样品溶液中苯酚的浓度。
3. 结果分析:3.1 计算样品溶液中苯酚的浓度,并与理论值进行比较。
3.2 分析实验误差,讨论实验过程中可能存在的问题。
五、实验结果与分析1. 标准曲线的绘制:通过绘制标准曲线,可以得出苯酚溶液的浓度与吸光度之间的关系。
高三专题复习教案:苯酚
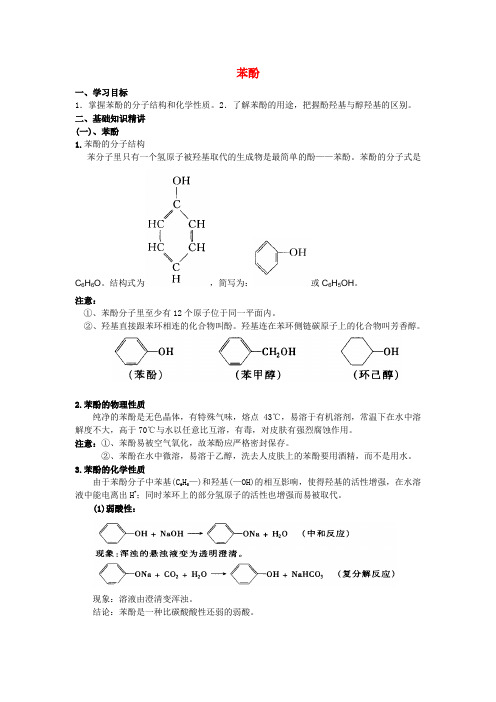
苯酚一、学习目标1.掌握苯酚的分子结构和化学性质。
2.了解苯酚的用途,把握酚羟基与醇羟基的区别。
二、基础知识精讲(一)、苯酚1.苯酚的分子结构苯分子里只有一个氢原子被羟基取代的生成物是最简单的酚——苯酚。
苯酚的分子式是C6H6O。
结构式为,简写为:或C6H5OH。
注意:①、苯酚分子里至少有12个原子位于同一平面内。
②、羟基直接跟苯环相连的化合物叫酚。
羟基连在苯环侧链碳原子上的化合物叫芳香醇。
2.苯酚的物理性质纯净的苯酚是无色晶体,有特殊气味,熔点43℃,易溶于有机溶剂,常温下在水中溶解度不大,高于70℃与水以任意比互溶,有毒,对皮肤有强烈腐蚀作用。
注意:①、苯酚易被空气氧化,故苯酚应严格密封保存。
②、苯酚在水中微溶,易溶于乙醇,洗去人皮肤上的苯酚要用酒精,而不是用水。
3.苯酚的化学性质由于苯酚分子中苯基(C6H5—)和羟基(—OH)的相互影响,使得羟基的活性增强,在水溶液中能电离出H+;同时苯环上的部分氢原子的活性也增强而易被取代。
(1)弱酸性:现象:溶液由澄清变浑浊。
结论:苯酚是一种比碳酸酸性还弱的弱酸。
说明:H①由于苯环对羟基产生了影响,使羟基的活性增强,在水溶液中能电离出可见苯酚具有酸性,所以苯酚又名石炭酸,但酸性极弱,不能使石蕊试液变红,其电离程度为:所以,苯酚可与碳酸钠溶液反应,且生成碳酸氢钠和苯酚钠,不与碳酸氢钠溶液反应。
而盐酸、醋酸等可与苯酚钠反应得到苯酚:②苯酚与NaOH反应生成苯酚钠和水,化学反应方程式如下:反应的实质是酚羟基的氢与氢氧化钠的氢氧根结合成了水。
③苯酚钠是一种盐,易溶于水,易电离,是强电解质,苯酚钠在水溶液中的电离方程式如下:H,说明乙醇中的羟基也具有一定的活性;但乙醇在水溶液④乙醇能与Na反应放出2中很难电离出氢离子,也不能与碱反应生成盐,由此可知,酚羟基上的H比醇羟基上的H 活泼。
(2)取代反应:说明:①苯酚与溴反应生成的是三溴苯酚白色沉淀:②OH H C 56与2Br 的反应灵敏,常用于苯酚的定性检验和定量测定。
苯酚的结构与性质

苯酚的结构与性质1.酚的概念酚是羟基与苯环直接相连而形成的化合物,最简单的酚为苯酚()。
2.苯酚的物理性质3.苯酚的化学性质(1)酚羟基的反应(弱酸性)+H2O+H3O+苯酚具有酸性,俗称石炭酸。
酸性:H2CO3>>HCO-3,苯酚不能使酸碱指示剂变色,其酸性仅表现在与金属、强碱的反应中。
与NaOH反应:+NaOH―→+H2O;与Na2CO3反应:+Na2CO3―→+NaHCO3。
(2)与溴水的取代反应苯酚滴入过量浓溴水中产生现象为:生成白色沉淀。
化学方程式:+3Br2―→↓+3HBr。
(3)显色反应:与FeCl3溶液作用显紫色。
催化剂(4)苯酚与甲醛在催化剂作用下,可发生缩聚反应,化学方程式是:n+n HCHO――→。
(5)氧化反应:易被空气氧化为粉红色。
(1)苯酚的水溶液呈酸性,说明酚羟基的活泼性大于水中羟基的活泼性(√)(2)除去苯中的苯酚,加入浓溴水再过滤(×)错因:生成的三溴苯酚溶于苯中。
(3)和含有的官能团相同,二者的化学性质相似(×)错因:二者化学性质差别很大,前者属于醇类而后者属于酚类。
(4)鉴别苯酚溶液与乙醇溶液可滴加FeCl3溶液(√)1.苯酚与苯甲醇是否属于同系物?简述理由,比较二者性质的差异。
答案不是。
苯酚和苯甲醇虽然在组成上相差一个CH2原子团,但结构并不相似,苯酚的官能团—OH直接连在苯环上,而苯甲醇的官能团—OH连在苯环侧链烷基上。
苯酚能与烧碱、FeCl3溶液、浓溴水反应而苯甲醇不能,但苯甲醇能发生催化氧化生成醛。
2.请设计简单的实验除去甲苯中的少量苯酚。
答案加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液。
3.从基团之间的相互影响的角度阐述苯酚溶液显弱酸性、苯酚比苯易发生取代反应的原因。
答案①苯环对羟基的影响——显酸性即—OH上的氢原子更活泼,水溶液中电离出H+;②羟基对苯环的影响——易取代,即苯环上羟基邻、对位氢原子更活泼,易被取代。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.
CH3
B.
OH
C.
OH
OH
CH2OH
D.
E.
C 2 H5
F.
苯酚的物理性质
纯净的苯酚是 无 色 晶 体,具有 特殊 气味,暴 露在空气中因 部分氧化 显 粉红 色。
• 少量苯酚晶体加少量水现象( 浑 ) (浑 )
加苯
振荡
水浴
现象清
冷却
现象( 清 )
煤油
现象 清
• 苯酚有毒,它的溶液对皮肤有 , 强腐蚀作用 使用时应注意,如果不慎沾到皮肤上,应 立即用酒精洗涤。(为什么不用水?)
=O
注意: 在与醇相似的条件下,苯酚不能发生 酯化反应。化工原料,制酚醛树脂、医药、染 料等,稀溶液用作防腐剂和消毒剂 苯酚的用途:
小结:
酚类的危害与处理
1、酚类的危害 在我国酚类物质被列为需重点控制的水污染 物之一。若用此废水直接灌溉农田,会使农 作物枯死;口服苯酚的致死量为每千克体重 530mg. 2、含酚废水的处理
基团间的相互影响
– 苯酚性质的特点 是苯环与羟基相 互影响的结果。 –研究烃的衍生物时, 既要注意官能团的共 性 ,又要注意它与不 同基团相连而引起的 “个性”。
你想到了吗?
三、基团间的相互影响
• 结论:有机物分子中基团间是相互影响的。
• 如苯与甲苯、苯酚中苯环与取代基的活性 • 乙醇与苯酚中羟基活性
ONa OH
+CO2 +H2O
+NaHCO3
(三) 化学性质
酸性: CH3COOH
>
H2CO3 >
OH
>HCO3-来自(石 炭 酸)(石炭酸)
苯酚的酸性比碳酸还弱,但比HCO3-强。
结论:苯环影响了-OH的活性
实验:P76观察与思考实验1 实验表明,苯酚的酸性比乙醇强。
用于苯酚的检验和测定
• 苯酚和乙醇分子中都含有羟基,但 苯酚能和强碱反应显酸性,乙醇却 不能。为什么?
苯酚的用途
酚醛塑料 合成纤维 医 药
农
药
苯酚
染
料
环境消毒
洗
剂
软
膏
布置作业
P.76练习与实践
回收利用或降解处理
三、生活中的酚类和环保
(一)酚类化合物的毒害
(二)含酚类废水的处理
1、物理方法 吸附法、萃取法 活性碳 苯
2、化学方法
——沉淀、氧化
课本实验
3、微生物处理法
羟基与苯环侧链相连的化合物是芳香醇。 羟基与苯环直接相连的化合物是酚。下 A、 C、E 列属于酚类的物质是 。
OH OCH3 OH
第二单元 醇和酚
二、酚的性质和应用
。
我你 们认 吗识 ?
1.什么是酚? 分子中羟基与苯环(或其他芳环)
上的碳原子直接相连的有机化合物属于酚。 比较:羟基与芳香烃侧链上的碳原子相连,其 化合物是芳香醇。
练习:判断下列物质哪种是酚类?
思考:相同碳原子个数的芳香醇与酚类是 什么关系? (同分异构体) 2、试推导饱和一元酚的通式,并思考符 合此通式的还有什么物质? CnH2n-6O
2. 苯酚结构
分子式:
C6H6O
OH
结构简式:
或
C6H5OH
实验验证: 1、设计实验验证苯酚具有酸性 与NaOH溶液反应 PH试纸
(三)、苯酚的化学性质:
1)苯酚的酸性:(活动与探究P72)
为什 么? OH+NaOH
ONa +H2O
• 苯酚是强酸还是弱酸呢? • 课本上是怎样证明的?原理是什么? • 写出化学方程式:
产物
一溴苯 三溴苯酚
液 溴
浓溴 水
苯酚分子中的苯环受羟基 影响更易发生取代反应
交流与思考: 为什么苯和苯酚发生溴代反应的条件和 产物有很大的不同? 3)苯酚的显色反应: 实验现象 OH +Fe3+ 6 [Fe(C6H5O)6]3- +6H+ 4)加成反应——与H2加成
5)氧化反应 (易燃)
OH
O=
二、苯酚 P72活动与探究
1、苯酚的物理性质
OH
无色晶体,有特殊气味,在 空气中易被氧化而略带红色,熔 点低(40.9℃) 。常温下在水 中溶解度不大(9.3g),加热时 如不慎沾到皮 易溶(>65℃时任意比溶)于水, 肤上应立即用 易溶于乙醇等有机溶剂,密度比 酒精洗涤。 水大,有毒,有腐蚀性 。
苯酚的化学性质
• 苯环的影响使酚羟基比醇羟基活泼,表现出弱 酸性。 • 羟基的影响使苯环上的邻、对位氢原子比苯中 的氢原子活泼,苯环上更易发生取代反应。 苯酚与溴发生取代反应,生成白色的三溴苯 酚,可用于苯酚的定性定量测定。 • 苯酚还能和氯化铁反应,生成紫色溶液,同样 可以用于苯酚的检测。 • 易氧化,露置在空气中会被氧化而呈粉红色。 (苯酚能使酸性KMnO4溶液褪色吗?)
原来如此
苯酚中羟基受苯环的影响 而变得比醇羟基更活泼。
热的苯酚和钠反应吗?
OH
ONa
2
+2Na
2
+
H2
• 羟基对苯环有影响吗? • 还是让实验说话吧!
2)苯酚与浓溴水的反应——取代反应 实验活动与探究:P73
结论:-OH影响了苯环的活性
苯、苯酚与溴反应比较
反应物 苯
苯酚
反应条件 催化剂
常 温
