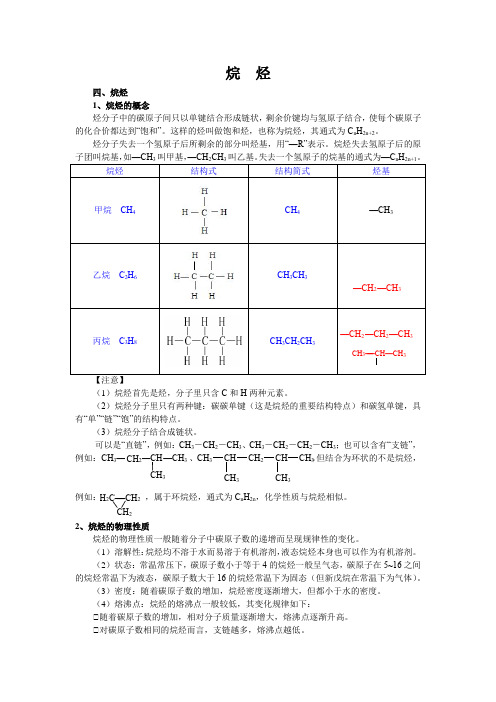
有机化学烷烃知识
有机化学烷烃

引言概述:有机化学是研究含碳化合物的学科,而烷烃是有机化合物的一类基本结构。
烷烃是由碳和氢组成的化合物,其分子中只含有单键,具有较高的化学稳定性。
本文将就有机化学烷烃进行详细介绍和解析。
正文内容:一、烷烃的基本概念和结构1.1烷烃的组成和化学式烷烃的组成是由碳和氢元素组成,化学式一般为CnH2n+2。
1.2烷烃的命名规则烷烃的命名采用系统命名法,根据碳原子数量以及碳原子之间的连接关系进行命名。
1.3烷烃的结构烷烃分子中的碳原子通过单键连接,在空间构型上呈现出直线型或者分支型。
二、烷烃的物理性质2.1烷烃的沸点和熔点烷烃的沸点和熔点与其分子量以及分子结构有关,一般来说,分子量大的烷烃具有较高的沸点和熔点。
2.2烷烃的密度烷烃的密度一般较小,随着碳原子数量的增加而增加,与分子的分子量相关。
2.3烷烃的溶解性烷烃是非极性物质,与极性溶剂的相溶性较差,但与非极性溶剂的相溶性较好。
三、烷烃的化学性质3.1烷烃的燃烧反应烷烃是可燃物质,与氧气反应水和二氧化碳,释放大量的能量。
3.2烷烃的卤代反应烷烃可以与卤素反应卤代烷烃,反应过程是由于碳卤键的形成。
3.3烷烃的氧化反应烷烃可以与氧气反应醇或醛,反应过程中碳原子与氧原子形成新的化学键。
四、烷烃的合成方法4.1烷烃的天然资源烷烃可以从天然气和石油中分离得到。
4.2烷烃的加氢反应烷烃可以通过加氢反应将烯烃或芳烃还原为烷烃。
4.3烷烃的烷基化反应烷烃可以通过烷基化反应以及其他的烷烃取代反应进行合成。
五、烷烃的应用领域5.1燃料领域烷烃是燃料的重要组成部分,主要用作石油燃料和天然气燃料。
5.2化学品领域烷烃可以作为溶剂、表面活性剂、塑料和合成橡胶的原料。
5.3药物领域烷烃与其他有机化合物结合形成药物,具有重要的药用价值。
总结:本文对有机化学烷烃的基本概念和结构、物理性质、化学性质、合成方法和应用领域进行了详细的介绍和解析。
烷烃作为有机化合物的基本结构之一,在石油工业、化工工业以及药物领域都具有广泛的应用。
有机化学—烷烃

例:用衍生命名法给下列烷烃命名
CH3CHCH2CH3 CH3
戊烷
烷烃
同分异构
同分异构的分类
构造异构
碳链异构(正丁烷和异丁烷) 官能团位置异构(1-丁烯和2-丁烯) 官能团异构(乙醇和二甲醚)
互变异构(乙酰乙酸乙酯酮式和烯醇式)
立体异构
构型异构
顺反异构(烯烃) 光学异构(旋光异构)
构象异构(烷烃,环己烷,糖类)
一、烷烃的构造异构 分子构造:分子中原子间互相连接的顺序和方式。
CH4
C2H6
C3H8
C4H10
H
HH
HHH
HHHH
H C HH C C HH C C C HH C C C C H
H 甲烷
HH 乙烷
HHH 丙烷
HHHH 丁烷
第一节 烷烃的命名
一、伯、仲、叔、季碳原子和伯、仲、叔氢原子
1 H(伯氢)
2 H(仲氢)
H3C CH2 CH2 CH3
1 C(伯碳,一级碳) 2 C (仲碳,二级碳)
➢同系列 同系差 同系物 具有同一通式,结构、性质相似,组成上相差一个或若干个CH2 的一系列化合物称为同系列。CH2称为系差,同系列中各化合物 互称为同系物。如甲烷,乙烷,丙烷等都属于烷烃系列,三者彼此 之间互称烷烃同系物。
CH4 甲烷
C2H6 乙烷
C3H7 丙烷
C4H8 丁烷
有机化学烷烃

例:
(正己烷)
(异己烷)
(新己烷)
CH3CH2CH2CH2CH2CH3
CH3CHCH2CH2CH3
CH3
CH3—C—CH2 CH3
CH3
CH3
我国现在使用的有机化合物系统命名法是参考国际纯粹和应用化学联合会(International Union of Pure and Applied Chemistry 简称IUPAC)制定的命名原则,并结合我国的文字特点于1960年制定,1980年由中国化学会加以增减修订的《有机化学命名原则》。
色散力示意图:
烷烃属于非极性分子,分子间只有微弱的色散力,在室温(25℃)和下,
烷烃的状态
C1~C4的烷烃为气态(gas); C5~C16的烷烃为液态(liquid); C17以上的烷烃为固态(solid)。
1、随着碳原子数的递增,沸点依次升高。
1.沸点(boiling point)
有机化学烷烃
分子中只含有碳(carbon)和氢(hydrogen)两种元素的有机化合物叫做碳氢化合物,简称烃。 其它有机化合物可以看作是烃的衍生物,所以烃是有机化合物的“母体”。
烃(hydrocarbon)的定义:
烃
开链烃 (脂肪烃)
例:
戊烷——系统命名
正戊烷——习惯命名
(A)从烷烃的构造式中选取最长的连 续碳链作为主链,支链作为取代基。当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多的最长碳链作为主链。根据主链所含碳原子数称为“某”烷。
系统命名的基本原则:(支链烷烃)
正确的选择是2,不是1。
例:
问:下列化合物应选择哪条主链?
CH3
正丁烷和异丁烷属于同分异构体。正丁烷和异丁烷这种同分异构体,是由于分子内原子间互相连接的顺序不同造成的(即不同构造(constitution)引起的),称为构造异构体(constitutional isomers) 。
有机化学 烷烃

3
5
2
4
3
2
1
C H
C H
C H C H
3
C H C H C H
2 2
C H C H
3
C H C H
3
C H
3
C H 3 2 , 3 , 5 - 三 甲 基 - 4 - 丙 基 庚 烷
六个碳的主链上有四个取代基
六个碳的主链上有两个取代基
主链选最长;侧链当作基;编号近侧链;基位注在前。 (6)若在主链的等距离两端同时遇到取代基且多 于两个时,则要比较第二个取代基的位次大小,依 次类推(使取代基位次之和最小)。 6 5 4 3 2 1 CH3 CH CH2 CH CH CH3
戊烷C6H14有3个构造异构体
• 戊烷可看成是正丁烷和异丁烷上的一个 H被甲基-CH3 取代的产物。
随着碳原子数的增加,异构体的数目增加很快
• • • • • •
己烷C6H14有5个构造异构体, 庚烷C7H16有9个构造异构体, 辛烷C8H18有18个构造异构体. C10H22有75个构造异构体. C13H28有802个构造异构体, C25H52有3679个构造异构体…
对简单烷基可以用普通命名法:烷变基
CH3
甲基 Methyl (Me)
CH3CH2
乙基 Ethyl (Et)
CH3CH2CH2
(正)丙基 Propyl (Pr)
CH3CHCH3
异丙基
Isopropyl (i-Pr)
CH3 CH3
CH3CH2CH2CH2— CH3CHCH2CH3 CH3CHCH2— CH3-C— CH3
3、系统命名原则 1)选主链(母体)和取代基
•选择主链 ——把构造式中连续的最长碳链作为母体
有机化学烷烃知识

CH4
+
2 O2
CO2
+ 2 H2O
低级的烷烃与一定比例空气的混合物,遇到火花时会
发生爆炸,这就是矿井瓦斯爆炸的原因
3.热裂反应
C1,C2断 裂 1 2 3 4 C2,C3断 裂 C3,C4断 裂
CH3
CH3CH2CH2CH2CH2CH3
·+ CH CH CH CH CH · CH CH · + CH CH CH CH · 2 CH CH CH ·
正丁烷各种构象的能差不大,室温下可迅速转化,正丁烷实际上是 各种构象异构体的混合物,但对位交叉式 (Anti)为优势构象,约占 70%,邻位交叉式(Gauche)约占30%,其他构象所占比例极小。
当正烷烃碳原子数增加时,尽管构象也随之更复 杂,但仍然主要以对位交叉式构象状态存在。所以直 链烷烃绝大多数是锯齿形的。如正戊烷主要以第 1 种构象形式存在,第 3 种为全重叠构象,最不稳定。
纽曼 (Newman)投影式
构象的能量分析
非键合的两原子或基团接近到相当于范氏半径之和时, 二者间以弱的引力相互作用,体系能量较低;如果接近到这 一距离以内,斥力就会急剧增大,体系能量升高。
一些原子或基团的范德华半径(pm) H C N O Cl CH3 120 150 150 140 180 200
CH3-CH
CH-CH3
CH3 CH3
2,5-甲基-3,4二乙基己烷
2,5-2甲基 3,4-2乙基己烷
2 4 5 6 1 例3 CH3-CH-CH2—CH—CH—CH3 2,5-二甲基-3-异丙基己烷 6 5 3 2 1 CH3 CH CH3 2,5-二甲基-4-异丙基己烷 CH3 CH3
CH3
有机化学 烷烃

有机化学烷烃有机化学-烷烃烷烃是有机化合物中最简单的一类化合物,它的分子结构中只包含碳和氢两种元素。
烷烃分子中碳原子通过单键连接,构成一个直链或环状的结构。
本文将从烷烃的概述、命名规则、物理性质和应用等方面进行讨论。
一、概述烷烃是一类饱和的化合物,因为碳原子与氢原子之间只有单键,它们的化学键是非极性的。
根据碳原子的排列方式,烷烃分为直链烷烃和环状烷烃两大类。
直链烷烃的碳原子按照直线排列,而环状烷烃中的碳原子形成一个或多个环状结构。
由于烷烃分子中只有碳和氢原子,它们通常具有较低的化学反应活性。
二、命名规则烷烃的命名根据碳原子数目和结构特征进行。
以直链烷烃为例,根据碳原子数目,我们可以使用以下的命名规则:1. 一碳烷烃:甲烷2. 两碳烷烃:乙烷3. 三碳烷烃:丙烷4. 四碳烷烃:丁烷5. 五碳烷烃:戊烷6. 六碳烷烃:己烷7. 十碳烷烃:癸烷对于直链烷烃,我们可以将数字代表碳原子数目的前缀与“烷”结合来命名。
例如,六个碳原子的直链烷烃称为己烷。
对于环状烷烃,我们使用环状碳原子数目加上“环”作为前缀进行命名。
例如,六个碳原子形成一个环的烷烃称为环己烷。
三、物理性质烷烃通常是无色、无臭的液体或气体,很少有固体存在。
它们的密度较小,不溶于水,而与非极性溶剂如苯和四氯化碳等相溶。
烷烃易挥发,燃烧时释放出大量的热能。
由于烷烃的碳原子之间只有单键,所以它们的沸点和熔点较低。
四、应用烷烃在日常生活和工业生产中具有广泛的应用。
以下是几个常见的应用领域:1. 燃料:烷烃是石油和天然气中最主要的成分之一。
甲烷作为天然气的主要组成部分,在家庭中用作燃料,而较长的烷烃则广泛应用于汽车燃料。
2. 溶剂:由于烷烃的非极性特性,它们被广泛用作有机溶剂。
例如,戊烷和己烷常用于清洗和溶解脂肪类物质。
3. 原料:烷烃也是许多合成化学品的重要原料,如塑料、橡胶等。
通过对烷烃的化学变化,可以获得更复杂的有机化合物。
4. 生物医学:在医学领域,烷烃有时被用作麻醉剂和药物载体。
烷烃 知识点
方法二:求出0.1mol该气态烃中含C、H的物质的量,进而求出1mol该气态烃中C、H的物质的量,从而求出分子式。
②同一个碳原子上连相同的烃基时,烃基等效,只需观察其中一个即可。例如:
—中的3个氢原子等效,只算其中一个即可;
中的三个甲基等效,只算其中一个即可;
中两个乙基等效,只算其中一个即可。
③处于镜面对称位置(相当于镜面成像时,物与像的关系)的氢原子等效。例如:
一氯取代物有4种,一氯取代物只有1种。
(2)二元取代物同分异构体数目的判断
(1)同系物的结构相似,主要指化学键类型相似,分子中各原子的结合方式相似。对烷烃而言,就是指碳原子间通过共价单键相连,其余价键全部结合氢原子。同系物结构相似,并不是相同。例如:和,前者有支链,而后者无支链,结构不相同,
但两者的碳原子均以单键结合成链状,结构相似,故互称为同系物。
(2)同系物的组成元素必相同。
例如:,属于环烷烃,通式为CnH2n,化学性质与烷烃相似。
2、烷烃的物理性质
烷烃的物理性质一般随着分子中碳原子数的递增而呈现规律性的变化。
(1)溶解性:烷烃均不溶于水而易溶于有机溶剂,液态烷烃本身也可以作为有机溶剂。
(2)状态:常温常压下,碳原子数小于等于4的烷烃一般呈气态,碳原子在5~16之间的烷烃常温下为液态,碳原子数大于16的烷烃常温下为固态(但新戊烷在常温下为气体)。
(3)同系物必符合同一通式。但符合同一通式且分子组成上相差一个或多个CH2原子团的物质不一定是同系物,例如: (乙烯)和(环丙烷)。
(4)同系物一定具有不同的分子式。
六、同分异构现象和同分异构体
1、定义:化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。具有同分异构现象的化合物互称为同分异构体。同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。
有关烷烃的知识点总结

有关烷烃的知识点总结1. 烷烃的结构和命名烷烃的结构特别简单,由碳原子和氢原子通过共价键连接而成。
碳原子的价层有四个电子,因此可以和其他碳原子或氢原子形成共价键。
而烷烃分子中的碳原子全部是sp3杂化的,它们之间的键角是109.5度,形成了正四面体结构。
在烷烃分子中,碳原子可以按连续链状结构排列,也可以形成支链式结构,这些都将影响烷烃的性质。
烷烃的命名主要遵守IUPAC命名法,其规则如下:(1)确定主链:找出分子中最长的连续碳原子链,以它为主链。
(2)编号:对主链上的碳原子进行编号,使得侧链(如果有的话)的取代基尽可能得到较小的编号。
(3)确定取代基名称和位置:标示出主链上的取代基的数量、种类和位置。
(4)编写化学式:将主链上的碳原子按编号和取代基写成一个连续的分子式。
(5)拼接名字:将这些信息组合起来,编写成一个完整的名称。
例如,对于分子结构为CH3-CH2-CH2-CH2-CH3的化合物,其主链是包含5个碳原子的链,因此它的IUPAC命名为戊烷。
2. 烷烃的物理性质烷烃是无色、无味、无毒的气体或液体,在常温下具有较低的沸点和燃点。
由于烷烃分子内只包含碳和氢原子,因此它们之间的相互作用比较弱,故容易挥发。
较长链烷烃具有较高的沸点和熔点,而较短链烷烃则具有较低的沸点和熔点。
烷烃的密度较小,几乎均小于水的密度。
值得注意的是,烷烃在空气中燃烧的时候,产生的都是无色无味的二氧化碳和水,没有任何有害的物质释放。
3. 烷烃的化学性质烷烃中的碳原子都是sp3杂化的,因此其结构比较稳定,不容易发生化学反应。
但在适当的条件下,烷烃也可以发生一些重要的化学反应。
(1)烷烃的燃烧反应:由于烷烃和氧气发生燃烧反应时释放的能量较大,因此烷烃是重要的燃料之一。
例如,甲烷和氧气在适当条件下反应会产生二氧化碳和水,并放出大量热能。
(2)烷烃的氧化反应:烷烃可以和空气中的氧气发生氧化反应,形成醇、醛、酮等化合物。
这些产物在工业生产和化工领域中都具有很重要的用途。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.5.2
烷烃的化学性质
1、稳定性
室温下烷烃与强酸、强碱、强氧化剂或强还原剂不 发生反应或反应很慢。
2、燃烧
CH3-C-CH2— CH3CH2-C—
CH3
CH3CH=CH— 丙烯基
CH2=CH-CH2— 烯丙基
新戊基
叔戊基
2 系统命名法
关键是如何确定主链和处理取代基的位置
分为三步:一选二编三配基。
1. 选母体:碳链最长,取代最多
2. 编号:位次最低(最低系列原则)
3. 配基:先小后大(优先基团后列出) 同基合并
不同类型的氢 反应活性不一样
2.2
烷烃的命名
1 普通命名法(common nomenclature),又叫习 惯命名法,适用于简单的链烃。
1. 按分子中碳原子总数叫“某烷”。≤10C 用甲、乙、丙、 丁、戊、己、庚、辛、壬、癸 表示, >10C 用十一、十二 等 中文数字表示。
2. 用“正”、“异”、“新”等字区别同分异构体。
CH3-CH2-CH3 + Cl2 CH3
光,25℃
CH3CH2CH2-Cl + CH3-CH-
Cl
1-氯丙烷(45%) 2-氯丙烷(55%)
仲氢与伯氢的活性比:
2°/1°=(55/2)÷(45/6)= 3.67/1
CH3CH2CH2CH3 + Cl2
光,25℃
仲氢比伯氢活泼
CH3CH2CH2CH2-Cl + CH3CH2CHCH3 Cl
2.5
烷烃的性质
2.5.1 烷烃的物理性质 (熔点、沸点、比重、溶解性等)
36.1℃
C1~C4 气 体C5~16 液体≥C17 固体
在同分异构体中,分支程度越高,沸点越低。因为烷 烃分子中支链的存在会影响分子间的相互靠近,减弱分子 间的引力,使沸点随之降低。 支链烷烃的熔点也比相应的直链烷烃低,但高度对称 的支链烷烃其熔点却异乎寻常的高,这是因为分子的对称 性越高,在晶体中排列越紧密。如:
2.1.2
烷烃的同分异构现象
同分异构(isomerism):分子式相同,但结构式(分 子中各原子的排列次序、结合方式或空间位置)不同
构造异构:原子间的排列顺序、结合方式不同
同 分 异 构
碳架异构 位置异构 官能团异构(包括互变异构)
立体异构:构造相同,原子在空间排布方式不同
顺反异构
构型异构
构象异构
CH4
+
2 O2
CO2
+ 2 H2O
低级的烷烃与一定比例空气的混合物,遇到火花时会
发生爆炸,这就是矿井瓦斯爆炸的原因
3.热裂反应
C1,C2断 裂 1 2 3 4 C2,C3断 裂 C3,C4断 裂
CH3
CH3CH2CH2CH2CH2CH3
·+ CH CH CH CH CH · CH CH · + CH CH CH CH · 2 CH CH CH ·
3 2 2 2 2 3 2 3 2 2 2 3 2 2
热裂后产生的游离基可以互相结合,如:
· + CH CH · CH CH CH CH CH · + CH CH CH ·
CH3
2 3 2 3 2 2 2 3 2 2
CH3CH2CH3 CH3CH2CH2CH2CH2CH2CH2CH3
也可以碳氢键断裂,产生烯烃。
2-氯丁烷得率
=
1o H的总数
2o H的总数
×
1o H相对反应活性
2o H相对反应活性
=
6
4
×
1
4
=
3
8
1-氯丁烷得率:[3/(3+8)] ×100% = 27.3% (实际为28%) 2-氯丁烷得率:[8/(3+8)] ×100% = 72.7% (实际为72%)
甲烷的氯代反应机制 反 应 机 制 ( 也 叫 反 应 历 程 , reaction mechanism) ,就是对某个化学反应逐步变化过程的 详细描述。
H CH3CH2 H CH2CH2 H CH2
·+ ·+
CH3 CH
·
CH3CH2
+
CH3CH
CH2 H
CH3 CH2 CH2
·
CH2
CH2
+
CH3 CH2 CH2
4、卤代反应
(substitution reaction)
有机化合物分子中的氢原子(或其它原子、基团)被 另一原子或基团取代的反应称为取代反应。被卤原子 取代叫卤代(halogenation)。
CH3 C2H5 C CH3 CH3
CH3CH2CH2CH2 CH CH2CH2 CH CH3
2-甲基-5-(1,1-二甲基丙基)壬烷
2.3 烷烃的结构
乙 烷 分 子 的 形 成
头碰头重叠形成C-Cσ键
构 象 的 表 示 方 法
交叉式
锯架式(透视式) 重叠式 sawhorse formula
60° 0°
在英文命名中,取代基按词首的字母排列顺序先后列出
8 例1 CH3-CH2
3 2 1 5 CH2-CH-CH2 -CH-CH2-CH3 CH2 CH3 CH3
取 代 基 位 次
3-甲基-5-乙基辛烷
读 作 : 位 连 字 符 基 名 母 体 名
例2 CH3-CH2-CH—CH-CH2-CH3
2,5-二甲基-3,4-二乙基己烷
烷 烃 卤 代 反 应 是 游 离 基 的 链 反 应 (free-radical chain reaction), 其历程分 3步进行:
① 链引发(chain-initiating step):形成自由基。 (需要光 hn或热或引发剂)
Cl:Cl
光或热
Cl· + Cl·
DH= +242.7kj·mol-1
•芳香烃基:芳香烃去掉1个H后剩下的部分。“Ar-”
•烷基:烷烃的基。
烷烃同一碳上去掉2个H或3个H后, 分别称为亚基、次 基。如:
CH2 亚甲基 CHCH3 亚乙基 —CH 次甲基 —C-CH3 次乙基
• 烃基的名称由相应的烃名确定。 •当烃分子中含有不同类型的氢时,会出现不同的烃基。
CH3 — 甲基(Me)
第2章 烷
烃
烃:只由碳和氢两种元素组成的化合物 饱和烃——烷烃 不饱和烃——烯烃、炔烃 脂环烃(环烷烃、环烯烃、环炔烃) 苯型芳香烃
脂肪烃
芳香烃
非苯型芳烃
2.1
2.1.1
烷烃的同系列及同分异构现象
烷烃的同系列
甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 烷烃的通式:CnH2n+2 同系列(homologous series):凡具有同一个通式,结构 相似,化学性质也相似,物理性质则随着碳原子数的 增加而有规律变化的化合物系列 同系物(homolog):同系列中的化合物互称为同系物 同系差:相邻两同系物之间的组成差别。烷烃同系物 的系差为CH2
227 249
306
289
乙烷的重叠式内能最高,最不稳定,而交叉 式内能最低,最为稳定。这种构象称为优势构象.
Ⅱ
Ⅲ
12.5kj/mol
其他构 象的内能则 介于交叉式
与重叠式之
间。随着乙 烷分子中两 个碳原子绕
Ⅰ
Ⅳ
单键的相对 旋转,能量 不断变化。
乙烷分子是处于交叉、重叠以及介于两者之间的无数构象的 动态平衡混合体系,但各种构象体存在的比率不同。
CH3CH2 — 乙基(Et)
CH3CH2CH2 — 正丙基(n-Pr)
CH3-CH-CH3 异丙基(iso-Pr)
CH3
CH3CH2CH2CH2— CH3CHCH2CH3 CH3CHCH2— CH3-C— CH3 丁基(n-Bu) CH3 CH3 仲丁基(sec-Bu) CH3 异丁基(iso-Bu) CH3 叔丁基(tert-Bu)
CH3-CH
CH-CH3
CH3 CH3
2,5-甲基-3,4二乙基己烷
2,5-2甲基 3,4-2乙基己烷
2 4 5 6 1 例3 CH3-CH-CH2—CH—CH—CH3 2,5-二甲基-3-异丙基己烷 6 5 3 2 1 CH3 CH CH3 2,5-二甲基-4-异丙基己烷 CH3 CH3
CH3
CH3-CH CH3
正丁烷各种构象的能差不大,室温下可迅速转化,正丁烷实际上是 各种构象异构体的混合物,但对位交叉式 (Anti)为优势构象,约占 70%,邻位交叉式(Gauche)约占30%,其他构象所占比例极小。
当正烷烃碳原子数增加时,尽管构象也随之更复 杂,但仍然主要以对位交叉式构象状态存在。所以直 链烷烃绝大多数是锯齿形的。如正戊烷主要以第 1 种构象形式存在,第 3 种为全重叠构象,最不稳定。
纽曼 (Newman)投影式
构象的能量分析
非键合的两原子或基团接近到相当于范氏半径之和时, 二者间以弱的引力相互作用,体系能量较低;如果接近到这 一距离以内,斥力就会急剧增大,体系能量升高。
一些原子或基团的范德华半径(pm) H C N O Cl CH3 120 150 150 140 180 200
(2) 丁烷的构象
Most stable (anti) and least stable (eclipsed) conformation of butane obtained by rotation about the C2—C3 bond
丁 烷 构 象 的 能 量 曲 线
