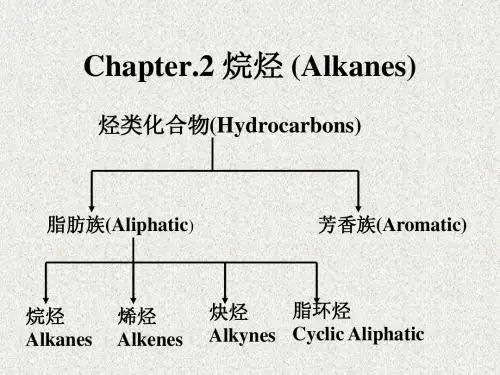
第二章 烷烃
合集下载
第二章 烷烃

顺序规则 ① 单原子取代基,按原子序数大小排列。原子序数大, 顺序大;原子次序小,顺序小;同位素中质量高的, 顺序大
I > Br > Cl > F > O > N > C > D > H
② 多原子基团第一个原子相同,则依次比较与其相连的其它原子。
CH2CH2CH3 C(C、H、H、)
<
CHCH3 CH3
CH3CH2CHCH3 CH2CH3
3
CC
C-C-C-C-C-C-C C-C-C C
1 2
主链
b. 主链编号 近取代基端开始编号,并遵守“最低 系列编号规则”
CH3 CH3 CH CH CH2 CH3 CH CH3 CH3
取代基位号 取代基位号
2,3,5 2,4,5
取代基距链两端位号相同时,编号从顺序小的基团 端开始。
CH3OH、C2H5OH、C3H7OH
二、同分异构
C4H10 丁烷 CH3CH2CH2CH3 CH3 CH3CHCH3 C5H12 戊烷
正丁烷
异丁烷
正戊烷
异戊烷
新戊烷
同分异构体:具有相同分子式的不同化合物 构造异构体:具有相同分子式,分子中原子或基团因连 接顺序不同而产生的异构体。 由碳架不同引起的异构,称碳架异构。(属构造异构) 异构体数目随碳原子增加而迅速增加 同分异构体的推导(课本17页)
4 全重叠 2,6 部分重叠 3,5 邻位交叉 1=7 对位交叉
H3CCH3
2, 4, 6 是不稳定构象,
H3CH H H 4 H H H3CH
1, 3, 5, 7 是稳定构象。
H H
能 量
H H 2
H CH3
第二章烷烃图文

少量环烃和其他衍生物。
天然气
C1~C6
20℃以下
液体石油(石油醚) C5~C6
20~60℃
汽油
C4~C8
40~200℃
煤油
C10~C16
175~275℃
柴油
C15~C20
250~400℃
润滑油
C18~C22
300℃
石蜡
C20~C30
350℃
沥青
C30以上
不挥发
第二章烷烃图文
1.烷烃的结构特征
碳原子都是 sp3 杂化 ,呈四面体结构 键角约为109.5
一构象停留时间极短(<10-6秒)不能分离。 • 乙烷交叉式构象是优势构象。
第二章烷烃图文
丁烷的构象CH3CH2-CH2CH3
CH 3 CH 3 6 0 O
H
H
HH
1
全重叠式
CH 3
H
CH 3
H
H
H
2
邻位交叉式
CH 3 H
60O
60O
H
H
CH 3 H
3 部分重叠式
CH 3
H
H 60O
CH 3
CH 3
CH3CH2CHCHCH3
CH3CH2CHCH(CH3)2
OH
CH3CH=CHCH2CH2CH(CH3)2
OH
(CH3)3CCH2CH(CH2CH3)2
CH3 CH3CCH2CHCH2CH3 第二章烷烃图文 CH3 CH2CH3
2. 烷烃的构象(Conformation)
构象:分子中的原子或基团在空间的特定 排列形式
重叠式两个H之间距离:2.29 A
氢原子半径:gH = 1.2 A
第二章 烷烃

-CH2CH2CHCH3 异戊基 i-Pent CH3 CH3 -CH2-C-CH3 新戊基 neo-Pent CH3
仲丁基 s-Bu
CH3 -C-CH2CH3 CH3
叔戊基 t-Pent
英文命名中,n(正), i(异), sec(二级), tert(三级)
烷烃分子从形式上去掉两个氢原子所剩下的基团叫做 亚烷基。
构造式 名称 构造式 名称
-CH3
甲基
Me Et
-CH2CH3
-CH2CH2CH3 CH3-CH-CH3 -CH2(CH2)2 CH3 -CH2-CH-CH3 CH3 -CH-CH2CH3 CH3
乙基
正丙基 n-Pr 异丙基 i-Pr
CH3 -C-CH3 CH3
叔丁基
t-Bu
正丁基 n-Bu 异丁基 i-Bu
2、构造异构的书写规则
先直后支、先边后心、先少后多、先简后繁
请大家书写庚烷的同分异构体
先直后支
先 简 后 繁
先边后心
先 少 后 多
三、烷烃分子中碳、氢类型
1、碳的类型
季碳 4oC 仲碳 2oC
叔碳 3oC 伯碳 1oC 2、氢的类型 根据与其相结合的碳原子, 分别称为伯、仲、叔氢。
1oH 2oH 1oC 2 oC
H H
m.p -138 C b.p
¡ ¡ -0.5 C
m.p -159 C b.p 11.7 C
¡ ¡
分子式相同,结构式不同的化合物--同分异构体;
分子式相同,结构式不同的现象--同分异构现象。
对烷烃这种同分异构是由于分子中碳原子排列方式不同引起的, 称为构造异构。
C4H10有2个异构体;C10H22有75个异构体;C20H42有366319 个异构体。 随着碳原子数增加,同分异构体迅速增加。
第2章 烷烃

20
以乙烷的重叠式构象
H
H H H H
HH HH 伞形式
锯架式
21
纽曼投影式:
H H H H H H
d. 注意:构象异构体的互相转换不需发生共价键的断裂。
分子的构象异构体有无数个,无法画出,采用 抓两头,选中间(选内能最高及最低构象), 中间选几个典型。
22
1. 乙烷构象 扭转角:
CH3
CH3CH3
CH3Cl
链终止
35
①. 具有链引发、链增长、链终止的反应在化学上叫自由 基反应(自由基链反应,连锁反应)。
②. 决定反应速度的步骤是
Cl + CH4 CH3 + HCl
链增长反应中的 夺氢过程
③. 不同卤素的反应活性
氟>氯>溴>碘 ④. 各种氢的相对反应活性 结论:叔氢>仲氢>伯氢
+ Br2
hν
CH3
CH3 C Br CH3
99.5%
2). 烷基自由基的稳定性 在自由基链反应中,决定速度步骤中的中间体是烷基自由
远,斥力最小,能量最低,最稳定。
φ= 60°300 °为顺交叉式。 C2上CH3与C3上CH3离的相对 较近,斥力相对较大,稳定性不如④。 φ= 0°为全重叠式。 C2上CH3与C3上CH3离的最近,斥力 最大,能量最高,最不稳定。 φ= 120 °240 °为部分重叠式。C2上CH3与C3上CH3离的较 近,斥力也较大,较不稳定。
16
d. 写法
( 半 取代基位置 字 线 用 ) 阿 拉 伯 数 字 , 数 字 间 用 逗 号 隔 开 位次 取代基名称 母体
相 同 的 取 代 基 合 并 起 来 , 用 一 、 二 、 三 表 示
第二章 烷烃(Alkane)

• 键 ——凡是成键电子云对键轴呈圆柱形对称的 键均称为 键.以 键相连的两个原子可以相对旋转 而不影响电子云的分布.
2.3.2 其它烷烃的结构
•乙烷的C- C 键
Stuart模型
乙烷分子中C-C键(C-H键用直线表示)
其他烷烃:据测定,除乙烷外,烷烃分子的碳链并不排 布在一条直线上,而是曲折地排布在空间。这是烷烃碳 原子的四面体结沟所决定的。如丁烷的结构:
烷烃分子中各原子之间都以σ键相连接的,所以两个碳原子 可以相对旋转,形成了不同的空间排布。实际上,在室温下 烷烃(液态)的各种不同排布方式经常不断地互相转变着。
注意:键线式书写烷烃的分子结构:
•为了方便,只要写出锯齿形骨架,用锯齿形线的 角 (120º )及其端点代表碳原子.不写出每个碳上所连的氢 原子.但其它原子必须写出.
• 乙烷可看成甲烷的一个氢原子被甲基-CH3取代;
• 丙烷可看成乙烷上的一个H被甲基-CH3取代; • 丁烷可看成丙烷的一个H被甲基 -CH3 取代:
• 同分异构体 ——由于分子式相同,但它们的构造
不同(分子中各原子相连的方式和次序不同). 又叫 构造异构体。
•它们是两种不同的化合物.物理性质一定的差异. 直链烃的沸点比带有支链的构造异构体的高(表21).
如:正丁烷的沸点:- 0.5℃,熔点:- 138.3℃, 异丁烷的沸点:- 11.7℃,熔点:- 159.4℃,
•戊烷可看成是正丁烷和异 丁 烷 上 的 一 个 H 被 甲 基CH3 取代的产物: (正戊烷 ,异戊烷,新戊烷)......
•随着碳原子数的增加,烷烃的构造异构体的数目也越 多.庚烷C7H16有9个构造异构体,辛烷C8H18有18个. •部分异构体的物理性质差异见表2-1. (3)同系物 烷烃的通式 CnH2n+2, 直链烃的通式可写为:
第二章烷烃 (Alkanes)
CH3 CH CH3 C CH3
:
X2的活性:F2 >Cl2 >Br 2>I2
反应活性高,选择性低,过度态到达早,游离基性质较少。
反应活性低,选择性高,过度态到达迟,游离基性质较多。
5. 游离基的不重排性,同位素示踪。
CH3 CH3 CH3 C D CH3
二 构象 ( Conformation): Sawhorse Model 锯木架式: Newman Projection 投影式: 透视式 Perspective
(二) 构象变化及能量图:
构象( Conformation)
重叠 ( Eclipse)
交叉 (Stagger)
邻位交叉 Gauch 四种构象稳定性次序:
Cl
CH3
Cl2
[
D Cl + CH3 C CH3 CH3 H Cl + CH3 C D CH2
CH3 C Cl CH3 CH3 CH3 C D CH2 Cl
Cl2
CH3 CH3 D Cl H Cl = CH3 C Cl CH3 CH3 C D CH2 Cl
CH3
CH3 CH CH2 CH3
新
(neo-pentyl)
(2). IUPAC Names of Alkanes 直链: Unbranched Alkanes 支链: Branched Alkanes
a. 常见的烷基: Alkyl group
{
CH3 CH CH2 CH3 CH2 CH CH3
iso-butyl sec-butyl
对位交叉 Anti
对位交叉 > 邻位交叉 > 部分重叠 > 全重叠
(三) 影响构象稳定性的因素: 1 扭转张力 ( Torsional Strain): 2 范得华斥力 3 偶极-偶极相互作用: ( Dipole-Dipole Interaction)
有机化学--第二章烷烃
重叠式构象 扭转张力大
重叠式和交叉式 构象之间的能量差 约为12.6 kJ·mol-1, 此能量差称为能垒。 其它构象的能量介 于此二者之间。
有机化学--第二章烷烃
2.3.4丁烷的构象
正丁烷可以看作是乙烷分子中每个碳原子上各有一 个氢原子被甲基取代的化合物,其构象更为复杂,我们 主要讨论沿C2和C3之间的σ键键轴旋转所形成的四种典型 构象:
仲氢 伯氢
叔氢 有机化学--第二章烷烃
2. 烷基 (alkyl group)
烷烃分子从形式上去掉一个氢原子后余下的基团称为烷
基,其通式为CnH2n+l,通常用R— 表示。最常见的烷基有:
烷基名称
烷基
中文名 英文名 缩写
烷基
中文名 英文名 缩写
CH3 CH3CH2
甲基 methyl 乙基 ethyl
Me-
仲丁基 sec-butyl s-Bu-
CH3CH2CHCH3
(s-butyl)
Et-
异丁基 isobutyl i-Bu
(C H 3 )2 C H 2 C H 2
C H 3C H 2C H 2 CH3CHCH3
正丙基 Propyl
Pr-
异丙基 isopropyl i-Pr-
(CH3)3C (C H 3)3C C H 2
6-tert-butyl-5-ethyl-2-methyldecane
有机化学--第二章烷烃
(4)如果烷烃比较复杂,在支链上还连有取代基时,可用带撇 的数字标明取代基在支链中的位次或把带有取代基的支链的 全名放在括号中。例如:
12
3
有机化学--第二章烷烃
2.3 烷烃的结构
碳原子基态时的 电子层结构为:
第二章_烷烃
CH3 CH3 600℃
C2H4 + H2
CH4 + C + H2
CH4 >1200℃ C + 2H2
CH3 CH2 CH2 CH3 500℃
CH4 + C3H6
CH3CH3 + C2H4 C4H8 + H2
• 将有害的烃类化合物转化为低毒性的醇类化合物
• 将核苷酸转化为脱氧核苷酸
• 无用的自由基对细胞毒害很大
自由基清除剂 (radical scavengers)
(对苯二酚)
(半醌)
生物体内存在的自由基清除剂
➢氧化反应
CH4 + 2O2 燃烧 CO2 + 2H2O + 891 kJ mol-1 适当条件下可部分氧化为醇、醛、酮、羧酸等含氧化合物。
如果位次和相同,则从取代基较不优先的一 端开始
• 列出取代基
根据优先基团后列出的原则 (英文按字母顺 序),在母体名称前依次列出取代基的位置、 数目、名称
3-甲基-5-乙基辛烷
7-甲基-3,3,6-三乙基癸烷
根据下面化合物的名称,画出结构式
a. 2,3-二甲基己烷 b. 2,4,5-三甲基-4-异丙基庚烷 c. 4,4-二乙基癸烷
• 反应性和选择性
• 不同卤素的反应性
F2 > Cl2 > Br2 > I2
• 不同卤素的选择性
自由基形成的相对速率
• 反应性-选择性原则
反应性越强,选择性越低
➢
➢
如果甲基环己烷与Cl2和Br2发生卤代反应, 哪个反应可以得到更多的1-卤-1-甲基环己 烷?
溴代反应
生物体中的自由基反应
不溶于水,能溶于某些低极性有机溶剂 (苯、氯仿、四氯化碳等)
有机化学课件-第二章烷烃
第 二 章 烷 烃
1.烷烃的概念和分类
烷烃的分类:按照碳链骨架可分为链烷烃和环烷烃; 链状烷烃的结构通式:
H H C H H H
H C H H C H H H
H C H H C H H C H
H H
H
H
C
H
甲烷 CH4
• •
乙烷 C2H5
丙烷 C3H8
n
CnH2n+2
含有n个碳原子的直链烷烃
卤代反应的机理: 链引发: 自由基锁链反应
Cl
H
Cl
Cl
hv
2Cl
CH3
CH3
H
Cl
链增长:
CH3
Cl Cl H3C Cl
Cl
Cl
CH3
H3C
Cl
链终止:
CH3 Cl
CH3 Cl
CH3CH3 Cl2
练习题 2.14(1)
第 二 章 烷 烃
6.烷烃的化学性质
反应过程中能量的变化: 反应物 过渡态
第 二 章 烷 烃
6.烷烃的化学性质
热裂解反应 烷烃在隔绝空气和高温条件下反应,分子中碳碳键断裂,生 成小分子的烷烃,也可转变为烯烃和氢气等复杂混合物。
600℃
CH4 CH3CH3 CH3CH2CH3
H2C C CH3 H H2C CH2
CH3CH2CH2CH3
丁烷加热至600℃反应,得甲烷、乙烷、乙烯、丙烯等
第 二 章 烷 烃
6.烷烃的化学性质
烷基自由基的相对稳定性:
H3C H3C CH H3C CH2 H3C CH H3C C CH3 CH3
CH3
第二章 烷烃(3hr)
a. 位次用阿拉伯数字表示;
b. 位次与名称之间用短横“-”隔开。
② 列出次序:
a. 不同取代基:
遵循次序规则,较大基团后列出;
b. 相同取代基: 名称合并,用汉字标明数目,位次按由 小到大次序的列出,并用“ , ”隔开。
常见烷基的大小(优先)次序:
-CH3<-CH2CH3 <-n-C3H7 <-CH(CH3)2 <-C (CH3)3
CH3
CH2CH3
CH3CH2CHCH2CHCHCH2CH2CH3
CH2CH2CH3
(2)若同时存在几个等长链,则选择 取代基最多者为主链。 例2: ① ②
CH3
CH3 CH3
③
CH3CH2CH-CH-CH-CHCH3 CH2
CH2
CH3
2、确定取代基 (给主链编号确定取代基位次) (最小原则) 编号原则:
结构特点:
碳原子为sp3杂化,呈四面体构型; 分子中C、H或C、C之间均以σ键连接;
σ
C-H
σ
C-C
σ键特点: 沿键轴方向成键,成键电子云重叠 程度高,牢度大,不易断裂;
成键原子可以绕键轴“自由”旋转。
(P 烷烃中碳原子的4种连接方式: 41)
7 1 2 6 3
CH3 CH3
8
CH3
4
伯氢(1º H):与1º C相连;
复杂支链名称作为一个整体放在括号 内,括号外标注其在主链的位次。
例:
1 2
CH3
3 4 5 6 7 8 9
10
CH3CH2CHCH2CHCH2CH2CH2CH2CH3 CH3
1'
C CH2CH3
2' 3'
CH3
3-甲基-5-(1,1-二甲基丙基)癸烷
b. 位次与名称之间用短横“-”隔开。
② 列出次序:
a. 不同取代基:
遵循次序规则,较大基团后列出;
b. 相同取代基: 名称合并,用汉字标明数目,位次按由 小到大次序的列出,并用“ , ”隔开。
常见烷基的大小(优先)次序:
-CH3<-CH2CH3 <-n-C3H7 <-CH(CH3)2 <-C (CH3)3
CH3
CH2CH3
CH3CH2CHCH2CHCHCH2CH2CH3
CH2CH2CH3
(2)若同时存在几个等长链,则选择 取代基最多者为主链。 例2: ① ②
CH3
CH3 CH3
③
CH3CH2CH-CH-CH-CHCH3 CH2
CH2
CH3
2、确定取代基 (给主链编号确定取代基位次) (最小原则) 编号原则:
结构特点:
碳原子为sp3杂化,呈四面体构型; 分子中C、H或C、C之间均以σ键连接;
σ
C-H
σ
C-C
σ键特点: 沿键轴方向成键,成键电子云重叠 程度高,牢度大,不易断裂;
成键原子可以绕键轴“自由”旋转。
(P 烷烃中碳原子的4种连接方式: 41)
7 1 2 6 3
CH3 CH3
8
CH3
4
伯氢(1º H):与1º C相连;
复杂支链名称作为一个整体放在括号 内,括号外标注其在主链的位次。
例:
1 2
CH3
3 4 5 6 7 8 9
10
CH3CH2CHCH2CHCH2CH2CH2CH2CH3 CH3
1'
C CH2CH3
2' 3'
CH3
3-甲基-5-(1,1-二甲基丙基)癸烷
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
则”(见第二章第一节)所定的“较优”基团列在后面。几种烃基的优先次
序为
(CH3)3C — > (CH3)2CH — > CH3CH2CH2 — > CH3CH2 — > CH3 — (“>”表示优先于)。例如,甲基与乙基相比,则乙基为较优基团。因此
乙基应排在甲基之后;丙基与异丙基相比,异丙基为较优基团,应排在丙
异构体。
丁烷可以看作是乙烷分子中的两个碳原子各有一个氢原子被一个甲基
取代后的产物,当绕C2-C3 σ键旋转 360°时,每旋转 60°可以得到一种有
代表性的构象。如图 1-6 所示:
CHC3H3
转 60。 H
CH3 CH3
H H
HH
(Ⅰ)全重叠式
H
H
H
(Ⅱ)邻位交叉式
CHH3
转 60。
转 60。
H H
的一系列化合物。同系列中的各个化合物互为同系物。相邻同系物之间的 差CH2叫做同系差。同系列是有机化学中的普遍现象,同系列中各个同系 物(特别是高级同系物)具有相似的结构和性质
CH3 CH2 CH3
两端任一氢被甲基取代
CH3 CH2 CH2 CH3
正丁烷 ( b.p. -0.5℃)
中间任一氢被甲基取代
CH3 CH3 CH CH3
异丁烷 (b.p. –10.2℃)
很明显,这两种丁烷结构上的差异是由于分子中碳原子连接方式不同
而产生的,我们把分子式相同而构造式不同所产生的同分异构现象叫做构
造异构;这种由于碳链的构造不同而产生的同分异构现象又称做碳链异
构。同理,由丁烷的两种同分异构体可以衍生出三种戊烷:
氢原子则按其与一级、二级或三级碳原子相连而分别称为第一、第二、 第三氢原子或称为伯、仲、叔氢原子。不同类型的氢原子的活泼性不同。 2.2、烷烃的命名
烷烃常用的命名法有普通命名法和系统命名法两种。 2.2.1 普通命名法(习惯命名法)
一般只适用于简单、含碳较少的烷烃,基本原则是: (1)根据分子中碳原子的数目称“某烷”。碳原子数在十以内时,用天 干字甲、乙、丙、丁、戊、已、庚、辛、壬、癸表示;碳原子数在十个以 上时,则以十一、十二、十三、……表示。例如:
基之后。
CH3 CH CH2 CH3
CH CH2 CH2CH3
CH3
CH3CH2CH2_ CH
CH3 CH
CH2 CH CH2CH2CH2CH3 CH2
CH3
CH2
CH3
2-甲基-4-乙基己烷
6-丙基-4-异丙基癸烷
5. 当主链上有几个取代基,并有几种编号的可能时,应当选取取代
基具有“最低系列”的那种编号。所谓“最低系列”指的是碳链以不同方
CH3CH2CH2CH2CH3 正戊烷
CH3CHCH2CH3
CH3 异戊2 烷
CH3 C CH3 CH3
新戊烷
2.2.2 烷基的命名
烷烃分子中去掉一个氢原子形成的一价基团叫烷基。烷基的名称由相
应的烷烃命名。常见烷基如下:
CH3— CH3CH2— CH3CH2CH2— (CH3)2CH—
甲基 乙基
丙基
C H3 C H2 C H2 C H2 C H3
C H3 C H3 C H C H2 C H3
C H3 C H3 C C H3
C H3
正戊烷(b.p. 36.1℃)
异戊烷(b.p. 28℃)
新戊烷(b.p. 9.5℃)
随着分子中碳原子数的增加,碳原子间就有更多的连接方式,异构体
1
的数目明显增加,己烷有五个同分异构体,庚烷有 9 个,辛烷有 18 个,而
CH3CH2CH2CH2CH3 戊烷
CH3(CH2)10CH3 十二烷
(2)为了区别异构体,直链烷烃称“正”某烷;在链端第二个碳原子上
连有一个甲基且无其它支链的烷烃,称“异”某烷;在链端第二个碳原子
上连有两个甲基且无其它支链的烷烃,称“新”某烷。例如:戊烷的三种
异构体,分别称为正戊烷、异戊烷、新戊烷。 CH3
交叉式构象和重叠式构象。交叉式构象两个碳原子上的氢原子距离最远,
相互间斥力最小,因而内能最低,稳定性也最大,这种构象称为优势构象。 在重叠式构象中, 两个碳原子上的氢原子两两相对,相互间斥力最大,内
5
能最高,也最不稳定。其它构象内能介于二者之间。 表示构象可以用透视式或纽曼(Newman)投影式。
1.氧化与燃烧 烷烃在空气中完全燃烧时,生成二氧化碳和水,并放出大量的热,烷烃主 要用做燃料。
CH4 + O2
CO2+ 2H2O + 890 kJ mo-l1
Cn H2n+2 +
3n+1 2
O2
n7CO2 + (n+1)H2O + 热能
2.热裂反应
烷烃在隔绝空气的条件下进行的分解叫热裂反应。
烷烃的热裂是一个复杂的反应。烷烃热裂可生成小分子烃,也可脱氢
向编号,得到两种或两种以上的不同编号的系列,则逐次比较各系列的不
同位次,最先遇到的位次最小者,定为“最低系列”。例如:
CH3
6
5
CH3
( 1)
CH
( 2)
4
(C3H) 2
3
(4C)H
2
C
( 5)
1
(C6H) 3
CH3
CH3 CH3
2,2,3,5-四甲基己烷 上述化合物有两种编号方法,从右向左编号,取代基的位次为 2,2, 3,5;从左向右编号,取代基的位次为 2,4,5,5。逐个比较每个取代基 的位次,第一个均为 2,第二个取代基编号分别为 2 和 4,因此应该从右向 左编号。又如:
面体结构,碳原子位于正四面体中心,四个氢原子位于正四面体的四个顶 点。四个碳氢键的键长都为 0.109nm,键能为 414.9kJ•mol-1 ,所有H-C-H 的键角都是 109.5o。甲烷分子的正四面体结构见图。
H
HC
H
H
从碳原子的杂化轨道理论也可以理解甲烷分子的正四面体结构。在形 成甲烷分子时,四个氢原子的轨道沿着碳原子的四个杂化轨道的对称轴方 向接近,实现最大程度的重叠,形成四个等同的 C-Hσ键。 乙烷分子中的碳原子也是以sp3杂化的。两个碳原子各以一个sp3轨道重叠形 成C-C σ键,两个碳原子又各以三个sp3杂化轨道分别与氢原子的 1s轨道重 叠形成六个等同的C-H σ键。 2.4 烷烃的构象
3.卤代反应 烷烃在紫外光、热或催化剂的作用下,氢原子被卤素所取代的反应。 CH4 +X2 —–—–→ CH3X (X= F、Cl、Br、I) 此反应不能停留在一氯代阶段,随着CH3X浓度的加大,它可以继续氯
代下去。如 CH3Cl+Cl2 —–—–→ CH2Cl2 +HCl CH2Cl2+Cl2—–—–→ CHCl3 +HCl CHCl3+Cl2 —–—–→ CCl4 +HCl
在常温下,乙烷分子中的两个甲基并不是固定在一定位置上,而是可
以绕 C-Cσ键自由旋转,在旋转中形成许多不同的空间排列形式。这种由
于绕单键旋转而产生的分子中的原子或基团在空间的不同排列方式,叫做 构象(conformation),同一分子的不同构象称为构象异构体。
乙烷分子可以有无数种构象,但从能量的观点看只有两种极限式构象:
CHH3
(Ⅲ)部分重叠式
CH3
H
H 转 60。
CHH3
H
H
CH3
H3HC
HH
转 60。 CH3 H
CH3 H
H H
(Ⅳ)对位交叉式 (Ⅴ)部分重叠式
(Ⅵ)邻位交叉式
6
在上述六种构象中,II 与 VI 相同,III 与 V 相同,所以实际上有代表 性的构象为 I、 II、 III、IV 四种。它们分别叫做全重叠式、邻位交叉 式、部分重叠式、对位交叉式。丁烷几种构象的内能高低顺序为:全重叠 式>部分重叠式>邻位交叉式>对位交叉式。对位交叉式是优势构象式。
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
HH
H
H
HH
透视式
投影式
透视式
投影式
(a)交叉式构象
(b)重叠式构象
交叉式与重叠式的构象虽然内能不同,但差别较小,约为 12.5kJ•
mol-1。因此,在室温时可以把乙烷看做交叉式与重叠式以及介于二者之间
的无数种构象异构体的平衡混合物。
由于各种构象在室温下能迅速转化,因而不能分离出乙烷的某一构象
C6 H 3 5C H 2 4C H 2 3C H C2 H 2 C1 H 3 CH3
3-甲基丁烷 3. 如果含有几个相同的取代基时,要把它们合并起来。取代基的数目
3
用二、三、四……表示,写在取代基的前面,其位次必须逐个注明,位次 的数字之间要用逗号隔开。例如:
CH3 CH3
CH3 CH2 CH2 CH C CH3 4. 如果含有几个不同取代CH基3 时,取代基排2列,的2,顺3序-三,甲是基将己“烷次序规
烷烃的沸点上升比较有规则,每增加一个CH2基,上升 20-30℃,越 到高级系列上升越慢。在相同碳原子数的烷烃中,直链的沸点比带支链 的高,这是由于在液态下,直链的烃分子易于相互接近,而有侧链的烃 分子空间阻碍较大,不易靠近。
3.比重、溶解度、折光率 (略) 2.6.烷烃的化学性质
烷烃的化学性质很不活泼。在常温下,烷烃与强酸、强碱、强氧化剂、 强还原剂等都不易起反应,所以烷烃在有机反应中常用来作溶剂。
_1 _ CH3CH2CH2 CH _ CH2CH3
CH CH3 CH3
