二氧化硫的制备与性质
SO2的制备 SO2、CO2的鉴别与除杂

二氧化硫与二氧化碳的比较二氧化硫与二氧化碳都是重要的非金属氧化物,二者有许多相似和不同的地方。
在通常情况下,都是无色气体,都能溶于水,但SO2的溶解度更大一些。
SO2有毒、有刺激性气味,CO2无毒、无味。
SO2是一种环境污染物,能导致酸雨的形成,CO2的排放也能导致温室效应。
一、SO2和CO2的实验室制备(1)反应原理:实验室可用亚硫酸钠固体与较浓的硫酸反应制取二氧化硫气体。
实验室用大理石或石灰石与稀盐酸反应制取二氧化碳气体。
Na2SO3+H2SO4 = SO2↑+Na2SO4+H2OCaCO3+2HCl = CO2↑+CaCl2+H2O(2)实验装置:两种气体都是用固体和液体反应制取,都不需要加热。
所以都可用“固体+液体→气体”的发生装置。
两者都能溶于水,不适合用排水法收集。
密度都比空气大,均可用瓶口向上的排空气法收集。
不同的是SO2有毒,所以必须有尾气处理装置,一般用NaOH溶液吸收多余的SO2,防止其污染环境。
而 CO2无毒,不需要尾气处理装置。
SO2很容易溶解于NaOH溶液,还需要考虑防倒吸的问题。
二氧化硫有漂白性,一般用品红溶液检验,溶液会褪色。
二氧化碳一般用澄清石灰水检验。
要注意的是,二氧化硫也可能使澄清石灰水变浑浊,不过由于二氧化硫溶解度较大,而石灰水的浓度较小,实际检验中二氧化硫很容易过量,往往不会产生浑浊,而且二氧化硫很容易用漂白性区别,所以仍然可以用澄清石灰水检验二氧化碳。
Ca(OH)2 + 2SO2 = Ca(HSO3)2二、SO2和CO2的鉴别与除杂SO2与CO2的化学性质也同样有相似和不同的地方。
它们都是酸性氧化物,都有酸性氧化物的性质:与碱反应生成盐和水,其对应的酸,亚硫酸和碳酸都是二元弱酸,都不稳定易分解。
2NaOH + SO2 = Na2SO3 + H2ONaOH + SO2 = NaHSO32NaOH + CO2 = Na2CO3 + H2ONaOH + CO2 = NaHCO3SO2 + H2O = (可逆)H2SO3CO2 + H2O = (可逆)H2CO3SO2 + CaO = CaSO3CO2 + CaO = CaCO3二者都有弱氧化性,比如:2H2S + SO2 = 3S + 2H2O2Mg + CO2 = (点燃)2MgO + C二氧化硫有强还原性、漂白性,而二氧化碳没有。
二氧化硫和二氧化氮的制备和性质研究教案

二氧化硫制备和性质研究教案三维目标知识与技能1、了解二氧化硫的实验室制法2、探究二氧化硫还原性、氧化性、酸性、漂白性的性质过程与方法1、通过探究二氧化硫的性质实验,使学生掌握科学的实验方法,培养学生的逻辑思维能力和动手能力。
2、学会鉴别、处理二氧化硫残留量过多的食品方法。
情感态度价值观1、通过对二氧化硫性质的推理过程,使学生从中体会到严谨求实的科学探究态度。
2、珍惜有限资源和环境保护意识,具有强烈的社会责任感。
3、培养学生与他人合作的协作精神。
4、让学生具有一些简单的自我保护意识。
要点提示教学重点1、对二氧化硫的性质探究2、培养学生求实协作精神教学难点1、利用探究试验推测二氧化硫的化学性质2、激发学生观察思辨的能力教学用品教学有关资料(新观察)98 %浓硫酸、无水亚硫酸钠、品红溶液、KMnO4溶液、Na2S溶液、5 % NaOH 溶液、蓝色石蕊试纸、蒸馏水、乳胶、针筒、具支试管、小试管、小烧杯等。
教学过程【提出问题】SO2是一种大气污染物,它是形成硫酸型酸雨的“罪魁祸首”,那么现在就让我们一起来探究SO2的实验室制备方法和其化学性质。
【板书】二氧化硫的制备与性质研究【演示实验】在一支具支试管中加入少量无水亚硫酸钠固定在铁架台上,分别在a、b、c、上滴1 滴蒸馏水、KMnO4溶液和Na2 S溶液;用针筒吸入2—3mL98 %浓硫酸,将针筒中的浓硫酸注入具支试管中,加热,让学生观察玻璃棒上试纸条、滤纸条,品红溶液的颜色变化,将产生多余的气体通入装有5 % NaOH 溶液的小试管中再加热已褪色的品红溶液,观察实验现象。
【实验现象板书】(1)蓝色石蕊试纸 a 变红(2)滴有KMnO4溶液的滤纸b 褪色(3)滴有Na2S 溶液的滤纸c变为黄色(4)品红溶液褪色,加热已褪色的品红溶液后溶液变红【整理联系】(1)蓝色石蕊试纸 a 变红,说明SO2的水溶液呈酸性;(2)滴有KMnO4溶液的滤纸b 褪色,说明SO2具有还原性,易被KMnO4所氧化;(3)滴有Na2S 溶液的滤纸c变为黄色,说明SO2具有氧化性,易将- 2价硫氧化为0价。
二氧化硫的制备和性质的微型实验

二氧化硫的制备和性质的微型实验作者:赵东洋来源:《中学生数理化·高一版》2017年第02期实验用品:微型实验操作台(带支杆和铁夹)、单球长管(A)、集气管(B)、多用滴管(C)、T形管(D)、导管(E)、胶皮管、带孔橡胶塞(00号)、橡胶塞(2号)、滤纸条、小烧杯、微型酒精灯、品红试纸、pH试纸,浓硫酸(约70%)、亚硫酸钠粉末、品红溶液、溴水、酸性高锰酸钾溶液、氢氧化钠溶液。
实验步骤:1.检查装置的气密性。
如图1组装连接仪器,把导管下端插入液面以下,在集氣管管口塞紧橡胶塞(2号),挤压多用滴管的吸泡,导管口出现气泡,松开不再挤压,导管内形成一段水柱,过一会儿,液面不下降,说明装置不漏气。
2.制取收集二氧化硫,试验二氧化硫的性质。
把单球长管用铁夹固定在微型实验操作台上(图1中未画出),先加入适量亚硫酸钠粉末,再用多用滴管分别从管口滴入品红溶液、溴水和酸性高锰酸钾溶液(注意:三种溶液各滴在一小片滤纸条上,各间隔一段时间滴加)。
用带有导管和集气管的橡胶塞(00号)塞紧单球长管的管口,导管下端插入盛有适量水的小烧杯中。
把吸有少量浓硫酸(约70%)的多用滴管插入单球长管的支管中(两者之间用胶皮管密封连接),挤压吸泡,逐滴滴入浓硫酸,亚硫酸钠粉末溶解。
过一会儿,滤纸条上的三种溶液都褪色,证明浓硫酸与亚硫酸钠反应有二氧化硫生成。
用酒精灯对着滤纸条部位缓缓加热,滴有品红溶液的滤纸条又恢复红色。
3.研究二氧化硫的溶解性。
将生成的气体用向上排空气法收集在集气管中。
用湿润的品红试纸在集气管管口检验气体,红色褪去,说明集气管中已经基本收集满了二氧化硫。
用橡胶塞(2号)塞紧集气管管口,继续将生成的气体向下通入水中。
当反应停止后,观察到导管内液面逐渐上升,最后几乎充满整个集气管。
用pH试纸检验溶液,溶液呈酸性。
所有剩余废液用适量氢氧化钠溶液中和处理后倒入水槽中,清洗,整理仪器。
(责任编辑王琼霞)。
二氧化硫制备及性质微型实验创新设计
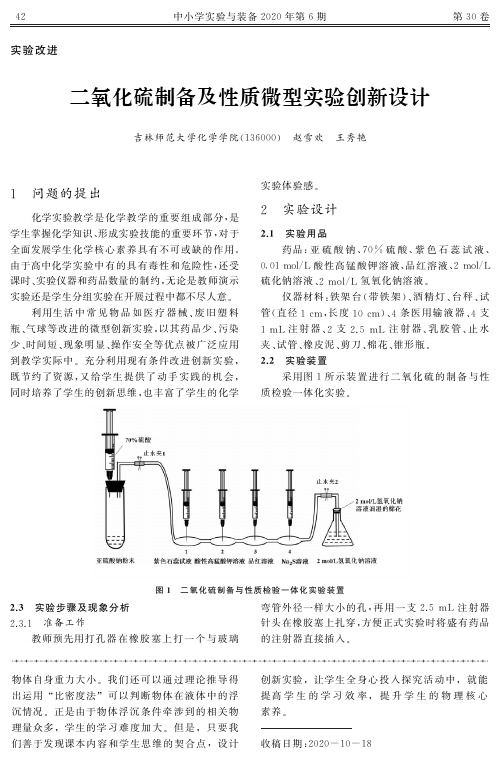
5 可反复操作,直至完全反应
4 个输液器滴壶中的反应速率很快,现象鲜明
但转瞬即逝,学生操作时可以通过两处止水夹的开
3.
2 实验药品微量化,实验现象明显化
随着实验装置的微型化,实验药品也相应实现
关控制反应的即时停止和发生,继续推动注射器内
了微量化,进一步降低了实验成本.输液器滴壶无
观察 4 个滴 壶 中 颜 色 的 变 化.微 型 微 量 化 的 设 计
5 mL 待
检验的紫色石 蕊 试 液、酸 性 高 锰 酸 钾 溶 液、品 红 溶
氢氧化钠溶液,加入右侧锥形瓶中至其容积的1/3,
NaOH 溶液浸湿 的 棉 花 团 来 密 封.其 他 药 品 暂 不
加入,
2.
5 mL 注射器在橡胶塞上不拔出,暂 时 用 来
密封小孔.按图 1 所示连接好实验装置,试管用铁
4 mL70% 硫 酸 注 入 试 管
中,启动系列实验反应.
2.
3.
4 观察现象,分析结果
依次观察编号 1、
2、
3、
4滴壶中试液颜色的变
化,填好实验记录表(见表 1).
表 1 二氧化硫性质实验现象与结论
滴壶的编号
实验现象
实验结论
1
紫色石蕊试液变红
SO2 与水反应生成亚硫酸
2
酸性高锰酸钾溶液褪色
4
既节约了资源,又 给 学 生 提 供 了 动 手 实 践 的 机 会,
同时培养了学生的创新思维,也丰富了学生的化学
2 实验设计
2.
1 实验用品
药品:亚 硫 酸 钠、
70% 硫 酸、紫 色 石 蕊 试 液、
/L 酸 性 高 锰 酸 钾 溶 液、品 红 溶 液、
二氧化硫的制备和性质

第二节二氧化硫的制备和性质教学设计【教学目标】(一)《普通高中化学标准》对于本课的要求认识二氧化硫的主要性质与作用,实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气的污染,知道硫酸型酸雨的形成原因和防治方法,培养良好的环境保护意识。
(二)三位教学目标1. 知识与技能:①认识二氧化硫的主要性质和作用;②了解二氧化硫对空气的污染知道硫酸型酸雨的形成原因和防治二氧化硫所导致的空气污染的方法;③会书写简单的化学方程式。
2. 过程与方法:①通过对二氧化硫性质的实验探究,进一步学习基本的化学实验技能,并且理解硫酸型酸雨的形成过程;②借助于生产实际和环境保护等社会热点内容,创设了促进学生改变学习方法的情景,在活动中获取知识,提高学生学以致用的意识和解决问题的能力3. 情感态度与价值观:①认识科学探究的意义,体会实验探究的过程和乐趣;②通过问题讨论和实验探究,激发勇于探索的精神,培养严谨的科学态度和合作意识;【教学重点、难点】教学重点:二氧化硫的性质与作用,建立环境保护意识。
教学难点:设计实验探究二氧化硫的性质。
【课堂导入】【实物展台】化学表演:龚喻《想当电工的粗铜》【问题设计】龚喻同学把铜冶炼出来了,这个铜和我们今天要学习的二氧化硫的制备有没有什么联系呢?在实验室中制备二氧化硫的方法有哪些?【PPT展示】一、实验室制备二氧化硫【合作学习】男同学和女同学PK赛,看谁写得多,谁写得好。
【自主学习】问题1三种制备二氧化硫的方法哪一个更好?说说你的理由?问题2:制备二氧化硫,选择20%、70%、98%的硫酸,哪一种更好?【学生回答】【小结】实验室制备气体考虑的原则①原料尽量采用非气体②反应条件加热或不加热③方便收集,所以我们采用固液不加热的方法制备气体,选用的硫酸浓度为70%左右。
【实验探究】分别把SO2通入下列溶液会有怎样的实验现象呢?【自主学习】实物展台展示学生讨论的结果【问题讨论】把SO2通入石蕊中,石蕊会先变红,然后会怎么样?会不会褪色?把SO2通入NaOH和酚酞的混合溶液中,红色褪去,是不是漂白?把SO2通入酸性高锰酸钾溶液中,红色褪去,是不是漂白?把SO2通入溴水中,橙色褪去,是不是漂白?【阅读教材】必修一P90,二氧化硫具有漂白性,它能漂白某些有色物质,二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。
二氧化硫的制备和性质-教案

第二节二氧化硫的制备和性质教学设计【教学目标】(一)《普通高中化学标准》对于本课的要求认识二氧化硫的主要性质与作用,实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气的污染,知道硫酸型酸雨的形成原因和防治方法,培养良好的环境保护意识。
(二)三位教学目标1. 知识与技能:①认识二氧化硫的主要性质和作用;②了解二氧化硫对空气的污染知道硫酸型酸雨的形成原因和防治二氧化硫所导致的空气污染的方法;③会书写简单的化学方程式。
2. 过程与方法:①通过对二氧化硫性质的实验探究,进一步学习基本的化学实验技能,并且理解硫酸型酸雨的形成过程;②借助于生产实际和环境保护等社会热点内容,创设了促进学生改变学习方法的情景,在活动中获取知识,提高学生学以致用的意识和解决问题的能力。
3. 情感态度与价值观:①认识科学探究的意义,体会实验探究的过程和乐趣;②通过问题讨论和实验探究,激发勇于探索的精神,培养严谨的科学态度和合作意识;【教学重点、难点】教学重点:二氧化硫的性质与作用,建立环境保护意识。
教学难点:设计实验探究二氧化硫的性质。
【课堂导入】【实物展台】化学表演:龚喻《想当电工的粗铜》【问题设计】龚喻同学把铜冶炼出来了,这个铜和我们今天要学习的二氧化硫的制备有没有什么联系呢?在实验室中制备二氧化硫的方法有哪些?【PPT展示】一、实验室制备二氧化硫【合作学习】男同学和女同学PK赛,看谁写得多,谁写得好。
【自主学习】问题1:三种制备二氧化硫的方法哪一个更好?说说你的理由?问题2:制备二氧化硫,选择20%、70%、98%的硫酸,哪一种更好?【学生回答】【小结】实验室制备气体考虑的原则①原料尽量采用非气体②反应条件加热或不加热③方便收集,所以我们采用固液不加热的方法制备气体,选用的硫酸浓度为70%左右。
【实验探究】分别把SO2通入下列溶液会有怎样的实验现象呢?【自主学习】实物展台展示学生讨论的结果【问题讨论】把SO2通入石蕊中,石蕊会先变红,然后会怎么样?会不会褪色?把SO2通入NaOH和酚酞的混合溶液中,红色褪去,是不是漂白?把SO2通入酸性高锰酸钾溶液中,红色褪去,是不是漂白?把SO2通入溴水中,橙色褪去,是不是漂白?【阅读教材】必修一P90,二氧化硫具有漂白性,它能漂白某些有色物质,二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。
高二第二节二氧化硫教案教案(精选3篇)

高二第二节二氧化硫教案教案(精选3篇)教案1:教学目标:1. 了解二氧化硫的化学性质和物理性质。
2. 掌握二氧化硫的制备方法。
3. 了解二氧化硫的应用。
4. 培养学生的实验操作能力和观察、分析能力。
教学重点:1. 二氧化硫的化学性质和物理性质。
2. 二氧化硫的制备方法。
教学难点:1. 二氧化硫的应用。
2. 实验操作能力和观察、分析能力的培养。
教学准备:实验器材和试剂:硫磺、酒精灯、干燥管、烧杯、试管、试纸等。
课件、图书资料等。
教学过程:Step 1:导入(5分钟)1. 引入二氧化硫的相关知识,引发学生对二氧化硫的兴趣。
Step 2:学习二氧化硫的化学性质和物理性质(15分钟)1. 呈现课件,介绍二氧化硫的化学性质和物理性质。
2. 学生根据课件内容进行讨论,解答相关问题。
Step 3:了解二氧化硫的制备方法(15分钟)1. 呈现课件,介绍二氧化硫的制备方法。
2. 学生根据课件内容进行讨论,解答相关问题。
Step 4:了解二氧化硫的应用(15分钟)1. 呈现课件,介绍二氧化硫的应用。
2. 学生根据课件内容进行讨论,解答相关问题。
Step 5:实验操作(30分钟)1. 学生分组进行实验操作,制备二氧化硫,并且观察实验现象和结果。
2. 学生根据实验结果,总结制备二氧化硫的方法,并且探讨其原因。
Step 6:总结与展示(10分钟)1. 学生将实验结果进行总结,归纳二氧化硫的制备方法和应用领域。
2. 学生组织展示,分享实验过程和结果。
Step 7:作业布置(5分钟)1. 布置二氧化硫的相关阅读作业。
教案2:教学目标:1. 了解二氧化硫的化学性质、物理性质和危害。
2. 掌握二氧化硫的制备方法和常见应用。
3. 培养学生的实验操作能力和科学分析能力。
教学重点:1. 二氧化硫的化学性质、物理性质和危害。
2. 二氧化硫的制备方法和常见应用。
教学难点:1. 二氧化硫的应用。
2. 实验操作能力和科学分析能力的培养。
教学准备:实验器材和试剂:硫磺、烧杯、试管、试纸等。
二氧化硫的制取与性质的微型实验设计

实验改进二氧化硫的制取与性质的微型实验设计浙江省衢州第二中学(324000)张胜王飞浙江省衢州第一中学(324000)毛艺苏教版必修一P88页“二氧化硫的制备和性质”课程容量大、性质实验多,是学生学习的重点和难点。
二氧化硫是一种有刺激性气味、有毒、污染空气的气体,应尽量避免在高中课堂现场大量制备。
而教材中逐一验证二氧化硫的性质实验过程繁琐,浪费药品,耗时长,不利于本节课的知识展开。
査阅了相关的教学案例,实验所需的二氧化硫气体要么提前由实验室制备,要么教师在课堂现场制备。
前者在观察二氧化硫的物理性质后,基本用二氧化硫的水溶液代替二氧化硫气体进行其化学性质探究,但二氧化硫的水溶液主要成分是亚硫酸,并且部分亚硫酸容易被空气氧化,不利于后续与氯化锁的实验检验;后者由于现场制备会产生大量有毒有害的二氧化硫气体,对学生和教师身心不利。
如果每个班都自制,污染和药品浪费会放大,而且大量时间浪费在搭建组装实验上,不利于当前的教学。
为了简化教学实验,结合当前课堂实际,设计如下实验。
1实验用品实验材料:培养皿(直径60mm1个,直径75mm1个)、表面皿(直径70mm1个,直径80mm1个)、玻璃板(边长100mmX100mm1个)、硬质试管2支、5mL针筒(带弯针头)、空矿泉水瓶1个500mL、药匙、滤纸1张(直径10cm)、酒精灯,烧杯(50mL2个,100mL1个)、保鲜膜和橡皮筋。
实验试剂:亚硫酸钠固体、浓硫酸、酸性高猛酸钾溶液、硫化钠溶液、紫色石蕊试液、品红溶液、氢氧化钠溶液。
2实验过程与现象2.1实验室收集二氧化硫气体如图1所示,利用亚硫酸钠和浓硫酸反应制备干燥的二氧化硫气体,实验原理为:Na2SO3+ H2SO4(浓)—Na2SO4+SO?水+巴0。
此实验反应快,实验用分液漏斗控制反应速率,但大量使用浓硫酸的危险性高,尤其针对多班连续上课的教师,对身体健康危害较大且要多次搭建组装实验装置。
图1实验室制取二氧化硫装置在实验室通风橱中利用图1装置制取二氧化硫干燥气体,准备好干燥洁净的500mL空矿泉水塑料瓶和30mL大试管,分别收集,并用湿润的pH试纸验满,验满后矿泉水瓶用盖子盖紧,大试管用保鲜膜和橡皮筋包扎严实,如图2所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4 实验操作
1)组装仪器
收集装置
发生装置
2)向锥形瓶中加入一定量的Na2SO3晶体;
3)分别将蘸有石蕊试液、 H2S的棉花团、 KMnO4的棉花团放到硬质玻璃管中。
4)打开分液漏斗活塞,向锥形瓶中注入 浓H2SO4,发生反应:
二氧化硫的制备与性质
讲师:孔伟炎
1 二氧化硫的来源:
1)天然产生:火山爆发、森林火灾、有 机体分解等等。 2)人类活动:化石燃料的燃烧,工业尾 气等等。 3)化学方法:
S+O2 点燃 SO2
硫粉
2 实验目的
1)了解二氧化硫的制法; 2)认识二氧化硫的主要化学性质。
3 实验仪器与药品ቤተ መጻሕፍቲ ባይዱ
仪器:锥形瓶、分液漏斗、弯导管、硬 质玻璃管、广口烧杯
Na2SO3 + H2SO4(浓)= Na2SO4 + H2O + SO2↑
5 实验现象
1)可观察到锥形瓶中产生大量气泡 请问:气泡代表有什么物质产生?
2)蘸有石蕊试液的棉花团变红
H2O + SO2 = H2SO3 (石蕊试液遇酸变红)
3)蘸有H2S的棉花团变黄
SO2 + 2H2S = 3S↓+ 2H2O
4)蘸有KMnO4的棉花团变白
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
6、结论
SO2具有酸性、氧化性、还原性
