化学元素的一些特殊性质
元素周期表中的稀有元素与放射性元素

元素周期表中的稀有元素与放射性元素元素周期表是化学领域中的一张重要图表,它将所有已知的化学元素按照原子序数和化学性质进行了分类和排列。
在这张表中,我们可以看到一些特殊的元素,如稀有元素和放射性元素。
本文将探讨这些元素的特性和应用。
稀有元素是指元素周期表中的18号族元素,也被称为稀有气体。
这些元素包括氦、氖、氩、氪、氙和氡。
它们在自然界中以单质的形式存在,具有稳定的电子结构和低反应性。
稀有气体在工业和科学领域有着广泛的应用。
例如,氦广泛用于气球和激光技术中,氖被用于霓虹灯和激光器,氩被用于气体保护焊和充电灯,氪和氙则被用于光学薄膜和激光器。
此外,稀有气体还被用于气象学研究、核磁共振成像和医学诊断。
除了稀有元素,元素周期表中还有一些放射性元素。
放射性元素是指具有放射性衰变性质的元素,它们的原子核不稳定,会自发地发射出粒子或电磁辐射以达到更稳定的状态。
放射性元素包括镭、铀、钚等。
放射性元素的放射性衰变可以用于放射治疗和核能发电。
例如,镭曾被用于治疗癌症,铀被用于核武器和核电站,钚则被用于核燃料和核爆炸装置。
然而,放射性元素也带来了一定的危险性。
放射性辐射对人体和环境都具有一定的伤害。
因此,在使用和处理放射性元素时,必须采取严格的安全措施。
核电站和核设施需要严格的安全监管,以防止辐射泄漏和核事故发生。
此外,核废料的处理和储存也是一个全球性的难题,需要找到安全可靠的方法来处理这些高放射性废料。
除了稀有元素和放射性元素,元素周期表中还有其他许多有趣的元素。
例如,金属铁是地球上最常见的元素之一,它在建筑、制造和能源领域有着广泛的应用。
碳是生命的基础,它存在于有机物中,如葡萄糖、脂肪和蛋白质。
硅是半导体材料,被广泛应用于电子器件和太阳能电池。
元素周期表中的每一个元素都有其独特的性质和应用。
通过研究这些元素,我们可以更好地理解物质的本质和化学反应的规律。
同时,我们也需要认识到元素的应用是需要谨慎和负责任的,特别是对于稀有元素和放射性元素。
高中化学元素知识点
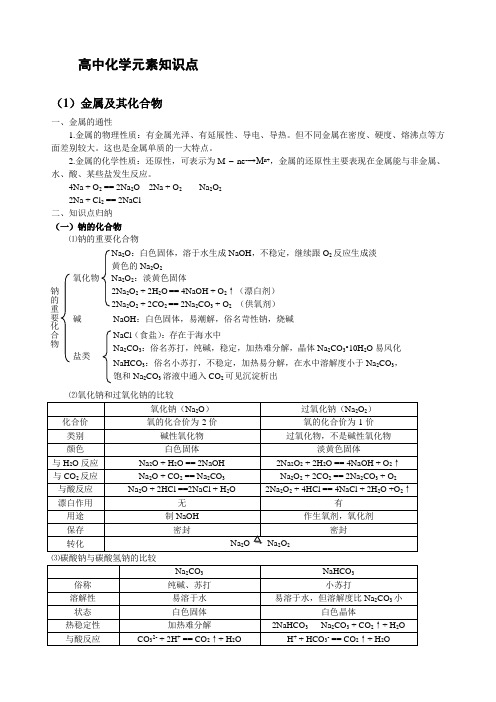
高中化学元素知识点(1)金属及其化合物一、金属的通性1.金属的物理性质:有金属光泽、有延展性、导电、导热。
但不同金属在密度、硬度、熔沸点等方面差别较大。
这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne -→M n+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O 2 == 2Na 2O 2Na + O 2 Na 2O 2 2Na + Cl 2 == 2NaCl 二、知识点归纳 (一)钠的化合物 ⑴钠的重要化合物氧化钠(Na 2O ) 过氧化钠(Na 2O 2) 化合价 氧的化合价为-2价氧的化合价为-1价 类别 碱性氧化物 过氧化物,不是碱性氧化物颜色 白色固体 淡黄色固体与H 2O 反应 Na 2O + H 2O == 2NaOH 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 与CO 2反应 Na 2O + CO 2 == Na 2CO 3 Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 与酸反应 Na 2O + 2HCl ==2NaCl + H 2O2Na 2O 2 + 4HCl == 4NaCl + 2H 2O +O 2↑漂白作用 无 有用途 制NaOH 作生氧剂,氧化剂保存 密封密封转化Na 2O → Na 2O 2Na 2CO 3 NaHCO 3 俗称 纯碱、苏打 小苏打溶解性 易溶于水 易溶于水,但溶解度比Na 2CO 3小状态 白色固体 白色晶体热稳定性 加热难分解2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O与酸反应CO 32- + 2H + == CO 2↑+ H 2OH + + HCO 3- == CO 2↑+ H 2O钠的重要化合物氧化物 Na 2O :白色固体,溶于水生成NaOH ,不稳定,继续跟O 2反应生成淡黄色的Na 2O 2Na 2O 2:淡黄色固体 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑(漂白剂) 2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 (供氧剂) 碱NaOH :白色固体,易潮解,俗名苛性钠,烧碱 盐类 NaCl (食盐):存在于海水中 Na 2CO 3:俗名苏打,纯碱,稳定,加热难分解,晶体Na 2CO 3•10H 2O 易风化NaHCO 3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na 2CO 3,饱和Na 2CO 3溶液中通入CO 2可见沉淀析出与CaCl 2反应 Ca 2+ + CO 32- == CaCO 3↓不反应与NaOH 反应 不反应HCO 3- + OH - == CO 32- + H 2O 与Ca(OH)2反应Ca2++ CO 32- == CaCO 3↓2HCO 3-(过量)+ 2OH - + Ca 2+ == CO 32- +2H 2O + CaCO 3↓相互转化CO 32- + CO 2 + H 2O == 2HCO 3- NaHCO 3 + NaOH == Na 2CO 3 + H 2O 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O(二) 铝及其重要化合物的性质⑴ 位置和原子结构示意图: 第3周期 第ⅢA 族。
元素化学及其特性

元素化学及其特性元素是构成物质的基本单位,人类对元素的研究可以追溯到古代。
随着科学技术的发展,元素化学逐渐成为一门独立的学科。
本文将介绍元素化学的基本概念和一些常见元素的特性。
一、元素的定义和分类元素是由相同类型的原子组成的物质,无法通过化学方法进一步分解。
根据元素的性质和特点,科学家将元素分为金属元素、非金属元素和过渡金属元素三类。
金属元素具有导电性、热导性和延展性等特点,例如铁、铜、锌等。
非金属元素通常不能导电,化学性质较为活泼,如氧、氮、碳等。
过渡金属元素具有特殊的物理和化学性质,如铁、铬、铜等。
二、原子结构及元素周期表元素的构成单位是原子。
原子由核和电子组成,核中包含质子和中子,电子环绕在核外。
质子和电子的数量相等,原子整体电荷为中性。
元素周期表是元素化学的重要工具。
它是根据元素的原子序数(即原子核中质子的数量)将元素排列起来,使具有相似化学性质的元素在同一竖列。
元素周期表将元素分为周期和族,周期表示元素的电子层次,族表示元素的化学性质。
三、元素的性质元素的性质包括物理性质和化学性质。
1. 物理性质物理性质是指元素在不改变其化学组成的情况下所表现出来的特性。
其中包括颜色、密度、硬度、熔点和沸点等。
例如,金属元素常常具有金黄色、高密度、较高的硬度和熔点等特点;非金属元素通常呈现无色或淡黄色、较低的密度和硬度,熔点和沸点也较低。
2. 化学性质化学性质是指元素在化学反应中与其他物质发生的变化。
元素的化学性质包括氧化性、还原性、稳定性等。
例如,金属元素常常具有较强的氧化性,可以与氧气反应生成金属氧化物;非金属元素通常具有较强的还原性,可以与氧气反应生成氧化物。
四、常见元素的特性1. 氢(H)氢是宇宙中最常见的元素之一,具有无色、无味、无毒的性质。
它是一种非常活泼的元素,在常温下与氧、氮等元素可以反应生成化合物。
2. 氧(O)氧是地球上最常见的元素之一,也是生命体系中必不可少的元素。
它是一种无色、无味、无毒的气体,在可燃物质燃烧和许多氧化反应中起着重要的作用。
常见化学元素性质 全

H 核内无中子;原子半径最小;在IA族中,但属非金属;唯一能形成裸露阳离子的非金属元素。
最外层电子数=电子总数=电子层数=周期数=主族序数。
H2为最轻的气体。
第ⅠA族中能形成共价化合物的元素;在化合物中其数目改变,质量分数变化不大;与O可生成两种液体(H2O、H2O2)。
He最外层电子数(2个)是电子层数的2倍,是最轻的稀有气体,一般不参加反应。
Li最轻的金属(密度最小的金属)。
最外层电子数=电子层数的一半(1/2)=次外层电子数的一半(1/2);次外层电子数=电子层数;周期数=主族序数的2倍。
唯一不能形成过氧化物的碱金属元素。
密保存于石蜡中。
Be相同质量情况下与酸反应放出H2最多的金属;最高价氧化物及其水化物既能与强酸反应又能与强碱反应。
最外层电子数=电子层数=次外层电子数=核外电子总数的一半(1/2);周期数=主族序数。
B最外层电子数比次外层电子数多1。
硼酸(H3BO3)可用于洗涤不小心溅在皮肤上的碱液的药品;硼砂(Na2B4O7•10H20)为制硼酸盐玻璃的材料。
C 12C作为相对原子质量的标准;气态氢化物含氢量最高;是形成化合物最多的元素;金刚石是天然矿物中最硬的物质;石墨是一种有金属光泽且能导电的混合晶体单质。
次外层电子数=电子层数=最外层电子数的一半(1/2);主族序数=周期数的2倍;最高正价=最低负价的绝对值。
CO2通入石灰水生成沉淀再消失;CO2灭火;CO2充汽水。
氧化物CO、CO2;简单氢化物CH4,正四面体结构,键角109°28′;最高价含氧酸H2CO3;N氮元素是植物所需的三大元素之一;气态氢化物水溶液呈碱性且溶解度最大;气态氢化物可以与其最高价氧化物对应水化物发生化合反应;液态时可以做致冷剂;其单质化学性质较稳定,可用于填充灯泡、储存粮食和焊接金属的保护气;HNO3为实验室中常备的三大强酸之一。
最外层电子数比次外层多3个;最高正价与负价绝对值之差为2。
氢化物NH3;氧化物形式最多(6种);含氧酸有HNO3,HNO2;气态氢化物水溶液唯一呈碱性;常见离子化合物NH4C1中含配位键;NH4+正四面体结构;HNO3与金属不产生氢气。
元素周期表中的过渡金属元素特性

元素周期表中的过渡金属元素特性元素周期表是现代化学学科的基本工具之一,它将所有已知的化学元素组织成特定的顺序。
在这个表中,过渡金属元素占据了一整个区域,包括3d系列和4d系列的元素,它们具有特殊的化学和物理性质,对于我们理解和应用元素周期表是非常重要的。
本文将重点探讨过渡金属元素的特性。
一、原子结构过渡金属元素的共同特点是它们的原子结构中有一个或多个未填满的d轨道。
这意味着过渡金属元素的电子结构在外层电子的填充上有一些特殊规律。
以铁(Fe)为例,其电子结构为1s² 2s² 2p⁶ 3s² 3p⁶ 4s²3d⁶,其中未填满的3d轨道成为其特征。
二、物理性质过渡金属元素常常具有良好的导电性和热导率。
这是由于它们的原子结构中的未填满d轨道,能够容纳更多的电子和形成更复杂的电子结构,从而增强导电性能。
此外,过渡金属元素的硬度通常较高,且具有高熔点和高密度。
这些物理性质使得过渡金属元素在工业和科学研究中有广泛的应用。
三、化学性质1. 变价性:过渡金属元素通常具有多种变价态。
由于其未填满的d轨道,过渡金属元素可以通过失去或获得d轨道中的电子来形成不同的化合物。
这种多变价性使得过渡金属元素在催化剂、电池等领域有着重要的应用。
2. 形成配合物的能力:过渡金属元素具有形成配合物的能力,这是由于它们的d轨道可以接受配体的电子对并与之形成稳定的配合物。
这种能力使得过渡金属元素在生物学、医药化学和材料科学等领域具有广泛的应用。
3. 催化活性:由于其特殊的电子结构和变价性,过渡金属元素经常作为催化剂在化学反应中发挥着重要的作用。
例如,铂(Pt)常用来催化氢气和氧气的结合以产生水,铁(Fe)则在哈伯-博什过程中用作氨的合成催化剂。
四、应用领域过渡金属元素在许多领域都有着广泛的应用。
例如,铁、钴(Co)和镍(Ni)被广泛建筑和汽车制造业用作钢铁的合金成分。
铜(Cu)是一种重要的导电金属,广泛应用于电子、电力和通信行业。
高中化学-氧族元素及其化合物的特殊性

10. 浓H2SO4是一种酸性干燥剂,一般可用于干燥中性和酸性气体,但不能干燥H2S、HBr、HI等具有还原性的酸性气体。
这是因为浓H2SO4能将其氧化。
H2SO4(浓)+ H2S === S↓ + SO2 + 2H2O、H2SO4(浓)+ 2HBr === Br2 + SO2↑ + 2H2O、H2SO4(浓)+ 2HI === I2 + SO2↑ + 2H2O11. 酸与酸之间一般不反应,但浓H2SO4和亚硫酸能分别和氢硫酸反应。
H2SO4(浓)+ H2S === S↓ + SO2↑+ 2H2O、H2SO3 + 2H2S === 3S↓ + 3H2O。
12. 酸性氧化物与酸一般不反应,但SO2与氢硫酸能够反应。
SO2 + 2H2S === 3S↓ + 2H2O13. 强酸与弱酸盐反应可以制弱酸,弱酸一般不能与强酸盐反应制强酸。
但有氢硫酸与CuSO4溶液反应可制的强酸。
CuSO4+ H2S === H2SO4 + CuS↓。
14. 在实验室用浓H2SO4与NaCl反应制取HCl,可以在强热的条件下进行反应生成Na2SO4;但用浓H2SO4与NaNO3反应制取HNO3时,却不能强热,只能微热生成NaHSO4。
H2SO4(浓)+ 2NaCl Na2SO4 + 2HCl↑H2SO4(浓)+ NaNO3NaHSO4 + HNO3↑。
15. 钡盐一般有毒,但BaSO4却无毒,可做“钡餐”。
16. 同素异形体之间的转化一般属于化学变化,如O2和O3、白磷与红磷、金刚石与石墨之间的转化等均属于化学变化;但斜方硫与单斜硫之间的转化(S8的组成及硫原子之间的化学键均未变化,只是S8分子大晶体里的排列方式不同)却属于物理变化。
、17. 活泼金属与稀H2SO4反应,一般速率很快;但活泼金属Ca、Ba与稀H2SO4反应时,由于生成CaSO4、BaSO4沉淀物附于金属表面,致使反应速率很慢。
18.在金属活动顺序表中,位于氢后面的金属与非氧化性酸一般不反应,但Cu与氢硫酸可以反应。
元素周期表中特殊元素化合价和性质的解释

特殊元素的性质及用途
物理性质
密度:元素周期表 中特殊元素的密度 与其原子量、电子 排布和晶体结构有 关。
熔点:特殊元素的 熔点与其原子量、 电子排布和晶体结 构有关。
导电性:特殊元素 的导电性与其原子 量、电子排布和晶 体结构有关。
光学性质:特殊元 素的光学性质与其 原子量、电子排布 和晶体结构有关。
汇报人:XX
特殊元素如铊、镉等对土壤和水源 的污染和破坏
对人体健康的影响
特殊元素如硒、锌等对人体健 康有重要影响
硒元素具有抗氧化、提高免疫 力等作用
锌元素对生长发育、免疫系统 等有重要作用
特殊元素摄入过量或缺乏都可 能对人体健康造成危害
周期表中特殊元素的未来发展 前景
稀有气体元素的开发利用
稀有气体元素的特性:惰性、稳定 性、低反应性
2价
硫元素:通常为-2价或 +6价,但在某些特殊 情况下可能为+4价或-
1价
钾元素:通常为+1价, 但在某些特殊情况下可能
为-1价
镁元素:通常为+2价, 但在某些特殊情况下可能
为+1价或+4价
氢元素:通常为+1价, 但在某些特殊情况下可能
为-1价
碳元素:通常为+4价或4价,但在某些特殊情况 下可能为+2价或+3价
元素周期表中特殊元素化合价 和性质的解释
汇报人:XX
周期表中特殊元素的分类 特殊元素的化合价特点 特殊元素的性质及用途 周期表中特殊元素对人类的影响 周期表中特殊元素的未来发展前景
周期表中特殊元素的分类
主族元素
定义:位于元素周期表左上角的元素,包括氢、氦、锂、铍、硼、碳、氮、氧、氟、氖等 性质:主族元素通常具有相似的化学性质,如氧化态、电负性等 化合价:主族元素通常具有稳定的化合价,如氢为+1,氧为-2等 应用:主族元素在化学工业、材料科学、生物化学等领域有着广泛的应用。
《化学元素知识》元素简介:铍

《化学元素知识》元素简介:铍大家好,我们接着来认识铍元素,铍是一种有毒的元素,会涉及医学和职业病相关方面的知识,希望大家喜欢,有什么问题可以和我交流。
铍是一种化学元素,符号为Be,原子序为4,原子量为9.012,属于碱土金属。
铍通常在宇宙射线与较重原子散裂过程中产生,是宇宙中较为稀有的元素之一。
在恒星核心内,铍会被聚变成更重的元素,几乎很少保留。
铍单质呈灰色,是一种坚硬、轻质、易碎的金属。
1. 特性①物理性质铍是一种呈灰色的坚硬金属,室温下易碎,晶体呈六方密排结构。
铍有着极高的刚性(杨氏模量为287GPa)及熔点。
铍的弹性模量大约比钢高50%,铍的密度较低,这导致铍的音速特别高,在标况下约为12.9km/s。
另外,由于铍的热容量(1925J/kg·K)和热导率(216W/m·K)都很高,铍是单位重量散热性最好的金属。
铍的线性热膨胀率(1.14×10⁻⁵K⁻¹)较低,因此铍在热负荷条件下有着特殊的稳定性。
②核物理性质除了由宇宙射线所致的痕量放射性同位素以外,天然铍几乎完全由核自旋为3/2的铍-9组成。
铍的高能中子截面较大,对能量高于10keV的中子截面约为6靶恩。
因此,铍是一种良好的中子反射体和中子减速剂,能使中子热能降至0.03eV以下。
铍对这些低能中子的截面比高能中子低至少一个数量级,其确切截面值取决于材料雏晶的纯度和大小。
铍-9会与中子能量高于1.9MeV的中子反应,产生铍-8和两个中子,铍-8又会立刻分裂成两个α粒子。
所以对于高能中子来说,铍是一种中子倍增剂,因为它释放的中子多于吸收的中子。
铍-9在吸收低能中子后,还会生成氚和氦核以及电子。
铍-9受高能α粒子撞击时也会释放中子,铍-9会与α粒子发生核反应生成碳-12和一个中子。
铍在氘核和质子的撞击下还会释放中子,所以在实验室中可用镭、钋和钚对铍进行辐射作为中子源。
大部分波长的X射线和γ射线都可以穿透铍金属,所以铍可以做X射线管等器材的窗口材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学元素的一些特殊性质
高中化学
2011-05-02 19:55
一.周期表中特殊位置的元素
①族序数等于周期数的元素H、Be、Al、Ge。
②族序数等于周期数2倍的元素C、S。
③族序数等于周期数3倍的元素O。
④周期数是族序数2倍的元素Li、Ca。
⑤周期数是族序数3倍的元素Na、Ba。
⑥最高正价与最低负价代数和为零的短周期元素C。
⑦最高正价是最低负价绝对值3倍的短周期元素S。
⑧除H外,原子半径最小的元素F。
⑨短周期中离子半径最大的元素P。
二.常见元素及其化合物的特性
①形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素C。
②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素N。
③地壳中含量最多的元素、气态氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素O。
④最轻的单质的元素H ;最轻的金属单质的元素Li 。
⑤单质在常温下呈液态的非金属元素Br ;金属元素Hg 。
⑥最高价氧化物及其对应水化物既能与强酸反应,又能与强碱反应的元素Be、Al、Zn。
⑦元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应的元素N;能起氧化还原反应的元素S。
⑧元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素S。
⑨元素的单质在常温下能与水反应放出气体的短周期元素Li、Na、F。
⑩常见的能形成同素异形体的元素C、P、O、S。
∙ (2011-04-30 20:09:45)
∙ (2011-04-30 20:04:35)
∙ (2011-04-29 09:58:50)
∙ (2011-04-07 17:33:15)
∙(2011-04-06 17:32:47)
∙ (2011-04-06 16:00:54)
∙ (2011-04-05 19:26:15)
∙ (2011-04-04 12:10:35)
∙ (2011-03-21 10:57:34)
∙ (2010-05-26 20:21:19)。
