化工原理第八章第二节讲稿
第八章 传质过程导论(化工原理)

第八章 传质过程导论第一节 概述8-1 化工生产中的传质过程均相物系的分离(提纯,回收)1.吸收2.气体的减湿3.液-液萃取4.固-液萃取(浸沥,浸取)5.结晶6.吸附(脱附)7.干燥 8精馏 目的:湿分离或混合8-2 相组成的表示法1. 质量分率和摩尔分率mm a A A =mm a B B =mm a C C =……….......+++=C B A m m m mA,B 两组分 a a -1 nn x A A =nn x B B =nn x C C =…….......+++=C B A n n n n .......1+++=C B A x x x互换 A A AA A m m a m m x ==BB B m m a x =…….∑=++=iii B B A A m a m m m a m m a n ...... ()....,,C B A i =故 ∑==iii AA A A m a m a nn xi iiAA A m xm a a ∑=2.质量比和摩尔比质量比 B A m m a /=摩尔比 B A n n X =()a a a -=1 ()x x X -=1)X X x -=13.浓度质量浓度 V m C A A = 3/m kg摩尔浓度 V n C A A = 3/m k m o l均相混合物的密度ρ即为各组分质量浓度的总和(体积与混合物相等)∑=++=iB A CC C ........ρρA V m a V m C A A A ===C x V n x V n C A A A A ===混合气体 RTp V n C A A A ==RTp MVn M Vm C AAAA A A ===气体总摩尔浓度 RTp Vn C ==摩尔分率与分压分率相等 pp nn y A A A ==气体混合物摩尔比可用分压比表示 BB A A BB A A BA Mp M p Mn M n n n Y ===第二节 扩散原理8-3 基本概念和费克定律分子扩散: 扩散速率与浓度梯度成正比 费克定律: 对双组分物系下表达为: dzdl D J A ABA -=A J —分子A 的扩散通量 s m kmol ⋅2/ 方向与浓度样应相反 AB D —比例系数 组分A 在介质B 中的扩散系数 s m /2A c —组分A 浓度,3/m kmoldz dc A —组分A 的浓度梯度 4/m kmol RTp c A A =得 dzdp RTD J AAB A -=定义A J 通过得截面是“分子对称”得,即有一个A 分子通过某一截面,就有一个B 分子反方向通过这一截面,填补原A 分子得空部位,这种分子对称面为固定时,较为简便。
化工原理课件(天大版)第八章 干燥

t 湿球温度计
天津商学院本科生课程 化工原理
12/22
§8.1 湿空气的性质及湿度图
6.绝热饱和温度tas 在与外界绝热情况下,空气 与大量水经过无限长时间接触后, 空气温度与水温相等,称这一稳 定的温度为湿空气的绝热饱和温 度,用tas表示。
tas
补充水 tas 饱和空气
tas,Has, Ias
天津商学院本科生课程 化工原理
2/22
§8 概述
传导干燥 热能通过传热壁面以传导方式传给物料,产生的湿 分蒸气被气相(又称干燥介质)带走,或用真空泵 排走。例如纸制品可以铺在热滚筒上进行干燥。 对流干燥
以干燥介质:热空气、 湿分:水为例
干 燥 法
热能以对流方式加入物料,产生的蒸气被干燥介质所带走。
cH cg cv H 1.01 1.88 H
c H f H
天津商学院本科生课程 化工原理
9/22
§8.1 湿空气的性质及湿度图
4.湿空气的焓I
kJ/kg 干气
焓----kJ/kg
I I g Iv H
cg cv H t r0 H
1.01 1.88H t 2490H
50% 为宜;室温达18℃ 时,相对湿 度应控制在30%—40% 。 7/22
pv p s H 0.622 0.622 相对湿度代表湿空气的不饱和程度。 P p s P pv
天津商学院本科生课程 化工原理
§8.1 湿空气的性质及湿度图
1kg干空 气的体积 Hkg水气 体积 H 1kg干空 气
传质、传热同时发生
本章重点讨论以空气作干燥介质,以水为湿份的对流干燥过程。
天津商学院本科生课程 化工原理
化工原理,第8-9章

第八章 传质过程导论第一节 概述8-1 化工生产中的传质过程均相物系的分离(提纯,回收)1.吸收2.气体的减湿3.液-液萃取4.固-液萃取(浸沥,浸取)5.结晶6.吸附(脱附)7.干燥 8精馏 目的:湿分离或混合8-2 相组成的表示法1. 质量分率和摩尔分率m m a A A =m ma B B = mm a C C = ………. ......+++=C B A m m m mA,B 两组分 a a -1 n n x A A =n nx B B = nn x C C = ……. ......+++=C B A n n n n .......1+++=C B A x x x互换 A A A A A m m a m m x ==BB B m ma x = ……. ∑=++=i i i B B A A m a m m m a m m a n ...... ()....,,C B A i = 故 ∑==i iiAAA A m a m a n n x iiiA A A m x m a a ∑=2.质量比和摩尔比质量比 B A m m a /=摩尔比 B A n n X =()a a a -=1 ()x x X -=1()X X x -=13.浓度质量浓度 V m C A A = 3/m kg摩尔浓度 V n C A A = 3/m k m o l均相混合物的密度ρ即为各组分质量浓度的总和(体积与混合物相等)∑=++=i B A C C C ........ρρA V ma V m C A A A ===C x V n x V n C A A A A ===混合气体 RTp V n C A A A ==RTp M V n M V m C AA A A A A ===气体总摩尔浓度 RTpV n C ==摩尔分率与分压分率相等 pp n n y AA A ==气体混合物摩尔比可用分压比表示 BB AA B B A A B A M p M p M n M n n n Y ===第二节 扩散原理8-3 基本概念和费克定律分子扩散: 扩散速率与浓度梯度成正比 费克定律: 对双组分物系下表达为: dzdl D J AABA -= A J —分子A 的扩散通量 s m kmol ⋅2/ 方向与浓度样应相反 AB D —比例系数 组分A 在介质B 中的扩散系数 s m /2A c —组分A 浓度,3/m kmoldz dc A —组分A 的浓度梯度 4/m kmol RT p c A A =得 dzdp RT D J AAB A -= 定义A J 通过得截面是“分子对称”得,即有一个A 分子通过某一截面,就有一个B 分子反方向通过这一截面,填补原A 分子得空部位,这种分子对称面为固定时,较为简便。
化工原理(第二版)第八章-

中一
(8-11)
第二节 吸收过程的相平衡关系
(3)吸收平衡线 表明吸收过程中气、液相平衡关系 的图线称吸收平衡线。在吸收操作中,通常用图来表示。
图8-2吸收平衡线
第二节 吸收过程的相平衡关系
式(8-10)是用比摩尔分数表示的气液相平衡关系。
它在坐标系中是一条经原点的曲线,称为吸收平衡线,如 图8-2(a)所示;式(8-11)在图坐标系中表示为一条经 原点、斜率为m的直线。如图8-2(b)所示。
第二节 吸收过程的相平衡关系
相平衡关系随物系的性质、温度和压力而异,通常由 实验确定。图8-1是由实验得到的SO2和NH3在水中的溶解度 曲线,也称为相平衡曲线。图中横坐标为溶质组分(SO2 、 NH3)在液相中的摩尔分数 ,纵坐标为溶质组分在气相中 的分压 。从图中可见:在相同的温度和分压条件下, 不同的溶质在同一个溶剂中的溶解度不同,溶解度很大的 气体称为易溶气体,溶解度很小的气体称为难溶气体;同 一个物系,在相同温度下,分压越高,则溶解度越大;而 分压一定,温度越低,则溶解度越大。这表明较高的分压 和较低的温度有利于吸收操作。在实际吸收操作过程中, 溶质在气相中的组成是一定的,可以借助于提高操作压力 来提高其分压 ;当吸收温度较高时,则需要
(8-6) 式中 ——溶质在气相中的平衡分压,kPa;
——溶质在溶液中的摩尔分数; ——亨利系数,其单位与压力单位一致。 式(8-6)即为亨利定律的数学表达式,它表明稀溶 液上方的溶质平衡分压 与该溶质在液相中的摩尔分数 成正比,比例系数称为亨利系数。亨利系数的数值可由实 验测得,表8-1列出了某些气体水溶液的亨利系数值。
第二节 吸收过程的相平衡关系
1
分子扩散 物质以分子运动的方式通过静止流体
第八章 - 第二讲 -传质概论-分子扩散

kg / m3
= i
对气体混合物(在总压不太高时)中A组分的质量浓度为
A
=
pAM A RT
kg / m3
三、浓度
2.摩尔浓度
指单位体积内的物质的量,对A组分
CA
=
nA V
mol / m3
c = ci
对于气体混合物(在总压不太高时),若其中组分A的分 压为PA,则可由理想气体定律计算其摩尔浓度
积分:z=z1 :PA =PA1 z=z2 :PA =PA2
NA
=
D
RT
(PA1
−
) PA2
同理:
NB
=
D
RT
(PB1
−
PB2
)
NA
=
−
D RT
PA1 z1
− −
PA2 z2
NA = −NB
净物质通量: N = N A + NB = 0
一、等分子反向扩散
注:
①液相:总浓度CM=CA+CB,则:
( ) N AL
= J AL
= D
L
CA1 − CA2
L
( ) NBL
=
J BL
=
D
L
CB1 − CB2
L
NAL = −NBL
②实际中少有等分子反向扩散,但对于二组分摩尔汽化潜 热相等的精馏过程,可视为此类型。
第一节 传质过程概述
3.质量浓度与摩尔浓度
组成 质量浓度 摩尔浓度
计算公式
Ci
=
mi V
=
M i pi RT
ci
= ni V
=
pi RT
换算公式
Ci = ai
化工原理 第八章 固体干燥.

第八章固体干燥第一节概述§8.1.1、固体去湿方法和干燥过程在化学工业,制药工业,轻工,食品工业等有关工业中,常常需要从湿固体物料中除去湿分(水或其他液体),这种操作称为”去湿”.例如:药物,食品中去湿,以防失效变质,中药冲剂,片剂,糖,咖啡等去湿(干燥) 塑料颗粒若含水超过规定,则在以后的注塑加工中会产生气泡,影响产品的品质. 其他如木材的干燥,纸的干燥.一、物料的去湿方法1、机械去湿:压榨,过滤或离心分离的方法去除湿分,能耗底,但湿分的除去不完全。
2、吸附去湿:用某种平衡水汽分压很低的干燥剂(如CaCl2,硅胶,沸石吸附剂等)与湿物料并存,使物料中水分相续经气相转入到干燥剂内。
如实验室中干燥剂中保有干物料;能耗几乎为零,且能达到较为完全的去湿程度,但干燥剂的成本高,干燥速率慢。
3、供热干燥:向物料供热以汽化其中的水分,并将产生的蒸汽排走。
干燥过程的实质是被除去的湿分从固相转移到气相中,固相为被干燥的物料,气相为干燥介质。
工业干燥操作多半是用热空气或其他高温气体作干燥介质(如过热蒸汽,烟道气)能量消耗大,所以工业生产中湿物料若含水较多则可先采用机械去湿,然后在进行供热干燥来制得合格的干品。
二、干燥操作的分类1、按操作压强来分:1)、常压干燥:多数物料的干燥采用常压干燥2)、真空干燥:适用于处理热敏性,易氯化或要求产品含湿量很低的物料2、按操作方式来分:1)、连续式:湿物料从干燥设备中连续投入,干品连续排出特点:生产能力大,产品质量均匀,热效率高和劳动条件好。
2)、间歇式:湿物料分批加入干燥设备中,干燥完毕后卸下干品再加料如烘房,适用于小批量,多品种或要求干燥时间较长的物料的干燥。
3、按供热方式来分:1)、对流干燥:使干燥介质直接与湿物料接触,介质在掠过物料表面时向物料供热,传热方式属于对流,产生的蒸汽由干燥介质带走。
如气流干燥器,流化床,喷雾干燥器。
2)、传导干燥:热能通过传热壁面以传导方式加热物料,产生的蒸汽被干燥介质带走,或是用真空泵排走(真空干燥),如烘房,滚筒干燥器。
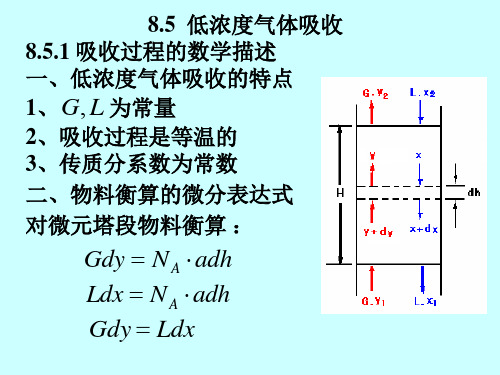
化工原理-第8章 气体吸收

8.3 扩散和单相传质
① 溶质由气相主体传递到两相界面,即气相内的物质传递;
② 溶质在相界面上的溶解,由气相转入液相,即界面上发生 的溶解过程
③ 溶质自界面被传递至液相主体,即液相内的物质传递。 通常,第②步即界面上发生的溶解过程很容易进行,其阻力很小
( 传质速率 小,
=
传质推动力 传质阻力
)故认为相界面上的溶解推动力亦很
8.1概述
①溶剂应对被分离组分(溶质)有较大的溶解度,或者说在 一定的温度与浓度下,溶质的平衡分压要低。这样,从平衡角度 来说,处理一定量混合气体所需溶剂量较少,气体中溶质的极限 残余浓度亦可降低;就过程数率而言,溶质平衡分压↓,过程推 动力大,传质数率快,所需设备尺寸小。
②溶剂对混合气体中其他组分的溶解度要小,即溶剂应具备 较高的选择性。若溶剂的选择性不高,将同时吸收混合物中的其 他组分,只能实现组分间某种程度的增浓而不能实现较为完全的 分离。
⑷工业吸收流程(见旧讲稿) 由流程图可见,采用吸收操作实现气体混合物的分离必须解决下 列问题: ①选择合适的溶剂,使能选择性比溶解某个(或某些)被分离组 分; ②提供适当的传质设备(多位填料塔,也有板式塔)以实现气液 两相的接触,使被分离组分得以从气相转移到液相(吸收)或气相 (解吸);
8.1概述
注意:此时并非没有溶质分子继续进入液相,只是任何瞬间 进入液相的溶质分子数与从液相逸出的溶质分子数恰好相等,在 宏观上过程就象是停止了。这种状态称为相际动平衡,简称相平 衡。
8.2.1平衡溶解度
⑴溶解度曲线
对 单 组 分 物 理 吸 收 的 物 系 , 根 据相律 ,自 由度数F 为F=CΦ+2=3-2+2=3(C=3,溶质A,惰性组分B,溶剂S,Φ=2,气、液两 相),即在温度 t ,总压 p ,气、液相组成共4个变量中,由3个自 变量(独立变量),另1个是它们的函数,故可将平衡时溶质在气
陈敏恒_化工原理课件_第八章(2)
新操作线与原操作线平行,
y2 , x1 , , N
讨论: x2 ,K y a 不变,而 N ,显然 ym x2 的调节限度:主要受解吸过程的限制
(3)吸收剂入塔温度的调节 原工况如图蓝线所示, 现仅 t , 操作结果如何变化? 新操作线与原操作线平行,
m ,y2 ,x1 ,η ,N
二、计算方法
H N OG H OG
由 H OG NOG L( y2 ) x1 第二类命题需要试差
mG y1 mx2 mG 1 ln 1 mG L y 2 mx2 L 1 L
三、吸收塔的操作和调节 调节方法:改变吸收剂的入口条件 L, x2 , t
返混:少量流体自身由下游返回至上游 任何形式的返混,都将降低传质推动力,对 传质不利。
例题1 课本P45,8-12 例题2 用纯溶剂吸收某混合气中有害组分,已知 ye mx ,H OG 与 m G L 为常数, 当 y1 0.09, 1 0.9 时,塔高为 H 1 当 y1 0.09, 2 0.99 时,塔高为 H 2 当 y1 0.009, 3 0.9 时,塔高为 H 3 试比较 H1 , H 2 , H 3 的大小
K y a,K x a :容积传质系数 kmol s m
3
六、传质单元数与传质单元高度
y1 dy G 令:H OG ,N OG y2 y y K ya e H H OG NOG x1 dy L 令:H OL , N OL x2 x x K xa e H H OL NOL
8.5.4 吸收塔的操作型计算 一、操作型计算的命题 (1)第一类命题 给定条件:H , L, G, x2 , y1 , y f ( x) 流动方式,K y a 或 K x a x1 计算目的: y2 ( ) , (2)第二类命题 给定条件:H , G, y1 , y2 , x2 , y f ( x) 流动方式,K y a 或 K x a 计算目的: L ,x1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/5/4
联结线的斜率<0
kA<1, yA<xA
2)分配曲线
yA f (xA ) ——分配曲线的数学表达式
2020/5/4
4、温度对相平衡关系的影响
物系的温度升高,溶质在溶剂中的溶解度加大
T1<T2<T3
温度升高,分层区面积缩小
2020/5/4
三、萃取过程在三角形相图上的表示
Em ax
kA kB
2020/5/4
β=1 , yA yB xA xB A、B两组分用萃取分离不适宜;
β>1,萃取时组分A可以在萃取相中浓集,β越大,组分A与 B萃取分离的效果越好。 2)选择性系数和分配系数的关系 kA愈大,kB愈小,选择性系数愈大 选择性系数表示萃取剂对组分A,B溶解能力差别的大小
2、萃取剂S与稀释剂B的互溶度
E
S MF F MS
F●
R R
E RF R EF
E R F
E M
E MR R ME
2020/5/4
四、萃取剂的选择
1、萃取剂的选择性和选择性系数
1)萃取剂的选择性
A在萃取相中的质量分率 B在萃取相中的质量分率
A在萃余相中的质量分率 B在萃余相中的质量分率
yA xA yLeabharlann yB yB xB xA xBB
S
F
G
2020/5/4
三角形内的任一点:一定组成的三元混合物 M点的组成为:
xA BE 0.4 xB SG 0.3 xS AK 0.3 xA xB xS 0.4 0.3 0.3 1.0
直角三角形相图
M点的横坐标表示萃取剂S的质量百分数 xS 0.3
纵坐标表示溶质A的质量百分数 xA 0.4 xB 1 xA xS 1 0.4 0.3 0.3
化学稳定性、不易聚合、分解,有阻垢的热稳定性, 抗氧化的稳定性,对设备的腐蚀性小,无毒,来源容易, 价格便宜等
2020/5/4
第八章 液液萃取
Solvent Extraction
第二节 三元体系液液相平衡
一、组成在三角形相图 上的表示方法 二、液-液平衡关系在 三角形相图上的表示法 三、萃取过程在三角形 相图上的表示 四、萃取剂的选择
2020/5/4
溶质A可溶于稀释剂B及萃取剂S中,但 萃取剂S与稀释剂B不互溶
三元物系 溶质A可溶于稀释剂B及萃取剂S中,稀 释剂B与萃取剂S也可部分互溶
4、萃取剂的其它性质
1)萃取剂的密度 萃取剂与被分离混合物应有较大的密度差 2)界面张力 界面张力较大时,有利于分层;界面张力过大,难以使两
相混合良好;
2020/5/4
界面张力较小时,两相难以分离。 首要考虑的还是满足分层的要求。 一般不选界面张力过小的萃取剂。 3)粘度 粘度小对萃取剂有利
5、一般工业要求
2020/5/4
2、杠杆法则 ——萃取物料衡算的依据
•三点共线
M点:合点
D、E:差点
•线段成比例
mD ME mE MD
mE DM mM DE mD EM mM ED
2020/5/4
●
E
●
●D
二、液-液平衡关系在三角形相图上的表示法
1、溶解度曲线与联结线(共轭线)
1)溶解度曲线
共轭相:R相和E相
联结线(共轭线):RE
单相区
F
E
M
R 两相区
2020/5/4
2)溶解度曲线的实验方法 混溶点
R3 R2 R1
J E3
M3
E2
M2
E1
M1
2020/5/4
2、辅助曲线和临界混溶点
辅助线的作法 辅助线 的作用: 求任一平衡液相的共轭相 P点:临界混熔点或褶点 —特征是什么?
P R
E C3
C2 C1
2020/5/4
组分B与S的互溶度影响溶解度曲线的形状和分层面积。
2020/5/4
Em ax
Em ax
B、S互溶度小,分层区面积大,可能得到的萃取液的最 高浓度ymax’较高。 B、S互溶度愈小,愈有利于萃取分离。
2020/5/4
3、萃取剂回收的难易
被分离体系相对挥发度α大,用蒸馏方法分离; 如果α接近1,可用反萃取,结晶分离等方法。
2020/5/4
三元混合液中有两对组分可部分互溶, 即溶质A与萃取剂S部分互溶,稀释剂B 与萃取剂S也部分互溶
一、组成在三角形相图上的表示方法
1、三元组成在三角形相图中的表示法
A
三个顶点:纯物质
三条边上的点:二 元混合物的组成 H点的组成为:
K H·
E
D
M
xA BH 0.7
xB AH 0.3
3、分配系数和分配曲线
1)分配系数
k A
组分A在E相中的组成 组分A在R相中的组成
yA xA
kB
yB xB
分配系数表达了某一组分在两个平衡液相中的分配关系。
kA值与联结线的斜率有关。
2020/5/4
联结线的斜率>0 联结线的斜率为0
kA>1,yA>xA
kA =1,yA=xA
kA值愈大,萃取分离的效果愈好。
