标准滴定溶液配制及标定原始记录 (2)
标准溶液的配置及标定方法

标准溶液的配置及标定方法1、0.1moL/L 氢氧化钠的配制及标定(1) 配制:将氢氧化钠配制成饱和溶液(约为52%),贮存于乙烯塑料瓶内,密闭放置数日,使碳酸钠沉淀。
小心吸取8.2mL上清液,加无二氧化碳的纯水稀释为1000mL。
(2)标定:准确称取0.5~0.6g于105~110℃烘干至恒重的基准邻苯二甲酸氢钾,共称三份。
分别置于250mL三角瓶内,加入不含二氧化碳的纯水使邻苯二甲酸氢钾溶解。
加2滴1%酚酞指示剂溶液,用0.1moL/L氢氧化钠溶液滴定至溶液显淡粉红色,即到终点。
同时作空白。
按下式计算氢氧化钠溶液的准确浓度:C=m×1000/(V-V)×204.22 21式中:C-----氢氧化钠溶液的浓度,moL/L;m----邻苯二甲酸氢钾质量,g;V----滴定邻苯二甲酸氢钾氢氧化钠用量,mL;1V----空白试验氢氧化钠用量,mL;2204.22--邻苯二甲酸氢钾的式量。
(3)贮存于塑料瓶中,如需要其它浓度的氢氧化钠溶液,可取浓氢氧化钠溶液照上法稀释后标定,或直接以0.1moL/L标准溶液稀释即得。
2、0.1moL/L盐酸标准溶液配制及标定(1)配制:量取9mL浓盐酸,用纯水稀释为1000mL,混匀。
此溶液的浓度为0.1moL/L。
(2)标定:准确称取0.15~0.2g于270~300℃灼烧至恒重的基准无水碳酸钠。
共称三份,分别于250mL三角烧瓶中,各加50mL纯水使之溶解,加1~2滴甲基橙指示剂,用上述盐酸滴定至溶液由黄色变为橙色。
同时作空白试验。
按下式计算HCL溶液的准确浓度:C= 2m×1000/(V-V)*M21 1式中:C-----盐酸溶液的浓度,moL/L;m---无水碳酸钠的质量,g;V---滴定碳酸钠消耗的盐酸溶液体积,mL;1V---空白试验消耗盐酸的体积,mL;2M(106.0)--碳酸钠的式量。
3、0.02moL/L乙二胺四乙酸二钠标准溶液配制及标定(1)配制:称取7.5g乙二胺四乙酸二钠(即EDTA—2Na),溶于纯水中,并稀释为1000mL,摇匀即得。
标准溶液(滴定液)管理规程

1.目的:建立一个药品分析化验室标准溶液管理规程,保证检验工作质量。
2.范围:药品分析用标准溶液。
3.责任:标准溶液配制人、复核人、中心化验室负责人。
4.内容:4.1 标准溶液的配制要求和配制前准备工作◆定义:标准溶液系指已知标准浓度的溶液,用来滴定被测物质。
●标准溶液化验室要求:应设在避光房间,室内阴凉、通风良好。
室内须空调设施,温湿度保持恒定,一般控制在20±5℃,相对湿度50-75%。
◆配制前准备工作●所有品种均有批准的试剂配制操作规程,严格执行标准操作规程。
●配制前:首先检查所领试剂的瓶签完好、包装完整、封口严密、无污染,在规定的使用期内,符合其规格要求。
●试剂恒重。
基准试剂在存放期间可能吸湿,配制前必须严格干燥至恒重。
恒重操作按《中国药典》(2010年版)执行。
●称重●称重是决定所配试剂准确性的关键步骤,必须准确无误。
●天平的称量范围及精度必须与所称样品要求相符,必须有计量部门签发的计量合格证,且在规定的期限内。
●称量样品所放的容器及所有操作过程所用容器均须洁净、无污迹、无残留物。
4.2 标准溶液的配制◆滴定液应由专人配制及标定,标定工作宜在要求下进行,并应在记录中注明标定时的室内温度。
◆标定用玻璃仪器必须是校验合格的玻璃仪器(A级),所用试剂为基准物质或优级纯物质。
◆标定中,滴定液宜从滴定管的起始刻度开始;滴定液的消耗量,除另有特殊规定外,应大于20ml,读数应估计到0.01ml。
◆标定工作应由初标者(一般为配制者)和复标者在相同条件下各作平行试验3份;各项原始数据经校正后,根据计算公式分别进行计算;3份平行试验结果的相对平均偏差,除另有规定外不得大于0. 1%;初标平均值和复标平均值的相对偏差也不得大于0. 1%,标定结果按初、复标的平均值计算,取4位有效数字;标定值应在名义值的±5%之间◆配好的标准溶液须放在与溶液性质相适应的洁净瓶中,贴好状态标记。
◆复核后合格的标准液须贴上标签。
实验二 酸碱标准溶液的配制与标定

实验二酸碱标准溶液的配制与标定一、实验目的:1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。
然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。
1︰2反应,其标定反应为:Na2B4O7·10H2O + 2HCI =2NaCI + 4H3BO3 + 5H2O 在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。
1︰2反应,其标定反应为:Na2CO3 + 2HCI =2NaCI + CO2+ H2O计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4):易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。
实验二 盐酸标定溶液的配制和标定

实验二 盐酸标准溶液的配制和标定,NaOH 溶液浓度的测定一、原理首先配制约0.1mol/L 的盐酸溶液,然后以甲基橙作指标剂,用已知准确浓度的22CO Na 标准溶液来标定盐酸的准确浓度。
利用此HCl 溶液测定NaOH 溶液的浓度。
↑+++22222CO O H NaCl CO Na二、试剂22CO Na 基准物:分析纯; 浓盐酸(比重1.19,):分析纯; 0.1%甲基橙:称取0.1g 甲基橙,溶于100mL 蒸馏水中。
三、测定步骤(一)22CO Na 标准溶液的配制——直接法在分析天平上,用差减法称取22CO Na 约1.2g~1.4g (准确至0.0001g )于小烧杯中,加入约50mL 蒸馏水,用玻璃棒搅拌,使其完全溶解,然后全部转移到250mL 容量瓶中,用水稀释到刻度。
盖好瓶塞,摇匀。
NaCO3m 1000C M V⨯=(mol/L ) 式中: m ——22CO Na 的重量(g ) M ——22CO Na 的分子量;V ——22CO Na 的溶液的体积,即容量瓶的体积(mL ) (二)0.1mol/L HCl 溶液的配制及标定——间接法 HCl 溶液的配制:用小量筒量取浓盐酸约4.5mL 于500mL 清洁的试剂瓶,加蒸馏水至500mL 。
HCl 溶液浓度的标定:用移液管准确吸取25.00mL 已知准确浓度的22CO Na 溶液于250ml 锥形瓶中,加入甲基橙指标剂两滴,用HCl 溶液滴定至溶液颜色由黄色变为橙红色且摇动不消失即为滴定终点,记录滴定管的终点读数,终点读数与起始读数之差,即为滴定所用HCl 溶液的体积。
平行做三份,滴定的相对平均偏差不应超过0.2%。
(三)NaOH溶液的浓度的测定取25.00mlNaOH溶液三份分别置于250ml锥形瓶中,加入1~2滴甲基橙指示剂,用HCl标准溶液滴定至橙色即为终点。
滴定的相对平均偏差不应超过0.2%。
四、原始数据及数据处理1.HCl溶液浓度的计算2.NaOH溶液浓度的计算(要计算结果的平均值及相对平均偏差)请大家注意,做《HCl溶液的配制、标定及测定NaOH浓度》这个实验时,要求一个大桌四个组的数据(NaOH浓度,4*3=12个)集中起来做数据处理,计算结果包括平均值、标准偏差、置信区间,还要考虑可疑值的剔除。
标准溶液滴定液管理规程(含表格)

文件制修订记录1.目的:建立标准溶液(滴定液)的标定、贮存、发放和使用管理规程,加强对标准溶液(滴定液)的管理,保证分析结果的准确性。
2.适用范围:适用于标准溶液(滴定液)的管理。
3.职责:标准溶液(滴定液)配制人、复标人、质量管理部对本规程的实施负责。
4.控制要求:4.1标准溶液(滴定液)的配制4.1.1标准溶液(滴定液)实验室要求:4.1.1.1应设在避光房间,室内阴凉、干燥、通风良好。
4.1.1.2室内须有空调设施,温湿度保持相对恒定,一般控制在温度20±5℃,相对湿度50%~75%。
4.1.2配制前准备工作:4.1.2.1所有品种均有批准的试剂配制操作规程。
4.1.2.2严格执行标准操作规程。
4.1.2.3配制前:首先检查所领试剂瓶签完好、包装完整、封口严密、无污染,在规定的使用期内,符合其规格要求。
4.1.2.4试剂恒重。
为防止基准试剂在存放后可能吸湿,配制前必须严格执行恒重的相关规定。
4.1.3称重:4.1.3.1称重是决定所需试剂准确性的关键步骤,必须准确无误。
4.1.3.2称量基准试剂所用天平应为灵敏度在万分之一的专用分析天平,且计量合格证在有效期内。
4.1.3.3称量样品所放的容器及所有操作过程所用容器均须洁净、无痕迹、无残留物。
4.1.4配制:4.1.4.1所有使用的玻璃量器,如容量瓶、滴定管、移液管均选用一等(A级)品,并经过校正,有校正合格证或附有校正值。
4.1.4.2严格按配制方法进行操作,实验操作规范,符合要求。
室内温度不符合要求时不得进行标定和复标。
4.1.4.3配好的标准溶液(滴定液)须放在与溶液性质相适应的洁净试剂瓶中,贴好标签。
4.1.4.4按规定程序进行标定,相对偏差应≤0.1%;由第二人进行复标,其相对偏差应≤0.1% 。
标定的份数和复标的份数均不得少于3份,二者的相对偏差≤0.1%,否则重标。
4.1.4.5标定结果按初、复标的平均值计算,取4位有效数字。
标准溶液的配置标定记录

标准溶液的配置标定记录氢氧化钠标准滴定溶液的配置滴定记录① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取毫升氢氧化钠饱和溶液,注入毫升不含二氧化碳的水中,摇匀。
② 标定:称取克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于毫升不含二氧化碳的水中,加2滴1酚酞指示液,用氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=m 1000(V1 V2)M式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(*****4)= 204.22 ]容量分析原始记录检验:审核:检验日期:① 配制:盐酸标准溶液,量取毫升盐酸,注入毫升水中。
② 标定:称取克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=m 1000(V1 V2)M式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V1---盐酸溶液的体积的数值,单位为毫升(mL)V2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12 Na2CO3)=52.994]容量分析原始记录检验:审核:检验日期:① 配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
标准溶液‘配制’及‘标定’原始重点学习的记录.docx
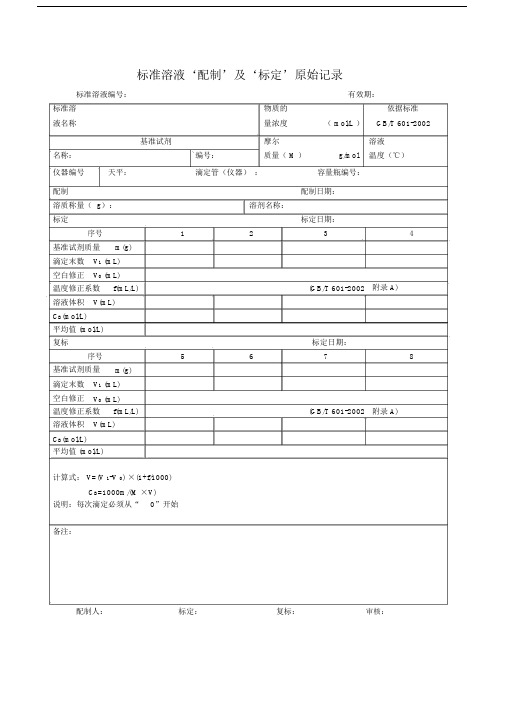
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:标准溶物质的依据标准液名称量浓度( mol/L )GB/T 601-2002基准试剂摩尔溶液名称:编号:质量( M )g/mol温度(℃)仪器编号天平:滴定管(仪器):容量瓶编号:配制配制日期:溶质称量( g):溶剂名称:标定标定日期:序号1234基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)复标标定日期:序号5678基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)计算式: V=(V 1-V 0) ×(1+f/1000)C B=1000m/(M ×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/ QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH配制:取定溶mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量( mL)V1=、 V2=、 V3=、V4=、V0=。
标准溶液浓度计算公式: C=计算结果():C1=C2=C3=C4= C =相对偏差( %):S1=S2=S3=S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号: JL/LJ-001-01一、标定方法: GB/T5009.1-2003二、使用仪器: AEL-200 电子天平(仪器编号: JYB001)马弗炉 (仪器编号:JYC009)三、操作1、量取 9ml 盐酸,加适量水并稀释至 1000ml 。
EDTA标准溶液的配制和标定

实验十八EDTA标准溶液的配制和标定1.实验目的(1)掌握络合滴定的原理,了解络合滴定的特点;(2)学习EDTA标准溶液的配制和标定方法;(3)了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。
2.实验原理乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配制标准溶液。
标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu 、MgSO4·7 H2O等。
用于测定Pb2+、Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。
以二甲酚橙作指示剂,在pH=5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。
EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。
EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。
其变色原理可表达如下:XO(黄色)+ Zn2+__ZnXO(紫红色)ZnXO(紫红色)+EDTA__ZnEDTA(无色)+XO(黄色)EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量及测定水的硬度,最好选用CaCO3做基准物标定。
这样基准物和被测组分含有相同的组分,使得测定条件一致,可以减少误差。
首先将CaCO3用盐酸溶解后,制成Ca2+标准溶液,调节酸度至pH>12.5时,以钙黄绿素-百里酚酞作混合指示剂,用EDTA标准溶液滴至由绿色荧光色消失。
3.仪器和药品仪器:电子天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。
药品:(1)以ZnO为基准物时所用试剂:ZnO(A.R)、乙二胺四乙酸二钠(A.R)、六次甲基四胺:20%(m/v)、二甲酚橙指示剂(0.2%)、盐酸(1+1)。
(2)以CaCO3为基准物时所用试剂:碳酸钙:固体,一级试剂(G.R);盐酸(1+1);钙黄绿素-百里酚酞混合指示剂(1g钙黄绿素和1g百里酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于小广口瓶中);氢氧化钾溶液:20%(m/v);乙二胺四乙酸二钠(A..R); 4.实验步骤(1)0.015mol/LEDTA标准溶液的配制称取5.6g乙二胺四乙酸二钠(A.R)置于400ml烧杯中,加入约200mL水及2小片氢氧化钠(A..R)加热溶解(必要时过滤),冷却后,用水稀释至1L,摇匀;(2)以ZnO为基准物标定EDTA溶液Zn2+标准溶液的配制准确称取ZnO基准物0.35~0.5g于150mL烧杯中,用数滴水润湿后,盖上表面皿,从烧杯嘴中滴加10mL1+1盐酸,待完全溶解后冲洗表面皿和烧杯内壁,定量转移至250mL容量瓶中,加水稀释至刻度,摇匀,计算其准确浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝酸银标准滴定溶液配制及标定原始记录
依据标准GB/T5009.1-2003有效期:3个月
基准试剂名称:氯化钠
基准试剂摩尔质量(M):58.442g/mol
仪器、设备编号
实验电阻炉:检41
分析天平:检25
称量瓶:
1000 mL棕色容量瓶:
150 mL三角瓶:
50mL棕酸滴定管:
配制
试剂称量(g):
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
复标
复校
操作序号
1
2
3
4
5
6
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mo复校
复校
操作序号
7
8
9
10
11
12
操作日期
氢氧化钠标准滴定溶液配制及标定原始记录
依据标准GB/T601-2002有效期:2个月
基准试剂名称:邻苯二甲酸氢钾
基准试剂摩尔质量(M):204.22g/mol
仪器、设备编号
电热恒温干燥箱:
分析天平:
称量瓶:
100 mL容量瓶:
10mL刻度吸管:
1000 mL容量瓶:
150 mL三角瓶:
滴定管:
配制
试剂称量(g):
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
配制人:标定人:
硫酸标准滴定溶液配制及标定原始记
依据标准GB/T601-2002有效期:3个月
基准试剂名称:无水碳酸钠
基准试剂摩尔质量(M):52.994g/mol
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:
V=﹙V1-V2﹚×﹙1± ﹚C= =
备注:❶每次滴定必须从“0”开始;
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
仪器、设备编号
实验电阻炉:
分析天平:
乳钵:
称量瓶:
50 ml量筒:
1000 mL容量瓶:
150 mL三角瓶:
50mL酸式滴定管:
配制
试剂称量(g):
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
操作序号
1
2
3
4
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
空白修正V2﹙mL﹚
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
配制人:标定:复标:复校:
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
操作序号
1
2
3
4
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
空白修正V2﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:V=﹙V1-V2﹚×﹙1± ﹚C= =
备注:❶每次滴定必须从“0”开始;
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:V=﹙1± ﹚×V1C= =
备注:❶每次滴定必须从“0”开始;
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
