差速离心法和密度梯度离心法的区别
密度离心和差速离心

密度离心和差速离心
一、密度离心
所谓密度离心,指的是利用密度的不同结合离心力,使重物离心旋转,从而使不同密度的液体分离的一种分离工艺。
一般用来分离悬浮液、分离混合物中比密度差不多的液体,也可以分离溶质、悬浮物等。
密度离心的工艺特点有:
1、离心力大,易于将混合物中的不同密度的液体分离出来。
2、机械结构简单,操作简单,只需数十甚至几十分钟就可以实现混合物的分离。
3、操作温度较低,不受外界温度波动影响。
4、如果混合物中液体的密度有明显的差别,可以实现快速、高效的分离。
二、差速离心
所谓的差速离心,就是利用混合物中液体不同的摩擦系数,在两个不同速度的离心管中使它们运动,从而达到混合物的分离而发明的一种离心技术。
差速离心主要用于高粘度、低浓度的混合物的分离,如果混合物中的液体摩擦系数较小,可以使液体较快的分离出来。
差速离心的工艺特点有:
1、离心力小,能有效分离混合物中的低浓度、高粘度的液体。
2、机械结构简单,易于操作。
3、操作温度低,不受外界温度波动影响。
4、操作较简单,只需要数十分钟就可以实现混合物的分离。
细胞分离常用方法

细胞分离常用方法细胞分离是生物学和医学研究中的基础技术之一,它可以将复杂的生物样品中的细胞分离出来,进而进行单细胞研究、细胞培养、细胞分析等进一步实验。
细胞分离的方法有很多种,可以根据研究目的和实验要求来选择合适的方法。
下面将介绍几种常用的细胞分离方法。
1.酶消化分离法:这种方法是通过使用特定的酶来消化组织或细胞间的连接物质,使细胞从组织中解离出来。
常用的酶有胰蛋白酶、胰酶、胶原酶、玉米胚胎蛋白酶等。
该方法适用于从组织中分离细胞,如从肝脏中分离肝细胞。
2.离心法:离心法是利用离心仪的离心力来分离细胞。
一般分为差速离心和密度梯度离心两种。
差速离心适用于分离不同大小和形状的细胞,如红细胞和白细胞的分离;而密度梯度离心适用于细胞的分子量和密度有明显差异的情况,如分离淋巴细胞、单核细胞等。
3.过滤法:过滤法是利用不同孔径的滤膜将样品中的细胞分离出来。
根据细胞大小的不同,可以选择不同孔径大小的滤膜,常见的有0.22μm的滤膜。
过滤法适用于细胞数目较多且大小相似的情况,如血液中的白细胞。
4.磁珠分离法:磁珠分离法是利用磁珠的特殊性质和磁场来分离细胞。
磁珠表面可以特异性地结合上其中一种特定分子,如抗体。
通过与标记有磁珠的抗体的结合,可以选择性地将含有特定表面标记的细胞分离出来。
这种方法可以用于对细胞表面标记的特异性分离,如肿瘤细胞的分离。
5.流式细胞术:流式细胞术是通过细胞在流动溶液中的特定速度和流体动力学效应来分离细胞。
这种方法需要将细胞样品悬浮在含有细胞染料的缓冲液中,经过专用的流式细胞术仪器进行分析。
根据细胞性状、大小和表面标记的不同,可以选择性地将不同细胞分离出来。
上述方法是几种常见的细胞分离方法,不同的方法适用于不同的细胞类型和实验要求。
除了上述方法外,还有其他一些特殊的细胞分离方法,如电泳法、免疫磁珠法等。
在选择细胞分离方法时,需要综合考虑细胞类型、实验目的和设备条件等因素,选择合适的分离方法。
差速离心、密度梯度离心、超滤离心技术在骨髓间充质干细胞外泌体提取中的应用对比观察

差速离心㊁密度梯度离心㊁超滤离心技术在骨髓间充质干细胞外泌体提取中的应用对比观察罗靖莹ꎬ贺宏丽ꎬ郭阳ꎬ黄玮玮ꎬ黄晓波(电子科技大学附属医院/四川省人民医院ꎬ成都610072)㊀㊀摘要:目的㊀观察差速离心㊁密度梯度离心㊁超滤离心技术在骨髓间充质干细胞(BMSCs)外泌体提取中的应用ꎬ筛选外泌体最佳离心提取方法ꎮ方法㊀取BMSCs培养48h后收集细胞上清ꎬ平均分成A㊁B㊁C组ꎬ分别使用差速离心技术㊁密度梯度离心技术㊁超滤离心技术提取外泌体ꎻ记录各组外泌体提取时间ꎻ采用负染色技术观察各组外泌体形态ꎻ使用纳米颗粒跟踪分析仪测算各组外泌体浓度及大小ꎻ采用BCA法测定外泌体总蛋白浓度ꎻ采用Westernblotting法检测各组外泌体表面标志蛋白CD9㊁CD63㊁Alixꎮ将肺微血管内皮细胞(PMVECs)分成5组ꎬEC组上室加入PMVECs及培养基ꎻLPS组上室加入PMVECs及含LPS的培养基(构建内皮细胞损伤模型)ꎻA㊁B㊁C组上室加入方法同LPS组ꎬ下室分别加入A㊁B㊁C组外泌体ꎻ采用葡聚糖渗漏实验检测外泌体内皮细胞通透性(观察外泌体对内皮细胞的修复作用)ꎬ以内皮细胞通透指数表示ꎮ结果㊀A㊁B㊁C组的外泌体的提取时间分别为(180ʃ8)㊁(203ʃ10)㊁(40ʃ5)minꎬA㊁B组外泌体的提取时间与C组相比ꎬP均<0.05ꎮ各组外泌体均为大小不等的椭圆形或圆形的膜性结构ꎬ边界清晰ꎬ但仅A组外泌体可见到典型的杯状结构ꎮA㊁B㊁C组的外泌体浓度分别为(4.46ʃ0.38)ˑ108/mL㊁(5.11ʃ0.16)ˑ108/mL㊁(2.18ʃ0.17)ˑ108/mLꎬA㊁B组与C组外泌体浓度相比ꎬP均<0.05ꎮA㊁B㊁C组的外泌体大小均为20~100nmꎮA㊁B组外泌体总蛋白浓度及CD63㊁Alix的相对表达量均显著高于C组(P均<0.05)ꎮA㊁B㊁C㊁LPS㊁EC组的内皮细胞通透指数分别为2.17ʃ0.15㊁1.77ʃ0.32㊁2.37ʃ0.42㊁2.93ʃ0.15㊁1.00ʃ0.00ꎬA㊁B㊁C㊁LPS组的内皮细胞通透指数与EC组相比ꎬP均<0.05ꎻA㊁B组的内皮细胞通透指数与LPS组相比ꎬP均<0.05ꎮ结论㊀密度梯度离心技术虽耗时较长ꎬ但提取的外泌体纯度㊁浓度较高ꎬ对内皮细胞的修复作用较强ꎬ可以作为科研和临床研究的首选外泌体离心提取方法ꎮ㊀㊀关键词:外泌体ꎻ外泌体提取方法ꎻ差速离心技术ꎻ密度梯度离心技术ꎻ超滤离心技术ꎻ间充质干细胞ꎻ骨髓间充质干细胞ꎻ肺微血管内皮细胞㊀㊀doi:10.3969/j.issn.1002 ̄266X.2019.12.013㊀㊀中图分类号:R33㊀㊀文献标志码:A㊀㊀文章编号:1002 ̄266X(2019)12 ̄0048 ̄05基金项目:四川省医学科学院 四川省人民医院青年博士基金(2015BS07)ꎮ通信作者:黄晓波(E ̄mail:drhuangxb@163.com)[12]StolfAMꎬCardosoCCꎬAccoA.Effectsofsilymarinondiabetesmellituscomplications:areview[J].PhytotherResꎬ2017ꎬ31(3):366 ̄374.[13]VessalGꎬAkmaliMꎬNajafiPꎬetal.Silymarinandmilkthistleextractmaypreventtheprogressionofdiabeticnephropathyinstreptozotocin ̄induceddiabeticrats[J].RenFailꎬ2010ꎬ32(6):733 ̄739.[14]SheelaNꎬJoseMAꎬSathyamurthyDꎬetal.Effectofsilymarinonstreptozotocin ̄nicotinamide ̄inducedtype2diabeticnephropathyinrats[J].IranJKidneyDisꎬ2013ꎬ7(2):117 ̄123.[15]张红ꎬ章向成ꎬ朱大龙.炎性反应与糖尿病肾病[J].国际内分泌代谢杂志ꎬ2015ꎬ35(1):49 ̄52.[16]NguyenDꎬPingFꎬMuWꎬetal.Macrophageaccumulationinhu ̄manprogressivediabeticnephropathy[J].Nephrologyꎬ2010ꎬ11(3):226 ̄231.[17]郑寿焕ꎬ金光明ꎬ柳明洙.CD14启动子 ̄159位点基因多态性与糖尿病肾病的相关性研究[J].中华内分泌代谢杂志ꎬ2009ꎬ25(4):409 ̄411.[18]WuCHꎬHuangSMꎬYenGC.Silymarin:anovelantioxidantwithantiglycationandantiinflammatorypropertiesinvitroandinvivo[J].AntioxidRedoxSignalꎬ2011ꎬ14(3):353 ̄366.[19]ZhangHꎬZhangRꎬChenJꎬetal.Highmobilitygroupbox1in ̄hibitorglycyrrhizicacidattenuateskidneyinjuryinstreptozotocin ̄induceddiabeticrats[J].KidneyBloodPressResꎬ2017ꎬ42(5):894 ̄904.[20]Garcia ̄GarciaPMꎬGetino ̄MelianMAꎬDominguez ̄PimentelVꎬetal.Inflammationindiabetickidneydisease[J].WorldJDiabetesꎬ2014ꎬ5(4):431 ̄443.[21]FallahzadehMKꎬDormaneshBꎬSaghebMMꎬetal.Effectofaddi ̄tionofsilymarintorenin ̄angiotensinsysteminhibitorsonproteinu ̄riaintype2diabeticpatientswithovertnephropathy:arandom ̄izedꎬdouble ̄blindꎬplacebo ̄controlledtrial[J].AmJKidneyDisꎬ2012ꎬ60(6):896 ̄903.(收稿日期:2018 ̄12 ̄04)84ComparisonofdifferentialcentrifugationꎬdensitygradientcentrifugationꎬandultrafiltrationofcentrifugationinextractionofexosomesfrombonemarrowmesenchymalstemcellsLUOJingyingꎬHEHongliꎬGUOYangꎬHUANGWeiweiꎬHUANGXiaobo(TheAffiliatedHospitalofUniversityofElectronicScienceandTechnology/SichuanProvincialPeople'sHospitalꎬChengdu610072ꎬChina)㊀㊀Abstract:Objective㊀Toobservetheapplicationofthedifferentialcentrifugationꎬdensitygradientcentrifugationandultrafiltrationofcentrifugationintheextractionofexosomesfrombonemarrowmesenchymalstemcells(BMSCs)ꎬandtofindouttheoptimalmethod.Methods㊀Afterculturingfor48hꎬthesupernatantsofBMSCswerecollectedanddividedintothegroupsAꎬBandC.Theexosomeswereextractedbydifferentialcentrifugationꎬdensitygradientcentrifugationꎬandul ̄trafiltrationcentrifugationꎬrespectively.Theextractiontimeofeachgroupwasrecorded.Themorphologyofexosomesineachgroupwasobservedbynegativestainingtechniqueꎻtheconcentrationandsizeofexosomesweremeasuredbynanopar ̄ticletrackinganalyzerꎻtheconcentrationoftotalproteinwasdeterminedbyBCAmethodꎻthesurfacemarkerproteinsCD9ꎬCD63ꎬAlixofexosomesweredetectedbyWesternblotting.Pulmonarymicrovascularendothelialcells(PMVECs)weredi ̄videdintofivegroups.PMVECsandmediumwereaddedtotheupperchamberoftheECgroup.PMVECsandLPS ̄contai ̄ningmediumwereaddedtotheupperchamberoftheLPSgroup(theendothelialcellinjurymodel)ꎻThesubstancesaddedtotheupperchamberofgroupsAꎬBandCwerethesameasthoseoftheLPSgroupꎬandthelowerchamberwasaddedwiththeexosomesꎬrespectively.Thepermeabilityofexosomeswasdetectedbydextranleakagetest(toobservetheeffectontherepairmentofendothelialcells).Results㊀TheextractiontimeofexosomesinthegroupsAꎬBandCwas(180ʃ8)ꎬ(203ʃ10)and(40ʃ5)minꎬrespectively.TheextractiontimeofexosomesinthegroupsAandBwassignificanthigherthanthatofthegroupC(P<0.05).TheexosomesofeachgroupwereellipticalorcircularmembranousstructuresofvaryingsizeswithclearboundariesꎬbutonlyinthegroupAꎬwefoundtypicalcup ̄likestructure.Theexosomeconcen ̄trationsinthegroupsAꎬBꎬandCwere(4.46ʃ0.38)ˑ108/mLꎬ(5.11ʃ0.16)ˑ108/mLꎬand(2.18ʃ0.17)ˑ108/mLꎬrespectivelyꎬwithstatisticallysignificantdifference(allP<0.05).Theexosomesofeachgroupwere20to100nminsize.ThetotalproteinconcentrationandtherelativeexpressionofCD63andAlixinthegroupsAandBweresignificantlyhigherthanthoseinthegroupC(allP<0.05).ThepermeabilityindexesofendothelialcellsinthegroupsAꎬBꎬCꎬLPSgroupandECgroupwere2.17ʃ0.15ꎬ1.77ʃ0.32ꎬ2.37ʃ0.42ꎬ2.93ʃ0.15ꎬand1.00ʃ0.00ꎬrespectivelyꎻsignifi ̄cantdifferencewasfoundinthepermeabilityofendothelialcellsbetweenthegroupECandgroupsAꎬBꎬCandLPS(allP<0.05)aswellasbetweenthegroupLPSandgroupsAandB(P<0.05).Conclusion㊀Ittakesalongertimeforden ̄sitygradientcentrifugationtechnologytoextracttheexosomesꎬbuttheextractedexosomeshavehigherpurityꎬconcentra ̄tionꎬandstrongerrepairingeffectonendothelialcells.Thereforeꎬdensitygradientcentrifugationtechnologycouldbeapre ̄ferredcentrifugalextractionmethodforscientificresearchandclinicalresearch.Keywords:exosomesꎻexosomesextractedmethodꎻdifferentialcentrifugationꎻdensitygradientcentrifugationꎻultra ̄filtrationcentrifugationꎻmesenchymalstemcellsꎻbonemarrowmesenchymalstemcellsꎻpulmonarymicrovascularendothe ̄lialcells㊀㊀间充质干细胞(MSCs)作为一种具有多向分化潜能的细胞ꎬ因其在再生医学领域和临床试验中对各种疾病的治疗效果受到广泛关注ꎮ骨髓间充质干细胞(BMSCs)常被作为细胞再生的理想供体细胞ꎬ主要的作用机制包括归巢㊁调节免疫㊁转分化及旁分泌[1~4]ꎮ外泌体是一种由脂质双分子层包裹的膜性囊泡ꎬ大小通常在20~100nmꎮ研究[5~9]显示ꎬ外泌体广泛存在于尿液㊁胸腹腔积液㊁乳汁㊁唾液等体液中ꎬ而且很多细胞可以分泌外泌体ꎬ如MSCs㊁血细胞㊁内皮细胞㊁神经细胞㊁肿瘤细胞等ꎻ外泌体内含有各种蛋白质㊁脂类和mRNA㊁miRNA㊁DNA片段等遗传物质ꎬ细胞间可以通过外泌体交换信息㊁相互作用ꎬ且免疫排斥风险较低ꎬ在各种病理状态及炎症反应中发挥着重要的作用ꎮ内皮细胞和上皮细胞受损是炎症反应中至关重要的环节ꎬ已证实MSCs可以通过外泌体修复受损的内皮细胞[10]ꎮ外泌体体积小且不稳定ꎬ因此如何快速有效地分离和提取外泌体是目前面临的主要挑战ꎮ分离和提取外泌体的方94法主要有离心法㊁免疫磁珠法㊁PEG沉淀法㊁试剂盒法等ꎬ其中常用的离心法主要有差速离心技术㊁密度梯度离心技术和超滤离心技术[11]ꎮ差速离心技术主要是依据粒子大小和密度设置不同的离心力ꎬ通过平衡沉降原理来分离外泌体ꎮ密度梯度离心技术通常采用蔗糖作为分离介质ꎬ与重水一起配置成1.1~1.19g/mL的密度垫ꎬ根据不同沉降系数物质在离心力作用下的分层分布ꎬ以此分离出外泌体[12]ꎮ超滤离心技术是在一定压力下使溶质通过不同孔径的滤膜ꎬ从而筛选出外泌体ꎮ2018年6月2日~2018年9月1日ꎬ本研究观察了差速离心㊁密度梯度离心㊁超滤离心技术在BMSCs外泌体提取中的应用ꎬ筛选外泌体最佳离心提取方法ꎮ1 材料与方法1.1㊀细胞㊁试剂及仪器㊀BMSCs㊁肺微血管内皮细胞(PMVECs)购自美国sciencell公司ꎬDMEM/F12培养基㊁胎牛血清(FBS)购自美国Gibco公司ꎬ抗CD9㊁CD63㊁Alix㊁GAPDH购自R&D公司ꎬ山羊抗兔IgG ̄HRP㊁山羊抗鼠IgG ̄HRP购自美国Abcam公司ꎬBCA蛋白试剂盒购自凯基公司ꎬ透射电子显微镜购自Philips公司ꎬ细胞恒温培养箱购自美国Thermo公司ꎬ超速离心机购自Beckman公司ꎬ荧光酶标仪购自美国Thermo公司ꎮ1.2㊀细胞培养㊁分组及外泌体的提取㊀BMSCs㊁PMVECs分别在37ħ㊁5%CO2细胞培养箱中ꎬ用含有10%胎牛血清(FBS)和5%双抗的DMEM/F12培养基进行培养ꎮ取第4~5代BMSCs培养至60%~70%融合时ꎬ更换为无血清培养基ꎬ继续培养48h后收集细胞上清360mLꎬ平均分成A㊁B㊁C组ꎬ每组120mLꎬ分别使用差速离心技术㊁密度梯度离心技术㊁超滤离心技术提取外泌体ꎮ记录各组外泌体提取时间ꎮ①差速离心技术提取外泌体ꎮ取A组细胞上清以3000ˑg离心20minꎬ去除细胞碎片和大分子物质ꎬ在4ħ条件下100000ˑg离心60minꎬ弃上清ꎬ加入4ħ的PBS重悬ꎬ然后在4ħ条件下100000ˑg离心60minꎬ将沉淀物用200μL预冷的PBS重悬ꎬ用0.22μm滤过膜过滤ꎬ即得BMSCs外泌体ꎮ②密度梯度离心技术提取外泌体ꎮ取B组细胞上清以300ˑg离心10minꎬ去除细胞碎片和大分子物质ꎬ10000ˑg离心30minꎬ去除微泡ꎬ延离心管壁缓慢加入4mL30%蔗糖溶液ꎬ形成一单层ꎬ在4ħ条件下100000ˑg离心90minꎬ弃上清ꎬ将蔗糖层重悬于PBS中ꎬ再在4ħ条件下100000ˑg离心90minꎬ将获得的沉淀物重悬于200μL预冷的PBS中ꎬ即得BMSCs外泌体ꎮ③超滤离心技术提取外泌体ꎮ在超滤离心管中加入PBS缓冲液ꎬ室温条件下3000ˑg离心15minꎬ去除甘油和其他保存剂ꎻ取C组细胞上清以17000ˑg离心15minꎬ然后加入超滤离心管中以3000ˑg离心30minꎬ用200μLPBS重悬超滤膜上的沉淀物ꎬ即得BMSCs外泌体ꎮ1.3㊀A㊁B㊁C组外泌体形态观察㊀采用负染色技术ꎮ向载样铜网上分别加入提取的A㊁B㊁C组外泌体混悬液20μLꎬ室温静置3min后用滤纸吸干液体ꎬ再加入30μL的3%磷钨酸溶液负染5minꎬ滤纸吸干㊁晾干ꎬ透射电镜下观察各组外泌体形态ꎮ1.4㊀A㊁B㊁C组外泌体浓度及大小测算㊀取A㊁B㊁C组外泌体悬液100μL稀释于2mLPBS内ꎬ使用纳米颗粒跟踪分析仪(Nanosight)测算各组外泌体浓度ꎬ并根据每个粒子的布朗运动与斯托克斯 ̄爱因斯坦(Stokes ̄Einstein)方程测算各组外泌体大小ꎮ1.5㊀A㊁B㊁C组外泌体总蛋白及表面标志蛋白CD9㊁CD63㊁Alix的检测㊀①采用BCA法测定A㊁B㊁C组外泌体总蛋白浓度ꎮ②采用Westernblotting法检测A㊁B㊁C组外泌体表面标志蛋白CD9㊁CD63㊁Alixꎮ取A㊁B㊁C组外泌体悬液100μLꎬ加入RIPA裂解液于冰上裂解10minꎬ使用超声破碎外泌体后于4ħ条件下15000ˑg离心10minꎬ制得各组外泌体蛋白样本ꎮ取各组外泌体蛋白样本与上样缓冲液混合煮沸5min使蛋白变性ꎬ然后进行SDS ̄PAGE电泳ꎬ半干时转至PVDF膜上ꎬ用5%脱脂奶粉封闭ꎬ加入一抗ꎬ4ħ过夜ꎬTBST清洗3次ꎬ加入相应二抗ꎬ室温孵育1hꎬTBST清洗3次ꎬ以GAPDH为内参ꎬECL化学发光系统检测各组外泌体表面标志蛋白CD9㊁CD63㊁Alix灰度值ꎬ计算各组外泌体表面标志蛋白CD9㊁CD63㊁Alix的相对表达量ꎮ外泌体表面标志蛋白的相对表达量=外泌体表面标志蛋白灰度值/GAPDH灰度值ꎮ1.6㊀外泌体内皮细胞通透性检测㊀采用100ng/mL的脂多糖(LPS)干预PMVECs6h构建内皮细胞损伤模型ꎮ采用Transwell小室进行葡聚糖渗漏实验ꎮ将PMVECs分成5组ꎬEC组上室加入1ˑ105个PMVECs以及100μL完全培养基ꎻLPS组上室加入1ˑ105个PMVECs以及100μL含100ng/mLLPS的完全培养基ꎻA㊁B㊁C组上室加入方法05同LPS组ꎬ下室分别加入A㊁B㊁C组外泌体100μgꎬ用不含酚红㊁血清的培养基重悬至400μLꎮ各组上室弃上清ꎬ加入不含酚红㊁血清的培养基配制的FITC ̄葡聚糖(40kDaꎬ0.5mg/mL)100μLꎬ下室加入等浓度无FITC标记的葡聚糖100μLꎬ37ħ㊁5%CO2㊁避光条件下培养40minꎬ吸取上㊁下室液体各100uLꎬ在激发光波长490/485nm㊁发射光波长525/530nm处ꎬ采用荧光酶标仪检测荧光强度ꎬ计算内皮细胞通透系数ꎮ内皮细胞通透系数=([A]/t)ˑ(1/A)ˑ(v/[L])ꎮ其中[A]为下室荧光强度ꎻt为时间ꎬ单位为sꎻA为滤过面积ꎬ单位为cm2ꎻv为下室液体量ꎻ[L]为上室荧光强度ꎮ各组外泌体内皮细胞通透性以各组内皮细胞通透指数表示ꎮ各组内皮细胞通透指数=各组内皮细胞通透系数/EC组内皮细胞通透系数ꎮ1.7㊀统计学方法㊀采用SPSS20.0统计软件ꎮ计量资料以 xʃs表示ꎬ比较用单因素方差分析ꎮP<0.05为差异有统计学意义ꎮ2㊀结果2.1㊀A㊁B㊁C组外泌体提取时间比较㊀A㊁B㊁C组的外泌体的提取时间分别为(180ʃ8)㊁(203ʃ10)㊁(40ʃ5)minꎬA㊁B组外泌体的提取时间与C组相比ꎬP均<0.05ꎻA组外泌体的提取时间与B组相比ꎬP>0.05ꎮ2.2㊀A㊁B㊁C组外泌体形态比较㊀如图1所示ꎬ各组外泌体均为大小不等的椭圆形或圆形的膜性结构ꎬ边界清晰ꎬ但仅A组外泌体可见到典型的杯状结构ꎮ图1㊀透射电镜下各组外泌体形态2.3㊀A㊁B㊁C组外泌体浓度及大小比较㊀A㊁B㊁C组的外泌体浓度分别为(4.46ʃ0.38)ˑ108/mL㊁(5.11ʃ0.16)ˑ108/mL㊁(2.18ʃ0.17)ˑ108/mLꎬA㊁B组与C组外泌体浓度相比ꎬP均<0.05ꎻA组与B组外泌体浓度相比ꎬP>0.05ꎮA㊁B㊁C组的外泌体大小均为20~100nmꎮ2.4㊀A㊁B㊁C组外泌体总蛋白浓度及表面标志蛋白CD9㊁CD63㊁Alix的表达比较㊀如表1所示ꎬA㊁B组外泌体总蛋白浓度及CD63㊁Alix的相对表达量均显著高于C组(P均<0.05)ꎮ表1㊀A㊁B㊁C组外泌体表面标志蛋白CD9㊁CD63㊁Alix的表达比较( xʃs)组别总蛋白(μg/mL)CD9CD63AlixA组331.33ʃ24.17﹡6.47ʃ1.0718.47ʃ0.83﹡26.73ʃ0.76﹡B组350.06ʃ30.74﹡7.40ʃ0.5626.30ʃ0.82﹡37.70ʃ2.65﹡C组198.42ʃ18.965.53ʃ1.199.75ʃ0.4418.13ʃ1.27㊀㊀注:与C组相比ꎬ﹡P<0.05ꎮ2.5㊀A㊁B㊁C㊁LPS㊁EC组内皮细胞通透指数比较㊀A㊁B㊁C㊁LPS㊁EC组内皮细胞通透指数分别为2.17ʃ0.15㊁1.77ʃ0.32㊁2.37ʃ0.42㊁2.93ʃ0.15㊁1.00ʃ0.00ꎬA㊁B㊁C㊁LPS组的内皮细胞通透指数与EC组相比ꎬP均<0.05ꎻa㊁b组的内皮细胞通透指数与LPS组相比ꎬP均<0.05ꎻ其余各组间相比ꎬP均>0.05ꎮ3㊀讨论㊀㊀BMSCs是成体干细胞的一种ꎬ具有高度自我更新能力和多向分化潜能ꎬ且具有免疫调节作用ꎬ是组织工程学中常用的种子细胞ꎬ其对临床上常见的急性肺损伤/急性呼吸窘迫综合征㊁心肌梗死㊁糖尿病㊁肝肾功能衰竭等多种疾病的治疗效果受到了广泛的关注ꎮ随着研究的深入进展ꎬ研究人员发现MSCs主要是通过旁分泌机制进行组织器官的保护[13]ꎮ胞外囊泡(EV)被认为是细胞间信息交流和物质传递的新机制[14]ꎮ根据粒径大小和分泌机制的不同ꎬEV可分为100~1000nm的微泡(MV)和20~100nm的外泌体ꎮ研究[15]显示ꎬ外泌体易获取㊁易储存ꎬ无致瘤性ꎬ在再生医学㊁器官移植㊁疾病诊断和药物传递等方面发挥了不可或缺的作用ꎬ但目前并无标准的分离提取技15术ꎬ如何提高浓度㊁保证纯度㊁维持活性㊁节约时间ꎬ是目前临床亟需解决的问题ꎮ㊀㊀本研究首先采用差速离心技术㊁密度梯度离心技术和超滤离心技术提取BMSCs外泌体ꎬ随后对分离提取的外泌体进行了比较ꎮ各组外泌体提取时间对比显示ꎬ超滤离心技术提取外泌体用时最少ꎻ通过透射电镜和Nanosight观察到ꎬ3种方法均可以分离出大小不等的椭圆形或圆形的膜性结构ꎬ大小在20~100nmꎻ通过BCA蛋白定量法和NTA公式计算出ꎬ密度梯度离心技术提取的外泌体总蛋白和外泌体浓度最高ꎬ差速离心技术其次ꎬ超滤离心技术最低ꎻ3种方法提取的外泌体均可表达特异性表面标志物CD9㊁CD63㊁Alixꎬ差速离心技术和密度梯度离心技术CD63和Alix的表达明显高于超滤离心技术ꎬ说明超滤离心技术分离出来的外泌体浓度和纯度均较低ꎮ㊀㊀PMVECs既是急性肺损伤时的受害者ꎬ也是启动者ꎬ在急性呼吸窘迫综合征(ARDS)发生时ꎬPM ̄VECs的通透性显著升高ꎮ本研究通过LPS干预PMVECs构建了内皮细胞损伤模型ꎬ观察各离心技术提取的外泌体对受损内皮细胞的修复作用ꎬ结果显示ꎬ与LPS组相比ꎬA㊁B组外泌体内皮细胞通透指数显著下降ꎬ说明差速离心技术和密度梯度离心技术提取的外泌体具有更强的内皮细胞修复能力ꎬ可能与差速离心技术和密度梯度离心技术提取的外泌体浓度和纯度更高有关ꎬ但后期仍需研究更多的内皮细胞功能实验验证ꎮ㊀㊀差速离心技术步骤简单ꎬ产物纯度高ꎮ但差速离心技术也有一定的缺点ꎬ反复的离心提纯过程会造成外泌体丢失及影响囊膜的完整性ꎬ且易形成聚合物[16]ꎻ密度梯度离心技术提取产物更纯ꎬ且不影响外泌体的活性ꎬ但是准备工作繁琐ꎬ程序复杂且耗时长ꎮ超滤离心技术过程简单㊁速度快ꎬ但可能存在杂蛋白污染ꎬ部分外泌体也可能黏附于滤膜上导致产物损失以及活性丧失[17]ꎮ㊀㊀综上所述ꎬ密度梯度离心技术虽耗时较长ꎬ但提取的外泌体纯度㊁浓度较高ꎬ对内皮细胞的修复作用较强ꎬ可以作为科研和临床研究的首选外泌体离心提取方法ꎮ参考文献:[1]EsrefogluM.Roleofstemcellsinrepairofliverinjury:experi ̄mentalandclinicalbenefitoftransferredstemcellsonliverfailure[J].WorldJGastroenterolꎬ2013ꎬ19(40):6757 ̄6773. [2]BhasinAꎬSrivastavaMVꎬMohantySꎬetal.Stemcelltherapy:aclinicaltrialofstroke[J].ClinNeurolNeurosurgꎬ2013ꎬ115(7):1003 ̄1008.[3]LaiRCꎬTanSSꎬTehBJꎬetal.ProteolyticpotentialoftheMSCexosomeproteome:implicationsforanexosome ̄mediateddeliveryoftherapeuticproteasome[J].IntJProteomicsꎬ2012ꎬ2012:971907.[4]SinghMꎬGuptaSꎬRawatSꎬetal.Mechanismsofactionofhumanmesenchymalstemcellsintissuerepairregenerationandtheirim ̄plications[J].AnnNatlAcadMedSci(India)ꎬ2017ꎬ53(2):104 ̄120.[5]LiPꎬKaslanMꎬLeeSHꎬetal.Progressinexosomeisolationtech ̄niques[J].Theranosticsꎬ2017ꎬ7(3):789 ̄804. [6]ClarkDJꎬFondrieWEꎬLiaoZꎬetal.Redefiningthebreastcancerexosomeproteomebytandemmasstagquantitativeproteomicsandmultivariateclusteranalysis[J].AnalChemꎬ2015ꎬ87(20):10462 ̄10469.[7]YuBꎬZhangXꎬLiX.Exosomesderivedfrommesenchymalstemcells[J].IntJMolSciꎬ2014ꎬ15(3):4142 ̄4157. [8]叶冬熳ꎬ于韬.肿瘤外泌体的提取与鉴定[J].现代肿瘤医学ꎬ2018ꎬ26(20)ꎬ3341 ̄3343.[9]ChanBDꎬWongWYꎬLeeMMꎬetal.Exosomesininflammationandinflammatorydisease[J].Proteomicsꎬ2019ꎬ13:e1800149. [10]GongMꎬYuBꎬWangJꎬetal.Mesenchymalstemcellsreleaseex ̄osomesthattransfermiRNAstoendothelialcellsandpromotean ̄giogenesis[J].Oncotargetꎬ2017ꎬ8(28):45200 ̄45212. [11]贺娇ꎬ许泼实.外泌体提取方法及鉴定分析研究进展[J].中华实用诊断与治疗杂志ꎬ2018ꎬ32(7):718 ̄721.[12]PalmaJꎬYaddanapudiSCꎬPigatiLꎬetal.MicroRNAsareexpor ̄tedfrommalignantcellsincustomizedparticles[J].NucleicAcidsResꎬ2012ꎬ40(18):9125 ̄9138.[13]MarconiSꎬCastiglioneGꎬTuranoEꎬetal.Humanadipose ̄de ̄rivedmesenchymalstemcellssystemicallyinjectedpromoteperiph ̄eralnerveregenerationinthemousemodelofsciaticcrush[J].TissueEngPartAꎬ2012ꎬ18(11 ̄12):1264 ̄1272.[14]TettaCꎬGhigoEꎬSilengoLꎬetal.Extracellularvesiclesasane ̄mergingmechanismofcell ̄to ̄cellcommunication[J].Endocrineꎬ2013ꎬ44(1):11 ̄19.[15]杨君君ꎬ陈诚ꎬ杨柳ꎬ等.大鼠骨髓间充质干细胞来源的胞外囊泡分离与鉴定[J].细胞与分子免疫学杂志ꎬ2018ꎬ33(10):1381 ̄1384.[16]LinaresRꎬTanaSꎬGounouCꎬetal.High ̄speedcentrifugationin ̄ducesaggregationofextracellularvesicles[J].JExtracellvesiclesꎬ2015ꎬ4:29509.[17]WitwerKWꎬBuzásEIꎬBemisLTꎬetal.Standardizationofsamplecollectionꎬisolationandanalysismethodsinextracellularvesicleresearch[J].JExtracellVesiclesꎬ2013ꎬ2:20360.(收稿日期:2018 ̄11 ̄29)25。
高中生物中差速离心法和密度梯度离心法的应用

高中生物中差速离心法和密度梯度离心法的应用
离心是生物学实验中重要的操作步骤之一,差速离心法和密度梯度离心法是应用广泛的离心技术。
差速离心法是通过调节离心机转速和时间,使不同大小或密度的细胞或组分沉淀到不同位置,从而分离它们。
差速离心法常用于分离细胞器,如线粒体、叶绿体等。
另外,差速离心法还可以用于分离血液中的不同细胞,如白细胞、红细胞等。
密度梯度离心法是利用不同密度溶液的分层原理,分离不同大小或密度的细胞或组分。
密度梯度离心法常用于分离病毒、蛋白质、核酸等大分子。
例如,在DNA纯化过程中,可以将细胞裂解液加入密度梯度离心管中,经过离心后,DNA会在离心管的不同位置沉淀下来。
以上两种离心方法在生物学研究中具有广泛的应用,可以帮助科学家们分离和纯化不同的细胞组分,进一步研究它们的结构和功能,有助于我们更好地理解生命的奥秘。
- 1 -。
溶酶体分离

溶酶体分离溶酶体是一种细胞的细胞器,主要存在于真核细胞中。
它是一种被膜包围的小囊泡,含有多种水解酶,能够分解细胞内的废弃物和降解被吞噬的外来物质。
溶酶体在维持细胞内环境稳定、细胞代谢和细胞凋亡等生理过程中起着重要的作用。
为了研究溶酶体的功能和结构,科学家们发展了多种溶酶体分离方法。
溶酶体的分离方法可以分为两类:差速离心法和密度梯度离心法。
差速离心法是通过不同细胞器的沉降速度差异来实现分离的。
密度梯度离心法则是利用不同细胞器的密度差异进行分离。
差速离心法中,最常用的是差速离心法。
首先,需要从细胞中分离出溶酶体,这可以通过破碎细胞的方式实现。
一般来说,细胞可以用高压均质仪或超声波破碎,研磨细胞也是一种可行的方法。
然后,用不同的离心速度把破碎的细胞离心,根据细胞器的大小和密度的不同,不同的细胞器会沉降到管底的位置,最后可以用吸管吸取特定纯化的细胞器。
密度梯度离心法则是通过制备密度梯度离心试管来实现。
首先,将离心试管内注入由高到低梯度的离心液,通常常用的是葡聚糖或硅胶等溶液。
然后将破碎的细胞悬浮液缓慢地注入到离心试管中,并开始离心。
在离心过程中,不同密度的细胞器会停留在密度梯度的不同位置,从而实现了细胞器的分离。
最后,用注射器从离心试管中收集分离的细胞器。
通过这些分离方法,科学家们可以获得纯度较高的溶酶体样品,从而方便开展溶酶体的功能和结构研究。
这对于进一步揭示溶酶体在细胞代谢和细胞过程中的作用具有重要意义。
总结一下,溶酶体是一种功能重要的细胞器,可以通过差速离心法和密度梯度离心法进行分离。
差速离心法是根据不同细胞器的沉降速度差异进行分离,而密度梯度离心法则是通过不同细胞器的密度差异进行分离。
通过这些方法,科学家们可以获得纯净的溶酶体样品,从而有助于研究溶酶体的功能和结构。
高中课本中涉及离心技术比较
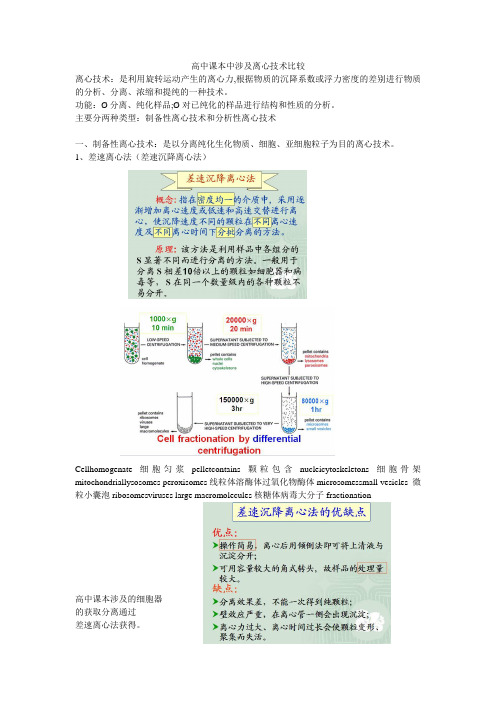
高中课本中涉及离心技术比较离心技术:是利用旋转运动产生的离心力,根据物质的沉降系数或浮力密度的差别进行物质的分析、分离、浓缩和提纯的一种技术。
功能:Ø分离、纯化样品;Ø对已纯化的样品进行结构和性质的分析。
主要分两种类型:制备性离心技术和分析性离心技术一、制备性离心技术:是以分离纯化生化物质、细胞、亚细胞粒子为目的离心技术。
1、差速离心法(差速沉降离心法)Cellhomogenate细胞匀浆pelletcontains颗粒包含nucleicytoskeletons细胞骨架mitochondriallysosomes peroxisomes线粒体溶酶体过氧化物酶体microsomessmall vesicles 微粒小囊泡ribosomesviruses large macromolecules核糖体病毒大分子fractionation高中课本涉及的细胞器的获取分离通过差速离心法获得。
2、密度梯度离心法(密度梯度区带离心法)此法可以用于DNA复制分离、病毒颗粒的分离等。
二、分析性超速离心技术:与制备性超速离心不同的是:分析性超速离心主要是为了研究生物大分子的沉降特性和结构,而不是专门收集某一特定组份。
因此它使用了特殊的转子和检测手段,以便连续监视物质在一个离心场中的沉降过程。
分析性超速离心的应用:⒈测定生物大分子的相对分子重量测定相对分子重量主要有三种方法:沉降速度、沉降平衡和接近沉降平衡。
其中应用最广的是沉降速度,超速离心在高速中进行,这个速度使得任意分布的粒子通过溶剂从旋转的中心辐射地向外移动,在清除了粒子的那部分溶剂和尚含有沉降物的那部分溶剂之间形成一个明显的界面,该界面随时间的移动而移动,这就是粒子沉降速度的一个指标,然后用照相记录,即可求出粒子的沉降系数。
⒉生物大分子的纯度估计静分析性超速离心已广泛地应用于研究DNA 制剂、病毒和蛋白质的纯度。
用沉降速度的技术来分析沉降界面是测定制剂均质性的最常用方法之一,出现单一清晰的界面一般认为是均质的,如有杂质则在主峰的一侧或二侧出现小峰。
差速离心法和密度梯度离心法的区别

差速离心法和密度梯度离心法的区别教学问题:高中生物必修1中研究细胞器的分离方法是差速离心法,必修2中研究DNA复制方式——半保留复制的方法是密度梯度离心法,两者之间有什么区别?一、差速离心法差速离心法是交替使用低速和高速离心,用不同强度的离心力使具有不同质量的物质分级分离的方法。
此法适用于混合样品中各沉降系数差别较大组分的分离。
1.工作原理通常两个组分的沉降系数差在10倍以上时可以用此法分离。
例如某样品中有大、中、小三个组分,用差速离心法分离时,把样品放在离心管内,先按大组分的沉降系数选择离心转速和离心时间,当离心结束时正好使大组分全部沉降到离心管底部,这时中小组分中的一部分也会沉降到底部。
若原始样品液中三个组分的含量相等,则在原始样品液中大组分占总组分量的三分之一。
通过一次离心后分离出的大组分沉淀占总组分量约90%。
如要进一步提纯可以把此沉淀物再溶解,再按大组分的沉降条件离心,得到大组分的第二次离心沉淀。
通过多次对沉淀和上清液差速离心,可以把三个沉降系数有差别的组份分离提纯,所以这个方法又称为分步离心法。
2.差速离心法的优缺点差速离心法的优点是样品的处理量较大,可用于大量样品的初分离。
其缺点是分离复杂样品和要求分离纯度较高时,离心次数多,操作繁杂。
由于沉淀的多次清洗、溶解、再沉淀,容易引起中间损失,所以离心分辨力差。
实际分离时由于离心时的对流、扩散和收取沉淀时的污染,对于一些沉降系数相差不大的组分无法进行完全的分离提纯。
产品的纯度和回收率都达不到上述理论值。
因此差速离心法主要用于大量样品的初步分离提纯。
二、密度梯度离心法密度梯度离心法又称为区带离心法,可以同时使样品中几个或全部组分分离,具有良好的分辨率。
离心时先将样品溶液置于一个由梯度材料形成的密度梯度液体柱中,离心后被分离组分以区带层分布于梯度柱中。
1.工作原理不同颗粒之间存在沉降系数差时,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带的方法。
分离细胞器的方法

分离细胞器的方法细胞器是细胞内的重要结构,它们在细胞的生存和功能执行中起着至关重要的作用。
分离细胞器是细胞生物学和生物化学研究中的重要操作,可以帮助科研人员更好地了解细胞器的结构和功能。
下面将介绍几种常用的分离细胞器的方法。
一、差速离心法。
差速离心法是一种常用的分离细胞器的方法,通过利用细胞器的不同密度来进行分离。
首先,需要将细胞悬液置于离心管中,然后进行低速离心,使细胞器沉淀到离心管底部。
接下来,将上清液转移到另一个离心管中,进行高速离心,这样可以将不同密度的细胞器分离出来。
通过这种方法,可以获得相对纯净的细胞器样品。
二、梯度离心法。
梯度离心法是利用密度梯度离心离心细胞器的方法。
首先,需要制备密度梯度离心液,然后将细胞悬液均匀地加在离心管上,进行超速离心。
在离心过程中,不同密度的细胞器会在密度梯度中分层沉淀,从而实现分离。
这种方法可以得到高纯度的细胞器。
三、超声破碎法。
超声破碎法是一种利用超声波对细胞进行破碎,分离细胞器的方法。
首先,将细胞悬液置于超声破碎仪中,经过超声波的作用,细胞膜会破裂,释放出细胞器。
然后,通过差速离心或梯度离心的方法,可以将细胞器分离出来。
这种方法操作简单,适用于一些对纯度要求不高的实验。
四、亲和层析法。
亲和层析法是利用生物分子之间的特异性相互作用来分离细胞器的方法。
通过将含有特定亲和基质的层析柱与混合细胞器悬液一起进行层析,利用细胞器与亲和基质之间的特异性结合来实现细胞器的分离。
这种方法可以得到高纯度的细胞器样品,适用于对细胞器纯度要求较高的实验。
五、离心上清法。
离心上清法是一种简单快捷的分离细胞器的方法。
首先,将细胞悬液进行差速离心,将上清液收集起来。
然后,通过连续的离心步骤,可以逐渐将不同密度的细胞器分离出来。
这种方法操作简单,适用于一些对纯度要求不高的实验。
总结。
以上介绍了几种常用的分离细胞器的方法,每种方法都有其特点和适用范围。
在实际操作中,可以根据实验的需要选择合适的方法进行细胞器的分离,以获得满意的实验结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
差速离心法和密度梯度离心法的区别
教学问题:高中生物必修1中研究细胞器的分离方法是差速离心法,必修2中研究DNA复制方式——半保留复制的方法是密度梯度离心法,两者之间有什么区别?
一、差速离心法
差速离心法是交替使用低速和高速离心,用不同强度的离心力使具有不同质量的物质分级分离的方法。
此法适用于混合样品中各沉降系数差别较大组分的分离。
1.工作原理
通常两个组分的沉降系数差在10倍以上时可以用此法分离。
例如某样品中有大、中、小三个组分,用差速离心法分离时,把样品放在离心管内,先按大组分的沉降系数选择离心转速和离心时间,当离心结束时正好使大组分全部沉降到离心管底部,这时中小组分中的一部分也会沉降到底部。
若原始样品液中三个组分的含量相等,则在原始样品液中大组分占总组分量的三分之一。
通过一次离心后分离出的大组分沉淀占总组分量约90%。
如要进一步提纯可以把此沉淀物再溶解,再按大组分的沉降条件离心,得到大组分的第二次离心沉淀。
通过多次对沉淀和上清液差速离心,可以把三个沉降系数有差别的组份分离提纯,所以这个方法又称为分步离心法。
2.差速离心法的优缺点
差速离心法的优点是样品的处理量较大,可用于大量样品的初分离。
其缺点是分离复杂样品和要求分离纯度较高时,离心次数多,操作繁杂。
由于沉淀的多次清洗、溶解、再沉淀,容易引起中间损失,所以离心分辨力差。
实际分离时由于离心时的对流、扩散和收取沉淀时的污染,对于一些沉降系数相差不大的组分无法进行完全的分离提纯。
产品的纯度和回收率都达不到上述理论值。
因此差速离心法主要用于大量样品的初步分离提纯。
二、密度梯度离心法
密度梯度离心法又称为区带离心法,可以同时使样品中几个或全部组分分离,具有良好的分辨率。
离心时先将样品溶液置于一个由梯度材料形成的密度梯度液体柱中,离心后被分离组分以区带层分布于梯度柱中。
1.工作原理
不同颗粒之间存在沉降系数差时,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带的方法。
介质梯度应预先形成,介质的最大密度要小于所有样品颗粒的密度。
常用的有蔗糖、甘油。
密度梯度液的制备用梯度混合器,形成由管口到管底逐步升高的密度梯度。
2.密度梯度离心法的优缺点
密度梯度离心法的优点是分离效果好,可一次性获得较纯净颗粒,适应范围广,颗粒不会挤压变形,能保持颗粒活性。
缺点是离心时间长,需要制备惰性梯度介质溶液,操作严格,不易掌握。
三、密度梯度离心法和差速离心法的区别
1.差速离心法是用不同强度的离心力使具有不同质量的物质分级分离,密度梯度离心中单一样品组份的分离是借助于混合样品穿过密度梯度层的沉降或上浮来达到的。
2.差速离心用两个甚至更多的转速,而密度梯度离心只用一个离心转速。
3.差速离心是适用于混合样品中各沉降系数差别较大组分,而密度梯度离心的物质是密度有一定差异的。
