氧族元素通性
第15章 氧族元素

15-1-1氧族存在 氧(Oxygen)地球含量最多的元素。 除氧外,其余元素(单质在标准状况下均为固体)主 要以化合态形式存在。 15-1-2氧族元素的基本性质 非金属到金属的完整过渡。 价层电子构型为ns2np4。 氧的第一电子亲和能及单键键能反常小。 氧可使用p-p π键形成强的双键(如CO2、HCHO等分 子),而硫、硒、碲除了有-2氧化数外,因均有可供 成键的空d轨道,能形成+Ⅳ或+Ⅵ等氧化态的化合物。
3、可以形成一个共价双键。
4、硫原子有空的3d轨道,3s和3p中的电子可以跃迁 到3d轨道参与成键,形成氧化数高于的正氧化态。
5、从单质硫的结构特征来看,它能形成-Sn-长硫链。 15-3-2 硫化物和多硫化物 一、硫化氢 硫化氢有臭鸡蛋味,有毒,对大气能造成污染。 饱和硫化氢水溶液的浓度为0.1 mol/L。 硫化氢是常用的还原剂,其水溶液易渐渐被空气中的 氧气氧化,所以要现用现配。 1. 实验室制法 FeS+H2SO4(稀)=FeSO4+H2S↑ 2. 结构 与H2O相似,但极性弱、无氢键。
臭氧是淡蓝色的气体,有一种鱼腥臭味,不稳定,但 在常温下分解较慢,437K以上迅速分解。 二氧化锰、二氧化铅、铂黑等催化剂的存在或经紫外 辐射都会促使臭氧分解,臭氧分解时放出热量: 2O3=3O2 rHө = -284 kJ· -1 mol 臭氧比氧有更大的化学活性,无论在酸性或碱性条件 下都比氧气有更强的氧化性 臭氧是最强氧化剂之一。除金和铂族金属外,它能氧 化所有的金属和大多数非金属。 2KI+H2SO4+O3= I2+O2+H2O2+K2SO4 该反应可用于检验混合气体中是否含有臭氧。
臭氧的结构臭氧分子中有Π34离域Π键。
氧族元素
Fe3+还原成 Fe2+ 的电位为 +0.77V,此值在 H2O2 还原成 H2O 和 O2 还原成 H2O2 的两个电位之间,因而催化分解反应可能发生, 我们可以通过下述计算作证明,从 Fe3+ 还原为 Fe2+ 的方程式和电 位减去 O2 还原成 H2O2 的方程式和电位得: 2 Fe3+ (aq) + H2O2 (aq) = 2 Fe2+ (aq) + O2(g) + 2 H+(aq) E = +0.07V E>0说明反应从热力学上是有利的,再从 H2O2 还原成 H2O 的 方程式和电位减去 Fe3+ 还原为 Fe2 +的方程式和电位得:
3、氧化物(Oxide)
(1)存在:大多数元素的氧化物均已知,而且不止一种二元 化合物,除了较轻的稀有气体外; (2)类型: 酸性、碱性、两性、中性氧化物 大多数非金属氧化物和某些高氧化态的金属氧化物均显 酸性;大多数金属氧化物显碱性; 一些金属氧化物(如Al2O3、ZnO、Cr2O3、Ga2O3等)和少 数非金属氧化物(如As4O6、Sb4O6、TeO2等)显两性; 不显酸碱性即呈中性的氧化物有NO、CO等。 氧化物酸碱性的一般规律:同周期各元素最高氧化态的氧化 物,从左到右碱性——两性——酸性。
HO B HO O O O O B OH OH
过硼酸钠的结构见图,而过碳酸盐实际上是碳酸钠的 过氧化氢合物 Na2CO3· 1.5H2O2。这两种无机过氧化物主要 用于洗涤剂组分,有些工厂间歇式地交替生产两种产品。 工业上以硼砂为原料按两步法制备过硼酸钠: Na2B4O7 + 2 NaOH = 4 NaBO2 + H2O 2 NaBO2+2 H2O2 + 6 H2O = Na2B2O4 (OH)4 · 2O 6H 过氧化钠主要用于采矿业,过二硫酸盐产量的 65%以上 用做聚合反应引发剂,以生产聚丙烯腈和乳液聚合的聚氯乙 烯等。
大学无机化学氧族元素课件

大学无机化学氧族元素课件
主要内容
第15章 氧族元素
§15.1 氧族元素通性 §15.2 氧及其化合物 §15.3 硫及其化合物
Inorganic Chemistry
15.1 氧族元素通性 思考: 1. 氧族元素在自然界中以何种形态存在?
氧和硫的成键特征有何不同?
2.硫、硒、碲在形成化合物时在价键上与氧 有何不同?为什么?
O3 + H2O + 2e- O2 + 2OH- B = 1.24V
O3 2I- 2H I2 O2 H2O
上述反应可用于检验氧气中是否存在臭氧。
习题15-2
Inorganic Chemistry
1臭5.2氧氧空及洞其改化合变物了智利最南部人们的生活方式
彭塔阿雷纳斯上空的彩 虹,在这样美好的天气人们 同样要小心防护自己。
15.2 氧及其化合物
1. O3分子有何结构特点?
O2的同素异形体
O OO
••
Π4 3
惟一极性单质
Inorganic Chemistry
O OO
中心O:sp2杂化形成 键角:117o;键长:128pm μ=1.8×10-30C•m
15.2 氧及其化合物
2.比较O3和O2的价键结构,说明为什 么氧化性O3>O2,热稳定性O3<O2?
中性氧化物有NO 、CO等。
Inorganic Chemistry
15.2 氧及其化合物
氧化物酸碱性的一般规律是: 同周期各元素最高氧化态的氧化物从左到
右由碱性——两性——酸性 相同氧化态的同族各元素的氧化物从上到
下碱性依次增强 同一元素能形成几种氧化态的氧化物, 酸性
第十五章氧族元素

相同氧化态的同族元素的氧化物从上到下碱性依次增强:
同一元素能形成几种氧化态的氧化物,其酸性随氧化数的升高而增强
As4O6 两性 As2O5 酸性
PbO 碱性 PbO2 两性
氧化物的酸碱性因变价而发生递变在d过渡元素中更为常见,如CrO(碱性), Cr2O3(两性),CrO3(酸性)。稀土元素随原子序数的增大,碱性减弱。
脱色剂,饮水消毒剂。雷雨后,放电产生的微量臭氧,消 毒杀菌,刺激中枢神经,加速血液循环(<1mg/L)
15-2-2氧化物
酸碱性:大多数非金属和某些高氧化态的金属氧化物显酸性;大多数金 属氧化物显碱性;部分金属氧化物(Al2O3、ZnO、 Cr2O3、Ga2O3等) 和少数非金属氧化物(As4O6、Sb4O6、TeO2)显两性;也有中性(NO、 CO)。
臭氧的制备 无声放电:
臭氧含量越3%-10%,利用沸点差异分级液化获得纯净臭氧
臭氧分子结构
臭氧的分解:室温下分解缓慢,紫外辐射、催化剂(MnO2、 PbO2和铂黑可促进分解)
2O3=3O2;rH=-284kJ•mol-1 rG=-326kJ•mol-1
放热反应
臭氧的强氧化性(比氧气强):
CN-+O3OCN-+O2 2NO2+O3 N2O5+O2 PbS+4O3 PbSO4+O2 2Co2++O3+2H+ 2Co3++O2+H2O 臭氧的碘量法测定:O3+2I-+H2O O2+I2+2OH应用:工业废水处理(对有机物的强氧化性),污水净水剂,
氧气反应活性很高,室温或加热条件下可剧烈氧化除W、Pt、Au、Ag、 Hg和稀有气体外的其它元素。如遇活泼金属还可以形成过氧化物。
无机化学氧族元素全解

O3结构:
•• Π 4 3
中心O:sp2杂化形成
未杂化的三个 p 轨道互相平 行,以“肩并肩”的方式相 互重叠,形成三中心四电子 大πΠ键 。
键角:117o
μ=1.8×10-30C•m
惟一极性单质
4 3
中
的
成键电子
不固定在
2
个原子之
间,是不
定或离域大π键。
臭氧分子中无单电子——反磁性物质。
7
大π键形成条件
2、 硫化氢和硫化物
硫化氢 结 性构质::HH2S2S是结无构色与,H有2O腐相蛋似味,剧毒气体。稍 溶于水,室温时饱和浓度为 0.1mol·L-1。水溶液 呈酸性,为二元弱酸。
最重要的性质是它的还原性:
0.3002V
A SO24- 0.1576V H2SO3
与空2气H 2(SO+2)3反O 2应:完全
过氧化物
含氧酸
+ H2O2(浓) →
含氧酸盐
过氧酸 过氧酸盐
(易水解为H2O2)
例如:H2SO4+H2O2(浓) → H2SO5+H2O
含氧酸去羟基,剩余部分为酰基。如,HO-SO2(含羟硫酰基)H-O-O-H中 H 被酰基取代得过氧酸,
取代一个氢称过一酸,取代两个氢称过二酸。 11
12.4 硫及其化合物
熔 沸 点:
单质Te
H2O H2S H2Se H2Te
小
大
大
小
弱
强
最高 小
大
3
氧族元素的标准电极电势图
氧气是一个较好的氧化剂。
4
12.2 氧和臭氧
1. 氧( O2)
氧是无色无味的气体,在90K时凝聚为淡蓝色 的液体,冷却到54K时凝结为蓝色的固体。氧在水 中的溶解度很小,在193K时,1L水中只能溶解 30mL的氧气。
15章氧族元素--09

过氧化氢
4、H2O2的检验 、
O O
O Cr
O O
在酸性溶液中过氧化氢能使重铬酸盐生成二过氧 合铬的氧化物, 生成的CrO5显 合铬的氧化物,即Cr(O2)2O或CrO5,生成的 或 蓝色,在乙醚中比较稳定,检验时在乙醚层中显蓝色, 蓝色,在乙醚中比较稳定,检验时在乙醚层中显蓝色, 可以相互检验。 可以相互检验。 4H2O2+H2Cr2O7===2Cr(O2)2O+5H2O 2Cr(O2)2O+7H2O2+6H+===2Cr3++7O2↑+10H2O
氧和臭氧
氧的同素异形体是O 氧的同素异形体是 2和O3。 由于氧分子中有两个成单电子,并且处于反键 由于氧分子中有两个成单电子,并且处于反键 氧分子中有两个成单电子 轨道, 轨道,所以氧分子可以获得或失去电子而形成分子 离子。它可形成四种O 离子。它可形成四种 22-、O2-、O2+、O22+(离子化 离子化 合物是难形成的)。 合物是难形成的)。 带负电荷的称为负氧离子, 带负电荷的称为负氧离子,有“空气维生素” 空气维生素” 之冠称。如海边、 之冠称。如海边、瀑布和喷泉处顿时觉得空气格外 新鲜,这是由于那里含有较丰富的负氧离子, 新鲜,这是由于那里含有较丰富的负氧离子,它能 影响中枢神经系统,促进人体的新陈代谢, 影响中枢神经系统,促进人体的新陈代谢,使组织 氧化过程加快,能消除疲劳。 氧化过程加快,能消除疲劳。
氧在化合物中的成键特征
电子提供物 成键情况 O2-离子型
O
实例 Na2O,CaO 或
O ..
H2O, H3O+ R2C=O
Sp3杂化 O原子 原子
O
:O
Sp杂化 杂化
氧族元素及其化合物

2Ag+2O3 →Ag2O2+2O2
氧族元素及其化合物
臭氧能迅速且定量地把I-氧化成I2,常利用该反应来测定O3的 含量,称之为碘量法。
臭氧具有强氧化性和不易导致二次污染的优点,因此常用作消毒杀 菌剂、空气净化剂和漂白剂等。在废气净化领域,可以利用臭氧氧化废 气中二氧化硫,并制得硫酸以回收利用;在废水处理领域,臭氧可氧化 废水中的有机物,通常与传统水处理技术进行组合,以满足废水深度净 化的要求。
在实验室里,可以将过氧化钠加到冷的稀硫酸或稀盐酸中来制备 H2O2:
Na2O2+H2SO4+10H2O →Na2SO4·10H2O+H2O2 工业上制备过氧化氢,目前主要有电解法和蒽醌法两种方法。
氧族元素及其化合物
三、 硫及其重要化合物 1. 单质硫
单质硫有几种同素异形体,最常见的是正交硫和单斜硫。当 加热到368.6 K时,正交硫不经熔化就转变成单斜硫,当把它冷 却时,就发生相反的转变过程,所以368.6 K是正交硫与单斜硫 之间的平衡转变点:
无机化学
氧族元素及其化合物
一、 氧族元素的通性
周期表第ⅥA族包括氧(O)、硫(S)、硒 (Se)、碲(Te)、钋(Po)五种元素,通称 为氧族元素。其中硒和碲是稀有元素,钋是放射 性元素,最重要的是氧和硫两种元素。有关氧族 元素的一些性质见表8-14。
氧族元素及其化合物
氧族元素及其化合物
氧族元素和卤素相似,随原子序数的增加,原子半径和离子半径增 大,而电负性和电离能则降低。由氧向钋过渡,元素的非金属性逐渐减 弱,金属性逐渐增强,氧和硫是典型的非金属,硒和碲是两性的准金属, 钋是金属。氧族元素的非金属活泼性弱于相应的卤族元素。
第18章-2 氧簇元素(1)

•焦硫酸及其盐
☺冷却发烟硫酸时可以析出焦硫酸晶体,mp:308 K
H2SO4 + SO3 = H2S2O7
O
O
H O S O H + H O S O H -H2O
O
O
➢具有比浓硫酸更强的氧
+ H2O
O
O
化性、吸水性和脱水性。 H O S O S O H
熔点以上
2KHSO4
O
O
Fe2(SO4)3 + 3K2SO4
K2S2O7 + H2O
更高温度
分析
K2SO4 + SO3
✓过氧键(-O-O-)
✓过一硫酸 在无水条件下:
HOOH + ClSO2(OH) =HOOSO2(OH) + HCl
✓过二硫酸
(NH4)2S2O8和K2S2O8,
钢铁分析 MnO4-
K2SO4 + SO3 + O2
•连多硫酸
➢H2SxO6,x = 3~6;连“几”硫酸 ➢盐的阴离子:[O3SSySO3]2-, y = 1~4。 ➢有硫链,游离的连多硫酸不稳 定,不存在酸式盐。 ➢用适当氧化剂与硫代硫酸钠反应可制得
•氧气的反应活性很高
➢直接氧化 与所有元素形成氧化物,除W、Pt、 Au、Ag、Hg和稀有气体以外;
•氧气的反应活性很高
➢过氧化物(O22-)或超氧化物(O2-) 遇活泼金属可形 成。 ➢与化合物直接作用 在适当条件下,许多无机物(如 H2S、CO等)和所有有机物。 ➢配位作用 氧作为配体与血红蛋白的作用 ➢制备 实验室加热分解KClO3(MnO2为催化剂)、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧族元素通性 王振山氧族元素指周期系第ⅥA 族元素,它包括氧(O )、硫(S )、硒(Se )、碲(Te )、钋(Po)五个元素。
除O 之外的S ,Se ,Te ,Po 又称硫族元素。
其中氧是地壳中含量最多的元素,约占总质量的48.6%;硫在地壳中的含量只有0.052%,居元素丰度第16位,但在自然界的分布很广。
氧元素在地球上的丰度最高,达58%(以mol 计),16O(993759%),17O(0.037%),18O(0.204%);14O ,15O ,19O 为人工合成的同位素,t 1/2为数十秒。
元素在地壳中的存在形式比较复杂,只有少数能以单质存在,例如,氧和硫在自然界大量以游离态单质状态存在,其余均为化合物。
化合物主要有氧化物和硫化物两大类。
地质学上称前者为亲石元素,后者为亲硫元素。
硒、碲则有稀有元素,单质为准金属,通常以硒化物,碲化物存在硫化矿床中;钋则是典型金属元素,是一种放身性元素,存在于含铀和钍的矿床中。
(S 有四种同位素: 32, 33, 34, 35)氧族元素通性氧族元素(ⅥA 族):O 、S 、Se 、Te 、Po ,非金属、准金属、金属。
氧族元素的一些基本性质表从表可以看出,氧族元素的性质变化趋势与卤素相似。
氧族元素的金属性、原子半径、离子半径、熔点、沸点随原子序数增加而增大;电负性、电离能随原子序数增加而减小。
氧族元素原子的价层电子构型均为ns 2np 4,有获得2个电子达到稀有气体稳定结构的趋势。
当氧族元素原子和其他元素化合时,如果电负性相差很大,则可以有电子的转移。
例如,氧可以和大多数金属元素形成二元离子化合物,硫、硒、碲只能和低价态的金属形成离子型的化合物。
当氧族元素和高价态的金属或非金属化合时,所生成的化合物主要为共价化合物。
氧和硫的性质相似,都活泼。
氧能与许多元素直接化合,生成氧化物,硫也能与氢、卤素及几乎所有的金属起作用,生成相应的卤化物和硫化物。
不仅氧和硫的单质的化学性质相似,它们的对应化合物的性质也有很多相似之处。
一、氧族元素1、原子结构和元素的性质 ⑴、原子结构*原子结构三要素:原子的电子层结构,原子半径,有效核电荷数。
⑵、元素的性质 ①、元素性质的递变②、硫分族(硫、硒、碲)*元素的金属性与非金属性的含义(孤立的原子在化学反应中的性能)。
例如,元素的非金属性强弱,是指元素的原子得电子能力的强弱。
*原子结构、元素在周期表中的位置、元素的性质,三者之间的关系。
③、氧族元素的非金属活泼性弱于卤素氧族元素的原子获得两个电子形成简单阴离子X 2-的倾向,比卤素原子形成X -的倾向要小得多。
例如,S 元素的非金属性[*氧元素的电负性(Pauling)=3.44,仅次于氟(3.98);氯(3.16),硫(2.58)。
] 2、成键特征:⑴、本族元素价电子层结构为:ns 2np 4nd 0如SF 6,均有获得2个电子的趋势,故常见氧化数为-2。
大多数金属氧化物是离子型的,含有O 2-离子,而S ,Se ,Te 形成的化合物离子性超过50%的为数则很少,因此在这些元素形成的化合物中,多为共价化合物。
⑵、氧的成键特点: ①、O原子a 、离子键O2-如:Na 2O(与电负性较小的元素),b 、共价键(与其电负性相近的元素),c 、OO <F S <Cl<原子电负性大、半径小,生成双键(CO 2),d 、O 原子可以与其它原子以三重键结合(CO ,NO), e 、可以作为配位原子形成配合物。
f 、O 原子可以把两个自旋相反的单电子归并,空出一个2P 轨道接受外来配位电子而成键;另外氧的孤电子对反馈到中心原子空的d 轨道形成d-p 反馈∏键(PO 43-,SO 42-) ②、O 2分子a 、O 22-,—O —O —过氧化物,Na 2O 2,K 2O 2)b 、O 2-(超氧化物,KO 2)c 、O 2+,生成二氧基阳离子化合物,2O 2+F 2+2AsF 5=2O 2+[AsF 6]-,O 2+Pt+3F 2=O 2+[PtF 6]-ee 思考:O 2+,O 2,O 2-,O 22-的分子轨道表示式及键级③、O 3分子 离子键O 3-,KO 3臭氧化钾。
⑶、单线态氧及性质:S=1:2S+1=3;S=0:S+1=1。
S 自旋量子数的合量通常所说的单线态氧就是指1△g(1O 2),单线态氧的生成可以通过光敏化法,微波放电法,化学方法。
敏化剂(基态)→敏化剂T 1(激发态),敏化剂T 1+3O 2 能量传递敏化剂+1O 2A(有机作用物) +1O 2→AO 2(产物)在化学方法中最常用的是H 2O 2-ClO -法:H 2O 2+ClO -→1O 2+H 2O+Cl - 单线态氧在有机体的代谢中会不断的生成与猝灭,并且在多种生理及病理生理过程中起作用。
(好坏两方面)⑷、与卤族元素相比:本族元素:价电子排布式n s 2n p 4,比ⅦA 元素相应的原子在p 轨道上少一个电子。
因此,本族元素的原子获得两个电子形成X 2-的倾向较卤素原子形成X -的倾向小得多,因为氧族元素的原子结合第二个电子是需要吸收能量的(E A2为正值)。
本族除O 之外,S ,Se ,Te 形成化合物时,还可有+2,+4,+6等氧化数,氧则仅与F 这种电负性最大的元素形成化合物时有+2氧化数(OF 2),其原因是O 的电负性大,且价电子层为n=2,只能容纳8个电子,要将电子拆单成键,使氧化数高于+2,就需将电子激发到较高能层,这就需要过高的能量,而硫族元素则电负性相对较小,又有价层d 轨道的利用,它们可以拆开成对电子而生成4个或6个价键。
〔S→Te :+2,+4,+6。
(S→Te 正氧化态化合物稳定性逐渐增加)〕成键特点:①、O 、S以-2价形式形成离子型化合物。
②、同过渡元素,非金属元素化合成共价化合物。
③、O有-2(H 2O )、-1(H 2O 2)、+2(OF 2) ⑷、形成共价单键的成键方式:电子构型四面体,分子角型;+2氧化数,如SCl 2、SF 2、TeCl 2、TeBr 2。
对共价型氧化物则为-2氧化数,如:H 2O 、Cl 2O 、H 2S 。
sp杂化态E nsnpnd 基态孤对电子通常占据赤道平面上的一个位置;电子构型三角双锥,分子构型畸变的四面体,形成+4氧化数,如TeF 4、TeCl 4、TeBr 4、TeI 4、SeF 4。
E nsnpnd激发态1杂化态1d电子构型八面体,分子构型亦为八面体,+6氧化数,如SF 6。
E nsnpnd激发态2 杂化态2sp 3d 2与卤素含氧酸一样,在S ,Se ,Te 的含氧酸及其盐中,中心原子采取SP 3杂化,形成d-pπ配键,但其中碲酸H 6TeO 6则与碘酸类似,中心原子也取sp 3d 2杂化,为正八面体结构。
3、重要性质递变规律〔r ,Ⅰ,Ⅹ:变化规律与ⅦA 相同;电子亲合势:A 12 A 1(-)A 2(+)〕 ⑴、原子共价半径,离子半径(-2,+6),单质的熔沸点从O-Te 递增,非极性分子色散力随分子量递增(S ,Se ,Te 为多原子分子)。
⑵、I 1、E A1、E A2、χ(电负性)从O-Te 递减,但O 的E A1与F 在卤素中类似,出现反常。
⑶、S→Te :+2,+4,+6。
(S→Te 正氧化态化合物稳定性逐渐增加)⑷、单质的键离解能书中指单键,O-O 键反常地小,与其r 特别小有关(因分子组成原子数不同,不作比较)。
⑸、单质的氧化性:φ:O 2/H 2O ,1.23;S/H 2S ,0.14;Se/H 2Se ,-0.99;Te/H 2Te ,-0.69; φ/V :O 2/OH -,0.401;S/S 2-,-0.476;Se/Se 2-,0.78;Te/Te 2-,-0.92。
可见从O 2-Te 呈降低趋势⑹、从O 2-Po ,非金属性──金属性 4、与卤族元素通性的比较⑴、同族从上──下,元素性质变化规律类似。
⑵、族间比较同周期氧族元素与卤素相比,电子层数不变,但从左──右有效核电数Z *e 增加,r 减小,得电子趋势增大,因此同周期的氧族元素的I 1,E A1均较卤族元素小,(单质)氧化力减弱,非金属性减弱。
从同族性质变化来看,虽然两族都是从上──下,非金属性减弱,但氧族的化性递变更明显:O 2为典型非金属,而Po 为金属。
⑶、在同族元素中,O 与F 具有类似性,即均是n=2,次外层(内层)只有2个电子,价层无d 轨道,半径特别小,故与本族其它元素相比,出现一些异常,如E A1反常,氧化力特别强,等等。
⑷、氧与硫的相似性小,而与卤素在性质上有颇多相似,如形成的金属化合物大多为离子型化合物等。
⑸、本族所有元素都存在不止一种的同素异形体,而卤素则无此特点。
二、单质⑴、氧与硫单质的结构氧与硫单质熔沸点相差很大,这是由于氧原子半径小而引起成键方式不同的缘故。
氧和硫原子的价层都有2个单电子,都可形成2个键,所以它们单质有两种键合方式:一种是两个原子之间以双键相连而形成双原子的小分子;另一种是多个原子之间以单键相连形成多原子的“大分子”。
氧单质是以小分子O 2,硫单质是以“大分子”S 8形式存在的,它们单质的分子结构分别为:O2分子结构式中表示由3个电子构成的π键,称为3电子π键。
简式表明O2分子中存在叁键,即一个σ键和两个3电子π键。
每个3电子π键中有1个未成对电子,2个π键则有2个未成对电子,并且自旋平行,致使O2表现出顺磁性。
⑵、同素异形体:①、氧单质:O2和O3;臭氧分子的构型为V型,如图所示:中心氧原子以2个sp2杂化轨道与另外两个氧原子形成σ键,第三个sp2杂化轨道被孤对电子所占有。
此外,中心氧原子的未参与杂化的p轨道上有一对孤对电子,两端的氧原子与其平行的p轨道上各有一个电子,它们之间形成垂直于分子平面的三中心四电子大π键,用∏43表示。
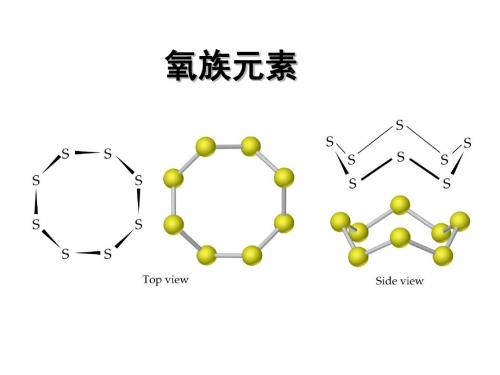
②、硫单质:单质硫有近50种同素异形体。
最常见的是斜方硫(菱形硫,又叫α-硫;确切地应称为“正交硫”—具有正交面心晶胞)和单斜硫(又叫β-硫)以及弹性硫等。
单斜硫和斜方硫的分子都是S8,它们只是晶体中分子排列不同而已。
室温下所有的晶体硫都是由S n环组成的,n可以从6到20。
室温下唯一稳定存在的形式是正交硫。
它们都易溶于CS2中,都是由S8分子组成的(在环状分子中,每个硫原子以SP3杂化轨道与另外两个硫原子形成共价单键相联结)。
对S6、S8、S12、S x等分子形成的晶体结构分析表明,分子中每个S 原子均与2个S原子成键,S-S键长206pm,∠SSS约为105°弹性硫为S8环断开后,相互聚合成长链的大分子,这些长链相互绞结,因而使其具有弹性。
③、硒单质:有三种红色单斜多晶态(无定形)物质(α、β、γ),是由Se8环组成,彼此的差别仅在分子间环的堆积不同,属于不良导体。
