第十章红外光谱分析教材
合集下载
《红外光谱解析方法》课件

确定分子结构 鉴别化合物
反应机理研究 生物大分子研究
红外光谱能够提供分子中官能团 和化学键的信息,有助于确定分 子的结构。
红外光谱可以用于研究化学反应 机理,通过分析反应前后红外光 谱的变化可以推断出反应过程和 机理。
02
红外光谱解析方法分类
Chapter
基线校正法
基线校正法是一种常用的红外光谱解析方法,主要用 于消除基线漂移和噪声干扰,提高光谱的准确性和可
傅里叶变换法
傅里叶变换法是一种通过傅里 叶变换将时域信号转换为频域 信号,从而解析红外光谱的方
法。
傅里叶变换法能够将复杂的光 谱信号分解为多个简单的正弦 波和余弦波的叠加,便于解析
和识别各种成分的特征峰。
傅里叶变换法需要高精度的光 谱仪和计算机硬件,因此成本 较高。
傅里叶变换法的优点是能够准 确解析各种成分的特征峰,适 用于复杂混合物和生物样品的 分析。
《红外光谱解析方法》ppt课件
目录
• 红外光谱解析方法简介 • 红外光谱解析方法分类 • 红外光谱解析步骤 • 红外光谱解析实例 • 红外光谱解析的未来发展
01
红外光谱解析方法简介
Chapter
红外光谱的基本原理
红外光谱的产生
红外光谱是由于分子振动和转动能级跃迁而产生的 ,不同物质具有不同的能级分布,因此红外光谱具 有特征性。
生物大分子的红外光谱解析在研究其结构和功能方面具有 重要作用。通过分析生物大分子的红外光谱,可以了解其 分子结构和分子间的相互作用,进而研究其在生命过程中 的功能和作用机制。例如,在蛋白质的红外光谱中,可以 观察到蛋白质二级结构的信息,这对于研究蛋白质的结构 和功能具有重要意义。
05
红外光谱解析的未来发展
第十章 红外光谱分析

第十章 红外吸收光谱分析
Infrared Absorption Spectrometry ,IR
2020/3/23
• 第一节 红外吸收光谱基本原理
一、红外光谱概述 二、红外吸收光谱产生条件 三、分子振动形式 四、红外光谱吸收强度
2020/3/23
一、红外光谱概述
红外吸收光谱(Infrared absorption spectroscopy, IR)又称为分子振动—转动光谱。
2020/3/23
1、红外光谱区域划分
习惯上按红外线波长,将红外光谱分成三个区域: (1)近红外区:0.78~2.5μm(12 820~4 000cm-1),主 要用于研究分子中的O—H、N—H、C—H键的振动倍频与组 频。 (2)中红外区:2.5~25μm(4 000~400cm-1),主要用 于研究大部分有机化合物的振动基频。 (3)远红外区:25~300μm(400~33cm-1),主要用于 研究分子的转动光谱及晶格的振动。
包含各种单键、双键和三键的伸缩振动及面内弯曲振动 特点:吸收峰稀疏、较强,易辨认 注:特征峰常出现在特征区 2. 指纹区: 指纹区: 1250~400cm-1的低频区,包含C—X(X:O,H, N)单键的伸缩振动及各种面内弯曲振动 特点:吸收峰密集、难辨认→指纹 注:相关峰常出现在指纹区
2020/3/23
2020/3/23
红外光谱的吸收带强度可用于定量分析,也是化合物定 性分析的重要依据。
2020/3/23
峰位、峰数、峰强 (1)峰位 化学键的力常数K越大,原子折合质量越小, 键的振动频率越大,吸收峰将出现在高波数区(短波区); 反之,出现在低波数区(长波区)。 (2)峰数 峰数与分子自由度有关。无瞬间偶基距变化 时,无红外吸收。
Infrared Absorption Spectrometry ,IR
2020/3/23
• 第一节 红外吸收光谱基本原理
一、红外光谱概述 二、红外吸收光谱产生条件 三、分子振动形式 四、红外光谱吸收强度
2020/3/23
一、红外光谱概述
红外吸收光谱(Infrared absorption spectroscopy, IR)又称为分子振动—转动光谱。
2020/3/23
1、红外光谱区域划分
习惯上按红外线波长,将红外光谱分成三个区域: (1)近红外区:0.78~2.5μm(12 820~4 000cm-1),主 要用于研究分子中的O—H、N—H、C—H键的振动倍频与组 频。 (2)中红外区:2.5~25μm(4 000~400cm-1),主要用 于研究大部分有机化合物的振动基频。 (3)远红外区:25~300μm(400~33cm-1),主要用于 研究分子的转动光谱及晶格的振动。
包含各种单键、双键和三键的伸缩振动及面内弯曲振动 特点:吸收峰稀疏、较强,易辨认 注:特征峰常出现在特征区 2. 指纹区: 指纹区: 1250~400cm-1的低频区,包含C—X(X:O,H, N)单键的伸缩振动及各种面内弯曲振动 特点:吸收峰密集、难辨认→指纹 注:相关峰常出现在指纹区
2020/3/23
2020/3/23
红外光谱的吸收带强度可用于定量分析,也是化合物定 性分析的重要依据。
2020/3/23
峰位、峰数、峰强 (1)峰位 化学键的力常数K越大,原子折合质量越小, 键的振动频率越大,吸收峰将出现在高波数区(短波区); 反之,出现在低波数区(长波区)。 (2)峰数 峰数与分子自由度有关。无瞬间偶基距变化 时,无红外吸收。
仪器分析-光谱分析法概论(第十章)

三个主要过程:(1)能源提供能量;(2)能量与被测物
质相互作用;(3)产生被检测信号。
第一节
电磁辐射及其物质的相互作用
一、电磁辐射和电磁波谱
1. 波动性(干涉、衍射、反射和折射) 用波长(nm)、波数(cm-1)和频率(Hz)表示。 =c/ = 1 / = /c
波长是在波的传播路线上具有相同振动相位的相邻两点间的线性距
光学分析法光谱分析法非光谱分析法原子光谱分析法分子光谱分析法原子吸收光谱原子发射光谱原子荧光光谱x射线荧光光谱折射法圆二色性法x射线衍射法干涉法旋光法紫外光谱法红外光谱法分子荧光光谱法分子磷光光谱法核磁共振波谱法光谱分析法吸收光谱法发射光谱法原子光谱法分子光谱法原子发射原子吸收原子荧光x射线荧光原子吸收紫外可见红外可见核磁共振紫外可见红外可见分子荧光分子磷光核磁共振化学发光原子发射原子荧光分子荧光分子磷光x射线荧光化学发光第三节光谱分析仪器光学分析法三个基本过程
原 子 发 射
原 子 吸 收
原 子 荧 光
X 射 线 荧 光
紫 外 可 见
红 外 可 见
分 子 荧 光
分 子 磷 光
核 磁 共 振
化 学 发 光
原子光谱法 光谱分析法 吸收光谱法 原 子 吸 收 紫 外 可 见 红 外 可 见 核 磁 共 振
分子光谱法
发射光谱法
原 子 发 射
原 子 荧 光
分 子 荧 光
离;波数是每厘米长度中波的数目; 频率是每秒内的波动次数。
※ 频率与波长成反比, 即波长越长, 频率越低, 波数越小
2. 微粒性(光电效应、光的吸收和发射) 用每个光子具有的能量E作为表征。 E = h =h c / = h c h (普朗克常数) , h=6.6262×10-34J•s ※ 光量子的能量(E)与波长成反比, 而与频率(或波数) 成正比.
红外光谱法PPT教学课件
方法名称
原子发射光谱法 原子荧光光谱法 分子荧光光谱法 分子磷光光谱法 化学发光法 X射线荧光分析
激发方式
电弧、火花、等离子炬等 高强度紫外、可见光 紫外、可见光 紫外、可见光 化学能 X射线(0.01—2.5nm)
作用物质或机理
气态原子的外层电子
检测信号
紫外、可见光
气态原子的外层电子
原子荧光
分子
荧光(紫外、可见光)
分子
磷光(紫外、可见光)
分子
可见光
原子内层电子的逐出,外层能级电 子跃入空位(电子跃迁)
特征X射线(X射线荧光)
荧光光谱法
当一种吸收物质吸收电磁辐射后跃迁到高能态,它的 寿命约为10-10~10-9秒,在一般情况下,受光激发的粒子与 系统中的其它粒子有一系列碰撞并将激发能转化为热,此 为无辐射跃迁。某些情况下,被电磁辐射激发到高激发态 的粒子很快通过碰撞失去振动能到达第一电子激发态的最 低振动能级,然后发射电磁辐射回到基态。
∆E=hc/λ 所以各种粒子吸收线的波长或频率不同。因此.对吸收线波长 及强度的研究,可以提供样品的性质,结构及含量的信息。 根据吸收光谱所在的光谱区域及吸收粒子的差别,主要可分为: 紫外—可见吸收光谱法、原子吸收光谱法及红外光谱法,此外还有 核磁共振波谱法及X射线吸收光谱法。
各类吸收光谱法的主要特点
可见光
光学分析方法分类
光学分析法分为光谱法和非光谱法两类。 光谱法是电磁波与物质作时,引起分子或原子内部量子化能级跃 迁而产生发射、吸收、散射或荧光,通过检测这些光谱的特征波长 和强度来进行定性定量分析。这类方法包括:原子吸收、原子发射、 原子荧光、紫外可见、红外光谱、分子荧光、分子磷光、核磁共振 等等。 非光谱法则是通过测量电磁波与物质作用时,电磁波的某些其他 性质,如反射、折射、散射、干涉、衍射和偏振等变化而建立。这 类方法有折射法、干涉法、散射浊度法、旋光法、圆二向色性法、X 射线衍射法和电子衍射法等。
第10章 红外吸收光谱分析
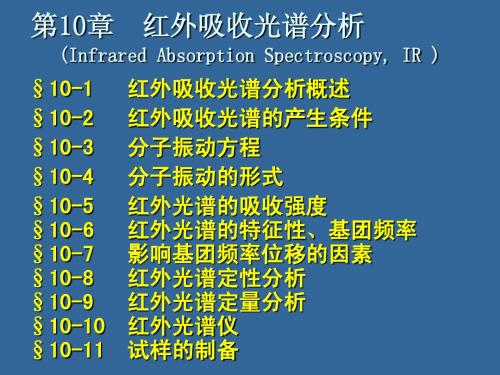
醛在2820和2720 cm-1附近的特征峰,后者尖锐易辨别。
醛:
特征1:醛羰基ν(C=O):~1725 cm-1。 特征2:2820 cm-1 和 2720 cm-1 弱的双峰。
酮:
酮羰基ν(C=O):1710~1715 cm-1。
脂类:C=O吸收峰:1725 ~ 1750 cm-1 ,强。
红外光谱信息区
常见的化学基团在4000 670 cm-1范围内有特征频率, 为便于记忆,常依据基团的振动形式,分为四个区: (1)4000 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) (2)2500 2000 cm-1 三键,累积双键伸缩振动区 (3)2000 1500 cm-1 双键伸缩振动区
上述用经典力学的方法来处理分子的振动是为了得 到宏观的图像,便于理解并有一定性概念。但一个
真实的微观粒子需要用量子理论方法加以理解,如
能量量子化。
实际上,在一个分子中,基团与基团间,基团中的 化学键之间都相互有影响,因此基本振动频率除了
决定于化学键两端的原子质量、化学键的力常数外, 有关。
还与内部因素(结构因素)及外部因素(化学环境)
倍频、合频和差频统称为泛频。
二、红外光谱的特征性
红外光谱的最大特点是具有特征性。
大多有机物的红外光谱基本上是C、H、O、N等元素
所形成化学键的振动贡献的。
基团特征频率
与一定结构单元相联系的、固定在一定范围内出现的 化学键振动频率——基团频率(特征峰)。
例: 2800 3000 cm-1 —CH3 特征峰;
在该区域出现的峰较少。
(1)RC CH
(2100 2140 cm-1 )
RC CR' (2190 2260 cm-1 ) R=R' 时,无红外活性 (2)RC N (2100 2140 cm-1 ) 非共轭 2240 2260 cm-1 共轭 2220 2230 cm-1 仅含C、H、N时:峰较强、尖锐; 有O原子存在时,O越靠近C N,峰越弱。
醛:
特征1:醛羰基ν(C=O):~1725 cm-1。 特征2:2820 cm-1 和 2720 cm-1 弱的双峰。
酮:
酮羰基ν(C=O):1710~1715 cm-1。
脂类:C=O吸收峰:1725 ~ 1750 cm-1 ,强。
红外光谱信息区
常见的化学基团在4000 670 cm-1范围内有特征频率, 为便于记忆,常依据基团的振动形式,分为四个区: (1)4000 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) (2)2500 2000 cm-1 三键,累积双键伸缩振动区 (3)2000 1500 cm-1 双键伸缩振动区
上述用经典力学的方法来处理分子的振动是为了得 到宏观的图像,便于理解并有一定性概念。但一个
真实的微观粒子需要用量子理论方法加以理解,如
能量量子化。
实际上,在一个分子中,基团与基团间,基团中的 化学键之间都相互有影响,因此基本振动频率除了
决定于化学键两端的原子质量、化学键的力常数外, 有关。
还与内部因素(结构因素)及外部因素(化学环境)
倍频、合频和差频统称为泛频。
二、红外光谱的特征性
红外光谱的最大特点是具有特征性。
大多有机物的红外光谱基本上是C、H、O、N等元素
所形成化学键的振动贡献的。
基团特征频率
与一定结构单元相联系的、固定在一定范围内出现的 化学键振动频率——基团频率(特征峰)。
例: 2800 3000 cm-1 —CH3 特征峰;
在该区域出现的峰较少。
(1)RC CH
(2100 2140 cm-1 )
RC CR' (2190 2260 cm-1 ) R=R' 时,无红外活性 (2)RC N (2100 2140 cm-1 ) 非共轭 2240 2260 cm-1 共轭 2220 2230 cm-1 仅含C、H、N时:峰较强、尖锐; 有O原子存在时,O越靠近C N,峰越弱。
第十章 红外光谱分析

例如: 例如:H2O
△µ≠0 偶极矩变化 吸收红外辐射,产生红外吸收光谱, 红外活性的分子。 吸收红外辐射,产生红外吸收光谱,是红外活性的分子。 红外辐射
第三节
分子振动方程式
一、双原子分子的振动——简谐振动 双原子分子的振动——简谐振动 ——
根据原子质量和相对原子质量之间的关系,上式可写成: 根据原子质量和相对原子质量之间的关系,上式可写成: 原子质量 之间的关系 NA ⌠= 2πC
1 2
k Μ
NA:阿伏加得罗常数, NA=6.022 ×1023 阿伏加得罗常数, M: 两个原子的折合相对原子质量; 两个原子的折合相对原子质量; M= M1·M2 M1+ M2 k Μ
⌠= 1303
二、影响基本振动频率因素
● ●
⌠= 1303
相对原子质量 化学键的力常数。 化学键的力常数
k Μ
⌠= 2062 cm-1 ⌠= 1683 cm-1 ⌠= 1190 cm-1
对于具有相似质量的原子基团, ⌠Κ 对于具有相似质量的原子基团,
键的力常数相近, 例: C-C、C-O、C-N键的力常数相近, 相对折合质量不同, 相对折合质量不同,MC-C < MC-N < MC-O C-C C-O C-N K K K M C-C M C-N M C-O σ= 1430 cm-1 σ= 1330 cm-1 σ= 1280 cm-1
原子的折合质量为: 解:C 原子和 H 原子的折合质量为: M= M1·M2 M 1+ M 2 5
0.923
=
12×1 × 12+ 1 =3030cm-1
= 0.923
⌠= 1303
例:
C C C
≡ = −
红外光谱-10-15

18
(2) 空间位阻 使共轭受限制,基团频率向高频移动。
C O 1663 cm-1
H3C
CO
CH3 O
C H
CH3
1680 cm-1
2020/2/4
C O 1715 cm-1
H3C
CO
CH3 C
CH3
O CH3
1700 cm-1
19
(3) 环张力 当环变小,环的张力增大时,环内双 键的伸缩振动向低频移动,而环外双键的伸缩振 动向高频移动。
HCOOH C=O 1739 cm-1
CH3COOH 1722 cm-1
CH3(CH3)16COOH 1703 cm-1
2020/2/4
14
-I效应 取代基电负性↑→电子分布改变→k↑→ 蓝移
如C=O:随着取代基电负性增大,-I效应增加,使羰基双 键性增加(化学键力常数增加)学键,不管分子中其 他部分的结构如何,它总是在相同或几乎相同的波数处产生 特征的吸收谱带,除光学异构体及长链烷烃同系物外,几乎 没有两种化合物具有相同的IR谱图。
2020/2/4
2
• 红外区域的划分:
近红外区: 中红外区: 远红外区:
波长(m) 0.78 ~ 2.5 2.5 ~ 25 25 ~ 300
O RCX
O RCX
C=O 1715 cm-1 1800 cm-1
1828 cm-1
1928 cm-1
C=O 1715 cm-1
2020/2/4
1735 cm-1
1800 cm-1
1870 cm-1
15
2. 共轭效应(C效应) 分子中形成大π键
共轭体系中的电子云密度平均化,使双键略有伸长(键强 降低,电子云密度降低),单键略有缩短。因此,双键的 吸收频率向低波数方向位移。 红移
第10章红外吸收光谱

V
h 2π
κ μ
当△V =1时,0→ 1振动能级的跃迁,称为基本振动频率 或基频吸收带。
由双原子分子振动方程式可以看出,折合质量和键力常 数是影响基本振动频率的直接因素。
K 越大,μ越小,化学键的振动频率越高,吸收峰将出
现在高波数区;反之,则出现在低波数区。
11
例1: 由表中查知 C=C 键的 k= 9.5 ~9.9 (N/cm) ,令其为9.6, 计
分子振动不会引起偶极矩的变化。 19
(2)物质与红外辐射间应能相互作用,这种相互作用 称为振动耦合。具有偶极矩变化的分子才有可能发生振 动耦合,吸收红外辐射。
电 场
无偶极矩变化
无红外吸收
磁
场
红外吸收
交变磁场 分子固有振动
偶极矩变化 (能级跃迁)
a
20
没有偶极矩变化的振动跃迁,无红外活性:
如:单原子分子、同核分子:He、Ne、N2、O2、Cl2、H2 等。 没有红外活性 。
如:对称性分子的非对称性振动,有偶极矩变化的振动跃迁, 有红外活性。
如:非对称分子,有偶极矩,红外活性。
电 场
无偶极矩变化
无红外吸收
磁
场
红外吸收
交变磁场
分子固有振动 a
偶极矩变化 (能级跃迁)
21
2、红外光谱的振动形式
一般把分子的振动形式分为两大类:化学键的伸缩 振动和弯曲振动。
伸缩振动:指成键原子沿着价键的方向来回地相对运动。
第十章 红外吸收光谱法
§10-1 §10-2 §10-3 §10-4 §10-5 §10-6 §10-7
试题
红外吸收光谱法的基本原理 经典红外谱带吸收范围 红外光谱解析实例 红外光谱仪 试样的处理 红外光谱法的应用 激光拉曼光谱法简介
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6.0 m
7.0 m
化学键键强越强(即键的力常数K越大)原子折合质量 越小,化学键的振动频率越大,吸收峰将出现在高波数区。
上一内容 下一内容 回主目录
返回
例题: 由表中查知C=C键的K=9.5 9.9 ,令其为 9.6, 计算波数值
v 1 1 k 1307 k 1307 9.6 1650cm1
上一内容 下一内容 回主目录
返回
2.峰位、峰数与峰强
(1)峰位
化学键的力常数K越大,原子折合质量越
小,键的振动频率越大,吸收峰将出现在高波数区(短波长
区);反之,出现在低波数区(高波长区)。
例1 水分子
(2)峰数
峰数与分子自由度有关。无瞬间偶
基距变化时,无红外吸收。
上一内容 下一内容 回主目录
返回
二、红外光谱的表示方法
红外光谱除用波长表示外,更常用波数 表示,二者的关系为:
/ cm-1
1
10 4
/ cm / m
例如=5m的红外线,它的波数为
上一内容
10 4 2000 cm-1
5
下一内容 回主目录
返回
红外光谱图: 纵坐标为吸收强度, 横坐标为波长λ ( μm ) 和波数1/λ 单位:cm-1 可以用峰数,峰位, 峰形,峰强来描述。
1.红外吸收光谱的特征性
基团频率
四个区域的划分: (单位: cm-1)
1) X-H伸缩振动区:4000-2300 2)三键和集聚双键伸缩振动区:2300-2000
3)双键伸缩振动区:
2000-1500
4)X-Y伸缩振动及X-H变形振动:小于1650
指纹区:
上一内容 下一内容 回主目录
1350`-650(同分异构体等)
返回
1.烷烃的红外光谱:A:2850~2950 cm—1 C---H 伸缩振动
第十章
红外吸收光谱分析
上一内容 下一内容 回主目录
பைடு நூலகம்回
第一节 红外光谱分析概述
一、红外光谱区的划分
上一内容 下一内容 回主目录
返回
上一内容 下一内容 回主目录
返回
红外光谱的产生原因 : 由于分子吸收红外光后,分子中的振动能级
和转动能级发生跃迁所产生,又称转动振动光谱 。
1 2c
C为光速,为弹簧的力常数,也即化学键 的力常数,为两个原子的折合质量.
m1 m2
m1 m2
发生振动能级跃迁需要能量的大小取决于键
两端原子的折合质量和键的力常数,即取决
于分子的结构特征。
上一内容 下一内容 回主目录
返回
根据小球的质量和相对原子质量之间 的关系,则振动频率可写成
应用:有机化合物的结构解析。 定性:基团的特征吸收频率; 定量:特征峰的强度;
上一内容 下一内容 回主目录
返回
第二节 红外吸收光谱产生的条件
满足两个条件: 1.辐射应具有能满足物质产生振动跃迁所需的能量; 2.辐射与物质间有相互偶合作用。
通常用分子的偶极矩来描 述分子极性的大小.设正 负电中心的电荷分别为+ q和-q,正负电荷中心 中距离为d,则
N1 2 A
2c M
M是折合相对原子质量,即
M M1M 2 M1 M2
上一内容 下一内容 回主目录
返回
表 某些键的伸缩力常数(毫达因/埃)
键类型 力常数 峰位
—CC — > —C =C — > —C — C —
15 17 9.5 9.9
4.5 5.6
4.5m
上一内容 下一内容 回主目录
返回
2.区域划分
λ μ m ν( cm-1 ) M cm mm
近红外 0.8--2.5 12500-4000 中红外 2.5--25 4000--400 远红外 25--1000 400--10
um = 10-6 nm = 10-9 pm = 10-12
上一内容 下一内容 回主目录
• (但只有两个吸收峰)
• O = C = O ,对称 △U = 0,1388cm-1
• O = C = O,反对称△U≠0, 2349cm-1 • • O = C = O ,面内变形, 667cm-1 • • O = C = O,面外变形, 667cm-1,简并
• 对称性愈高,简并愈多
上一内容 下一内容 回主目录
qd
上一内容 下一内容 回主目录
返回
• 对称分子:没有偶极矩, 辐射不能引起共振,无 红外活性。
• 如:N2、O2、Cl2 等。
• 非对称分子:有偶极矩, 红外活性。
• 偶极子在交变电场中 的作用示意图
上一内容 下一内容 回主目录
返回
上一内容 下一内容 回主目录
返回
返回
峰位、峰数与峰强
(3)瞬间偶基距变化大,吸收峰强;键两端原子电负性相 差越大(极性越大),吸收峰越强;
例2 CO2分子
(4)由基态跃迁到第一激发态,产生一个强的吸收峰, 基频峰;
(5)由基态直接跃迁到第二激发态,产生一个弱的吸收 峰,倍频峰;
上一内容 下一内容 回主目录
返回
第六节 红外吸收光谱的特征性,基团频率
返回
2.两类基本振动形式 伸缩振动 亚甲基:
变形振动 亚甲基
上一内容 下一内容 回主目录
返回
第五节 红外光谱的吸收强度
1、红外吸收光谱的吸收强度
(1)与分子振动时偶极矩 变化的平方成正比 (2)与分子对称性有关 (3)溶剂影响
比UV—VIS通常小2到3个数量级
用S(强),M (中等),VW(极弱)表示
上一内容 下一内容 回主目录
返回
第三节 分子振动方程式
1.双原子分子的简谐振动及其频率
化学键的振动类似于连接两个小球的弹簧
分子的振动能级(量子化):
E振=(V+1/2)h :化学键的 振动频率; V :振动量子数。
上一内容 下一内容 回主目录
返回
• 其振动频率(以波数表 示),可用经典力学虎克定 律导出如下公式:
2c
12 / 2
正己烯中C=C键伸缩振动频 率实测值为1652 cm-1
上一内容 下一内容 回主目录
返回
第四节 分子的基本振动形式
上一内容 下一内容 回主目录
返回
上一内容 下一内容 回主目录
返回
上一内容 下一内容 回主目录
返回
• 例如:CO2 3 n—5 = 4(P.90)
