Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
限制性内切酶使用

用Universal Buffer和Basal Buffer进行限制酶活性表示TaKaRa公司,为了方便限制酶的统一使用,采用了通用缓冲液 (Universal Buffer) 测定限制酶活性的体系 (5种通用缓冲液中,用标注的),以此时的活性值作为100%。
并把在其它通用缓冲液中的相对活性表示如下表。
有 ( ) 标记的是易受Star活性影响的缓冲液,为了避免Star活性的影响,希望尽量使用或标注的缓冲液。
每种限制酶都有其自身的基本缓冲液 (Basal Buffer),其中AccⅢ、BalⅠ、BcnⅠ、BglⅠ、Bpu1102Ⅰ、Cfr10Ⅰ、Eam1105Ⅰ、Eco52Ⅰ、NruⅠ、Psh BⅠ、Sna BⅠ、SspⅠ、TaqⅠ、VpaK11B Ⅰ(共14种)由于没有十分合适的通用缓冲液,只能使用基本缓冲液(Basal Buffer)。
各种限制酶的基本缓冲液组成不同,相互之间不能通用。
各种限制酶在基本缓冲液中的相对活性也被列于下表,供参考。
限制酶在各种缓冲液中的相对活性附带·活性测定用Buffer 推荐使用的Buffer*1+0.01%BSA→100%: Afl II, Aor13H I, Eco O65 I, Fok I, Hin1 I, Mun I, Nco I, Pvu I, Sse8387 I, Xba I *2 +0.01%BSA+0.01%Triton X-100→100%: Not I按Universal Buffer分类的限制酶各Universal Buffer的组成■ 使用注意事项10×Buffe r都为10倍浓度的缓冲液。
此外,10×T溶液中不含BSA,在使用时将BSA添加进去,使最终浓度为0.01%,有些限制酶(带有*1或*2标记)的反应体系中需加BSA或Triton X-100,添附的溶液是10倍浓度 (0.1%) 的液体,使用时,请在反应体系中添加1/10量进行反应。
双酶切体系之欧阳美创编

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
时间:2021.01.01 创作:欧阳美
■说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
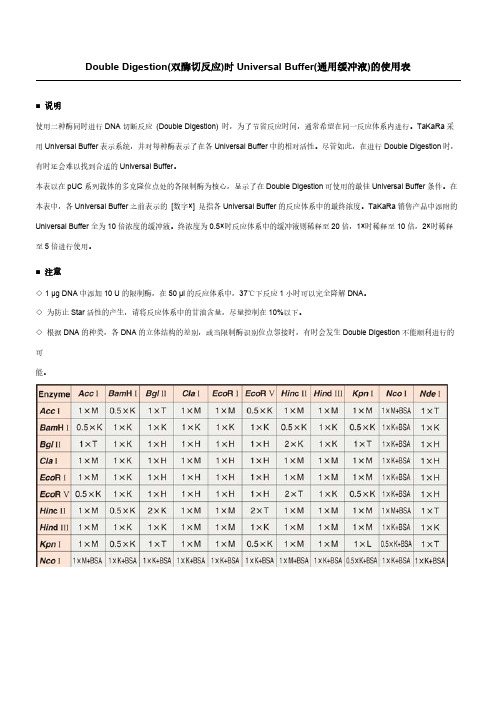
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star 活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
时间:2021.01.01 创作:欧阳美。
双酶切体系

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■说明
使用二种酶同时进行DNA切断反应(Double Digestion)时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统, 并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion 时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer 之前表示的[数字刃是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5 x
时反应体系中的缓冲液则稀释至20倍,1X时稀释至10倍,2X时稀释至5倍进行使用。
■注意
◊1 (i g DNA中添加10 U的限制酶,在50 口的反应体系中,37 C下反应1小时可以完全降解DNA。
◊为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◊根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生
Double Digestion不能顺利进行的可。
双酶切体系梳理

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表■ 说明使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer 之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意◇1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
(精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏)。
DNA限制性内切酶——双酶切反应时通用缓冲液的选用

DNA限制性内切酶——双酶切反应时通用缓冲液的选用
■当酶切位点确定后,最好购买同一家公司生产同一类型的内切酶(若酶切Buffer相同,这样有时候可以省去后期去需找酶切反应通用缓冲液)
■说明
使用两种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
限制酶使用说明

■ 保存
开封后室温保存。
Double Digestion(双酶切反应)时 Universal Buffer(通用缓冲液)的使用表
■ 说明 使用二种酶同时进行 DNA 切断反应 (Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。TaKaRa 采用 Universal Buffer 表示系统,并对每种酶表示了在各 Universal Buffer 中的相对活性。尽管如此,在进行 Double Digestion 时,有时还 会难以找到合适的 Universal Buffer。 本表以在 pUC 系列载体的多克隆位点处的各限制酶为核心,显示了在 Double Digestion 可使用的最佳 Universal Buffer 条件。在本表 中,各 Universal Buffer 之前表示的 [数字×] 是指各 Universal Buffer 的反应体系中的最终浓度。TaKaRa 销售产品中添附的 Universal Buffer 全为10倍浓度的缓冲液。终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。 ■ 注意 ◇ 1 μg DNA 中添加10 U 的限制酶,在50 μl 的反应体系中,37℃下反应1小时可以完全降解 DNA。 ◇ 为防止 Star 活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。 ◇ 根据 DNA 的种类,各 DNA 的立体结构的差别,或当限制酶识别位点邻接时,有时会发生 Double Digestion 不能顺利进行的可 能。
泳图谱,判断酶中是否夹杂有非特异性核酸酶。 2. 基因组 DNA 分析
对指定的限制酶(在酶的分项介绍中标明)进行该项检测。在适当的细菌 DNA 底物中 (琼脂糖凝胶块 中的 DNA 浓度为0.5 μg/50 μl)加入20~150 U 的限制酶,反应24小时,然后进行琼脂糖电泳,根据电泳 图谱,确认酶中是否含有杂质。 3. 连接—再切检定
TaKaRa Universal Buffer 宝生物双酶切缓冲液-推荐下载
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可
能。
限制性内切酶使用

用Universal Buffer和Basal Buffer进行限制酶活性表示TaKaRa公司,为了方便限制酶的统一使用,采用了通用缓冲液(Universal Buffer) 测定限制酶活性的体系(5种通用缓冲液中,用标注的),以此时的活性值作为100%。
并把在其它通用缓冲液中的相对活性表示如下表。
有( ) 标记的是易受Star活性影响的缓冲液,为了避免Star活性的影响,希望尽量使用或标注的缓冲液。
每种限制酶都有其自身的基本缓冲液(Basal Buffer),其中AccⅢ、BalⅠ、BcnⅠ、BglⅠ、Bpu1102Ⅰ、Cfr10Ⅰ、Eam1105Ⅰ、Eco52Ⅰ、NruⅠ、Psh BⅠ、Sna BⅠ、Ssp Ⅰ、TaqⅠ、VpaK11B Ⅰ(共14种)由于没有十分合适的通用缓冲液,只能使用基本缓冲液(Basal Buffer)。
各种限制酶的基本缓冲液组成不同,相互之间不能通用。
各种限制酶在基本缓冲液中的相对活性也被列于下表,供参考。
限制酶在各种缓冲液中的相对活性附带·活性测定用Buffer 推荐使用的Buffer*1+0.01%BSA→100%: Afl II, Aor13H I, Eco O65 I, Fok I, Hin1 I, Mun I, Nco I, Pvu I, Sse8387 I, Xba I *2 +0.01%BSA+0.01%Triton X-100→100%: Not I按Universal Buffer分类的限制酶各Universal Buffer的组成■ 使用注意事项10×Buffer都为10倍浓度的缓冲液。
此外,10×T溶液中不含BSA,在使用时将BSA添加进去,使最终浓度为0.01%,有些限制酶(带有*1或*2标记)的反应体系中需加BSA或Triton X-100,添附的溶液是10倍浓度(0.1%) 的液体,使用时,请在反应体系中添加1/10量进行反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
说明使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可
能。
