药品不良反应报告表填写指南
药品不良反应报告表的填写及相关注意事项

《药品不良反应/事件报告表》可大致分为报告基本情况、患者基本情况、使用药品情况、ADR过程描述、关联性评价、报告人报告单位信息六部分。
1.报告基本情况首次报告□跟踪报告□编码:是电子上报后自动形成的每份报告的唯一编码。
报告类型:新的□严重□一般□(1)严重的药品不良反应:①导致死亡危及生命②致癌、致畸、致出生缺陷③导致显著的或者永久的人体伤残或者器官功能损伤④导致住院时间时间延长(2)新的药品不良反应:指药品说明书中未载明的不良反应或者说明书中已有描述,但不良反应发生的性质、程度、后果获准频率与说明书描述不一致或者严重,按照新的药品不良反应处理。
报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□2.患者相关情况患者姓名:填写患者真实全名。
①当新生儿被发现有出生缺陷时,如果报告者认为这种出生缺陷可能与孕妇在妊娠期间服用药品有关时,患者是新生儿,并且将母亲使用的可能引起新生儿出现ADR的药品列在可以药品栏中;②如果孕妇在妊娠期间服用药品出现ADR没有影响到胎儿/新生儿,患者是母亲;如果ADR是胎儿死亡或自然流产,患者是母亲;③如果新生儿和母亲都发生ADR,应填写两张报告表,并且注明两张报告表的相关性。
出生日期/年龄:患者的出生年应填写4位数,如2004年。
如果患者的出生日期无法获得,应填写发生不良反应时的年龄(月龄/日龄)。
体重:注意以千克(公斤)为单位。
如果不知道准确的体重,请做一个最佳的估计。
联系方式:最好填写患者的联系电话或者移动电话。
如果填写患者的通信地址,请附上邮政编码。
原患疾病:患者所患的所有疾病。
若同时患有几种疾病,尽量完整填写所有疾病,建议首先填写与怀疑药品的使用相关的疾病。
疾病诊断应填写标准全称,如急性淋巴细胞白血病,不能写ALL。
既往药品不良反应/事件情况:包括药物过敏史:如选择“有”,应具体说明。
家族药品不良反应/事件:根据实际情况正确选择,如选择“有”,应具体说明。
相关重要信息:此栏的过敏史是指药物过敏史之外的其他过敏经历,如花粉过敏、牛奶过敏、花生过敏等;药物过敏史应在“既往药品不良反应/事件”一栏说明。
药品不良反应报告表 填写示例及填写说明
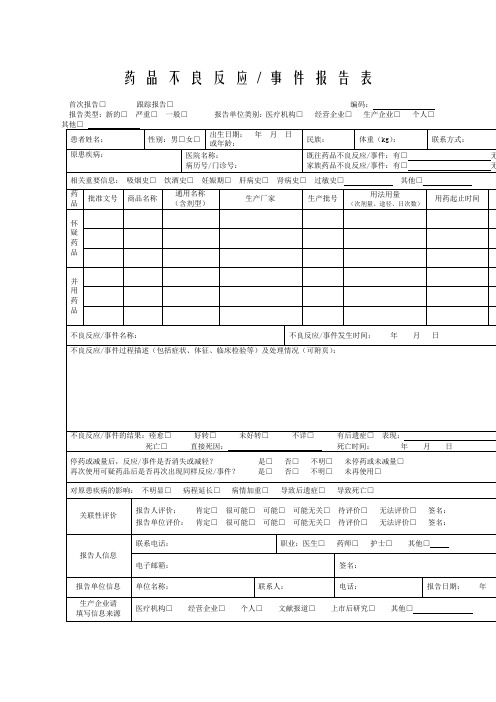
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
药品不良反应报告表填表说明

附:填表说明:一、药品不良反应定义:药品不良反应简称ADR,系指正常剂量的药物用药预防、诊断、治疗疾病或调节生理机能时出现的有害的和与用药目的无关的反应。
通俗地说就是合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。
药品不良反应既不是药品质量问题,也不属于医疗事故。
二、药品的不良反应包括:1、对人体有害的副作用。
如阿托品被用于解除胃肠痉挛而引起口干等。
2、毒性反应。
如引起失眠、耳鸣、贫血、肝功能损害等。
3、过敏反应。
4、三致作用。
致畸形、致突变、致癌等。
5、后遗效应。
6、继发性反应。
三、填表说明:1、填写注意事项:⑴《药品不良反应/事件报告表》的填报内容应真实、完整、准确。
⑵每一个病人填写一张报告表。
⑶尽可能详细地填写报告表中所要求的项目。
有些内容无法获得时,填写“不详”。
⑷对于报告表中的描述性内容如果报告表提供的空间不够,可另附A4纸说明。
在纸的顶部注明“附件”,并标示页码。
2、填写详细要求:⑴报告类型:新的□严重□一般□新的:是指药品说明书中未载明的。
严重:是指因服用药品引起以下情形之一的:死亡;致癌、致畸、致出生缺陷;对生命有危险并导致永久的或显著的伤残;对器官功能产生永久伤害;导致住院或住院时间延长。
一般:是指除新的、严重的以外的所有的不良反应。
⑵表中患者相关信息及所用药品信息均需完整真实填写。
⑶不良反应/事件名称为对明确为药源性疾病的填写疾病名称,不明确的填写不良反应中最主要、最明显的症状。
⑷不良反应/事件发生时间填写不良反应发生的确切时间。
⑸不良反应/事件过程描述:①不良反应/事件开始及变化过程,均需注明具体时间,如×年×月×日,不要用入院后第几天,或用药后第几天。
②填写不良反应/事件的表现时,要明确、具体,如为过敏性皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心律失常,要填写何种心律失常;严重病例应注意生命体征指标(体温、血压、脉搏、呼吸)的记录。
《药品不良反应事件报告表》填写与上报

报告表填写的基本要求
内容真实、完整、准确 钢笔填写,字迹清晰, 叙述准确、完整、简明
(详见教材讲解)
本人及家族既往药品不良反应史:
按所了解到的实际情况填写。
如有不良反应史者在“其它”栏内注明 具体药物及表现。
如不清楚则填“不详”。
不良反应事件名称: 填写不良反应名称。 名称是否规范主要参考《药品不良反应术语 集》-由国家药品不良反应监测中心编译出版 我中心网站有下载: 如不明确,则填不良反应一组表现中最主要 最明显的症状,如“头痛、头晕”;“恶心、呕吐” 。
不良反应事件发生时间: 填写发生不良反应事件的确切时间
不良反应事件过程描述及处理情况: 一般分三段进行描述 、出现不良反应的第一次描述(用药与的 间隔时间、症状、体征和相关检查) 、病情的动态变化(采取的治疗措施,治 疗过程中症状、体征和相关检查) 、治疗效果 (简单的可缺省第二项)
注意: 开始和变化的时间要用具体时间(准确到几点几分)
国内、外有无类似的不良反应: 如有应给出文献具体出处, 如果不清楚可填写不详。
不良反应分析栏: 用药与不良反应的出现有无合理的时间关系 反应是否符合该药已知的不良反应的类型 停药或减量后,反应是否消失或减轻 再次使用可疑药品后是否再次出现同样反应 反应是否可用并用药的作用、患者病情的进
患者使用头孢他定克静脉滴注分钟后出现胸闷、 气促、面色苍白、手脚冰凉等,测血压。 立即停药,让患者平卧,给予保暖、吸氧、并 予肾上腺素、地塞米松抗过敏治疗。 分钟后好转,血压恢复到。
使用药品的信息:
药品不良反应报告表的填写及相关注意事项

药品不良反应报告表的填写及相关注意事项《药品不良反应/事件报告表》可大致分为报告基本情况、患者基本情况、使用药品情况、ADR过程描述、关联性评价、报告人报告单位信息六部分。
1.报告基本情况首次报告□跟踪报告□编码:是电子上报后自动形成的每份报告的唯一编码。
报告类型:新的□严重□一般□(1)严重的药品不良反应:①导致死亡危及生命②致癌、致畸、致出生缺陷③导致显著的或者永久的人体伤残或者器官功能损伤④导致住院时间时间延长(2)新的药品不良反应:指药品说明书中未载明的不良反应或者说明书中已有描述,但不良反应发生的性质、程度、后果获准频率与说明书描述不一致或者严重,按照新的药品不良反应处理。
报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□2.患者相关情况患者姓名:填写患者真实全名。
①当新生儿被发现有出生缺陷时,如果报告者认为这种出生缺陷可能与孕妇在妊娠期间服用药品有关时,患者是新生儿,并且将母亲使用的可能引起新生儿出现ADR的药品列在可以药品栏中;②如果孕妇在妊娠期间服用药品出现ADR没有影响到胎儿/新生儿,患者是母亲;如果ADR是胎儿死亡或自然流产,患者是母亲;③如果新生儿和母亲都发生ADR,应填写两张报告表,并且注明两张报告表的相关性。
出生日期/年龄:患者的出生年应填写4位数,如2004年。
如果患者的出生日期无法获得,应填写发生不良反应时的年龄(月龄/日龄)。
体重:注意以千克(公斤)为单位。
如果不知道准确的体重,请做一个最佳的估计。
联系方式:最好填写患者的联系电话或者移动电话。
如果填写患者的通信地址,请附上邮政编码。
原患疾病:患者所患的所有疾病。
若同时患有几种疾病,尽量完整填写所有疾病,建议首先填写与怀疑药品的使用相关的疾病。
疾病诊断应填写标准全称,如急性淋巴细胞白血病,不能写ALL。
既往药品不良反应/事件情况:包括药物过敏史:如选择“有”,应具体说明。
家族药品不良反应/事件:根据实际情况正确选择,如选择“有”,应具体说明。
药品不良反应报告表填写示例及填写说明
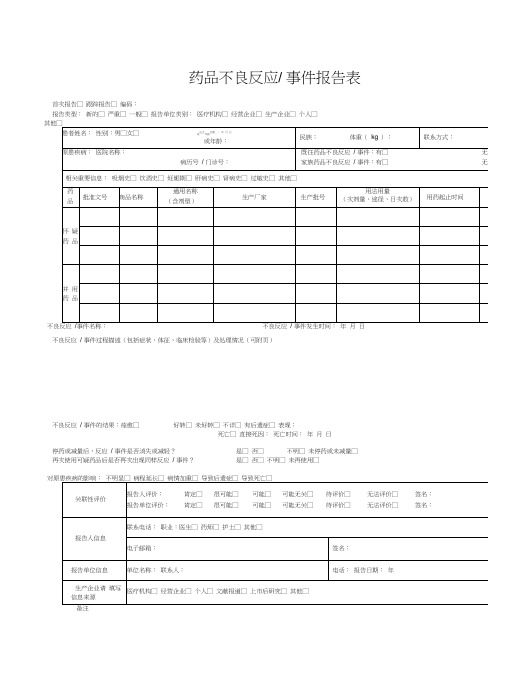
药品不良反应/ 事件报告表首次报告□ 跟踪报告□ 编码:报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□不良反应事件名称:不良反应事件发生时间:年月日不良反应/ 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/ 事件的结果:痊愈□好转□ 未好转□ 不详□ 有后遗症□ 表现:死亡□ 直接死因:死亡时间:年月日停药或减量后,反应/ 事件是否消失或减轻?是□ 否□不明□ 未停药或未减量□再次使用可疑药品后是否再次出现同样反应/ 事件?是□ 否□ 不明□ 未再使用□电子邮箱: 签名:×××药 品 不 良 反 应 / 事 件 报 告 表示例不良反应 / 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页) 一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×× ×时间出现×××反应(反应描述须明确、具体) ,×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂 和其他处理措施) ,处理后×××时间患者转归情况。
对原患疾病的影响: 不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:××× 报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:×××报告人信息患者姓名:×××性别:男□女□出生日期: 年 月 日 或年龄: ××民族:××体重( kg ):××联系方式:××××××原患疾病:指患者此次入 诊的主要疾病(如果有多 疾病可以补充在相关重要 是备注里面),不能写字院或就 种慢性信息或 母缩写。
药品不良反应报告表、填写示例及填写说明
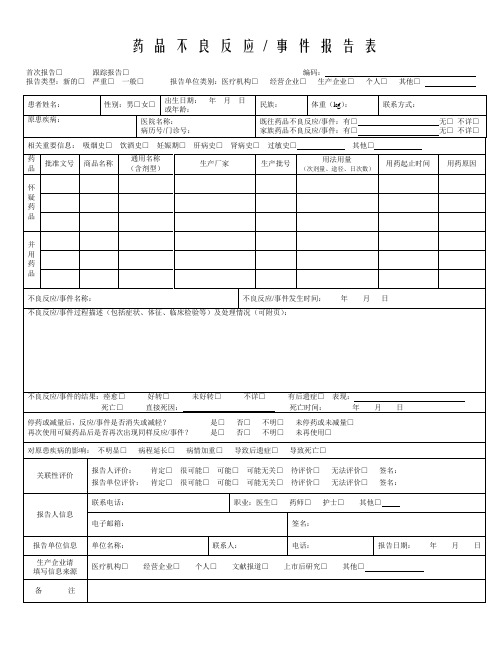
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
药品不良反应报告表填写示例及填写说明

药品不良反应报告表填写示例及填写说明 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人药品不良反应 / 事件报告表示例首次报告□跟踪报告□编码:1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显着的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 备注
如果需要详细叙述,请另附纸说明。
• 家族药品不良反应/事件
选择正确选项。 如果需要详细叙述,请另附纸说明。
返 回 点 此
• 相关重要信息 • 吸烟史□ 饮酒史□ • 妊娠期□ 肝病史□ 肾病史□
• 过敏史□
• 其他□
比如食物、 花粉
返 回 点 此
• 批准文号 比较重要的选项。批准文号填写正确 以后,药品的商品名、通用名和生产厂 家即自动生成,可减少工作量。
• 如果报告的是跟踪报告,搜索到原始报告后在原始报告上 进行修改,补充资料后保存。
返 回 点 此
• 编码
• 是报告单位内部编码,电子上报后系统自动形成的电子编 码,报告单位要记录在纸制报告上
报告类型
• 新的□ 严重□ 一般□
• 新的药品不良反应,是指药品说明书中未载明的不良反应。(说 明书中已有描述,但不良反应发生的性质、程度、后果或者频率 与说明书描述不一致或者更严重的,按照新的药品不良反应处 理。) • (原:新的药品不良反应 是指药品说明书中未载明的不良反应。) • 严重药品不良反应,是指因使用药品引起以下损害情形之一的反 应: 1.导致死亡; 2.危及生命; 3.致癌、致畸、致出生缺陷; 4.导致显著的或者永久的人体伤残或者器官功能的损伤; 5.导致住院或者住院时间延长; 6.导致其他重要医学事件,如不进行治疗可能出现上述所列 情况的。
返 回 点 此
原患疾病
即病历中的诊断,诊断疾病应写标准全称。如急 性淋巴细胞白血病,不能写ALL。
常见的不规范疾病名称
不规范名称
上感 慢支 肠胃炎 肺心病 房早 风心病 心梗
ICD-10
上呼吸道感染 慢性支气管炎 胃肠炎 慢性肺原性心脏病 房性早搏 风湿性心瓣膜病 心肌梗塞
不规范名称
肾衰 泌尿系统感染 乙肝 椎间盘突出 右输尿管结石 慢性肾炎 大腿静脉曲张
返 回 点 此
不良反应/事件分析及关联性评价
时间关系 已知类型 去激发 再激发 其他影响
肯定
很可能 可能 可能无关
+
+ + -
+
+ - -
+
+ ± ±
+
? ? ?
-
- ± ±
返 回 点 此
待评价:需要补充材料才能评价 无法评价:评价的必需资料无法获得
注:+表示肯定
-表示否定
±表示难以肯定或否定
?表示不明
ICD-10
肾功能衰竭 泌尿道感染 慢性乙型肝炎 椎间盘脱出 输尿管结石 慢性肾小球肾炎 大隐静脉曲张
返 回 点 此
• 病例号/门诊号(企业填写医院名称)
认真填写患者的病历号(门诊号)以便于对详
细病历详细资料的查找。
企业需填写病例发生的医院名称。
返 回 点 此
• 既往药品不良反应/事件情况
包括药物过敏史。
返 回 点 此
使用药品情况
• 生产批号
填写药品包装上的生产批号,如 980324 。注意 不要与生产日期、有效期相混淆。
• 用法用量
包括每次用药剂量、给药途径、每日给药次数, 例如,5mg,口服,每日2次。 如系静脉给药,需注明静脉滴注、静脉推注或 者“小壶”给药等。对于规定要缓慢静脉注射 的药品应在报告表“其它”栏内注明是否缓慢 注射。
不良反应名称的选取参考《WHO药品不良反应术语集》
• 不良反应/事件发生时间 填写不良反应发生的确切时间。 当一个新生儿被发现有出生缺陷,不良事件 返 回 的发生时间就是孩子的出生日期。 点 当一个胎儿因为先天缺陷而发生早产或流产时, 此 不良反应的发生时间就是怀孕终止日期。
不良反应过程描述
3个时间3个项目和2个尽可能
返 回 点 此
• 写不良反应中最主要、最明显的症状。例如: 返 不良反应表现:患者从Ⅹ年Ⅹ月Ⅹ日开始使用Ⅹ,1.0g, 回 点 1 次 / 日,静滴,Ⅹ日患者胸腹部出现斑丘疹,有瘙痒感。 此 继续使用后丘疹面积增大。不良反应名称可填写皮疹。
报告人信息
• 联系电话
• 职业:报告人职业(医疗机构):依据实际情况
做出选择。
返 回 点 此
医生□ 药师□ 护士□ 其他□
• 电子邮箱: • 报告人签名:
报告单位信息
• 单位名称 • 电话 联系人 报告日期:年月日
返 回 点 此
• 生产企业请填写信息来源:
医疗机构□ 经营企业□ 个人□ 文献报道□ 上 市后研究□ 其他□
返 回 点 此
商品名称 填写商品名,如批准文号填写正确,该项可自 动生成。如果没有或者不知道商品名,填写不 详。
通用名称(含剂型) 填写完整的通用名,如批准文号填写正确,该 项可自动生成。不可用简称,如“氨苄”等 生产厂家 填药品说明书上的药品生产企业的全称,如批 准文号填写正确,该项可自动生成。不可用简 称,如:“上五”、“白云”等
药品不良反应报告填写指南
该PPT对药品不良反应报告的填写 做出详细说明。如果在填写表格中有 哪一项不知道该如何规范填写的话, 点击表格中的该选项红框即可。
点此进入
•请点击幻灯片放 映(全屏)使用 !!!
点此进入
返回首页
点此进入 下半张表 格
点此进入下 半张表格
填写详细要求
报告的基本信息
• 首次报告□ 跟踪报告□(新增)
• 3个时间: 返 • 不良反应发生的时间; 回 • 采取措施干预不良反应的时间; 点 • 不良反应终结的时间。 此 • 3个项目: • 第一次药品不良反应出现时的相关症状、体征和相关检查; • 药品不良反应动态变化的相关症状、体征和相关检查; • 发生药品不良反应后采取的干预措施结果。 • 2个尽可能: • 不良反应/事件的表现填写时要尽可能明确、具体; • 与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写。
返 回 点 此
使用药品情况
• 用药起止时间
指使用药品的同一剂量的开始时间和停止时 间。如果用药过程中改变剂量应另行填写该剂 量的用药起止时间,并予以注明。 用药起止时间填写格式xxxx年Ⅹ月Ⅹ日- xxxx年X月X日。
• 用药原因
填写使用该药品的原因,应详细填写。如患者 既往高血压病史,此次因肺部感染而注射氨苄 青霉素引起不良反应,用药原因栏应填肺部感 染。
返 回 点 此
并用药品
• 并用药品:指发生此药品不良反应时患者除怀疑药品
外的其他用药情况,包括患者自行购买的药品或中草药 等。 • 不良反应发生时,患者同时使用的其他药品(不包括治 疗不良事件的药品),而且报告人并不认为这些药品与 不良反应发生有关。 • 并用药品的信息可能提供以前不知道的药品之间的相互 作用的线索,或者可以提供不良反应的另外的解释,故 请列出与怀疑药品相同的其他信息。
返 回 点 此
一般:新的、严重的药品不良反应以外的所有不良反 应
报告单位类别
• 选择药品不良反应报告表的填报单位的类型
医疗机构□ 生产企业□ 经营企业□ 个人□ 其他
• 医疗机构:指从事预防、诊断、治疗疾病活动 并使用药品的机构。 • 生产企业、经营企业:指药品的生产企业和药 品的销售企业 • 个人:指作为消费者本人 • 其他:以上来源之外的,如CRO公司
• 套用格式: • “患者因患XX疾病,XX日期XX时使用XX药,X时出现何 种不良反应(必要体征),X时停药,X时采取何种措施,X 时不良反应治愈或好转(必要体征)。”
不良反应结果
• 痊愈□ 好转□ 未好转□ 不详□ • 有后遗症□ 表现: 死亡□ 直接死因:
• 本次不良反应经采取相应的医疗措施后的结果,不是指 原患疾病的后果。例如患者的不良反应已经痊愈,后来 又死于原患疾病或与不良反应无关的并发症,此栏仍应 填"痊愈"。 • 不良反应经治疗后明显减轻,在填写报告表时没有痊愈, 但是经过一段时间可以痊愈时,选择“好转”。 • 不良反应经治疗后,未能痊愈而留有后遗症时,应注明 后遗症的表现。后遗症即永久的或长期的生理机能障碍, 应具体填写其临床表现,注意不应将恢复期或恢复阶段 的某些症状视为 “后遗症” 。 • 患者因不良反应导致死亡时,应指出直接死因和死亡时 间。
返 回 点 此
去激发/再激发
停药或减量后,反应/事件是否消失或 减轻?
是□ 否□ 不明□ 未停药或未减量□
返 回 点 此
再次使用可疑药品是否再次出现同样反 应/事件?
是□ 否□ 不明□ 未再使用□
• 对原患疾病的影响
• 不明显□ 病情延长□ 病情加重□ 导致后遗症□ 导致死亡□ • 不良反应对原患疾病产生的影响, 依据实际情况选择。
