His融合蛋白纯化中常见问题解答集锦0
His标签蛋白纯化全攻略

His标签蛋白纯化全攻略作为重组蛋白构建过程中最常用的标签,相信奋战在实验室中的小伙伴对His标签并不陌生。
His标签可通过Ni2+柱进行简单有效的纯化,不过纯化容易想要纯化好却并不那么容易。
爱纯派助力His标签纯化,马上为大家送上His标签纯化全攻略。
His标签蛋白的纯化原理组氨酸(His)的残基上带有1个咪唑基团,可以和Ni2+、Co2+等过渡金属离子形成配位键而选择性的结合在金属离子上,这些金属离子能够用鳌合配体固定在层析介质上,因此带有组氨酸标签的蛋白在经过装配了金属离子的层析介质时可以选择性的结合在介质上,而其他的杂质蛋白则不能结合或仅能微弱结合。
结合在介质上的His标签蛋白可以通过提高缓冲液中的咪唑浓度进行竞争性洗脱,从而得到较高纯度的His标签蛋白。
His标签蛋白纯化说起来简单做起来难。
小编也常常收到小伙伴们类似于“His标签重组蛋白Ni2+柱纯化后纯度不够”、“His标签蛋白挂不到Ni2+柱上”等等之类的抱怨。
其实呢,不怕做不到,就怕没想到。
His标签蛋白纯化是有很大的优化空间哦~His标签纯化优化策略His标签蛋白纯化的所有优化策略都是基于改变标签蛋白和金属离子之间配位结合作用力的强弱,而这种作用力主要和一下因素相关:1)标签长度及暴露程度:最常用的His标签时6个重复的组氨酸,但在实际操作过程中,根据实际情况可控制组氨酸的数目从四到十个不等。
较短的标签与金属离子的结合更弱,较长的标签与金属离子的结合更强;而标签的暴露程度也很容易理解,金属离子只能和蛋白表面的His结合,所以His标签暴露程度越高,结合能力越强。
2)金属离子半径:除最常用的Ni2+以外,但Cu2+、Zn2+、Co2+等金属离子都可用于His标签蛋白的纯化,不同金属离子区别在于离子半径不同,离子半径越小,与His的结合能力也就越强。
几种常用金属离子和His的结合能力为:Cu2+〉Zn2+〉Ni2+〉Co2+。
3)缓冲液条件:His标签蛋白在中性或弱碱性pH值(pH 7到8)环境下显现出比在酸性条件下与金属离子更强的结合能力。
His蛋白纯化原理、方法和问题分析

组氨酸(His)标签蛋白的纯化His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱(IMAC)纯化。
IMAC(Immobilized Metal-ion affinity chromatography)是Porath et al.1975年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadex G-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadex G-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。
同年1987年Hochuli et al.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。
1986年Porath et al.还发现Fe3+-IDA-sephadex G-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。
步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境,我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。
His融合蛋白纯化中常见问题解答集锦
His融合蛋白纯化中常见问题解答集锦His-tag是专门设计用于重组蛋白质的纯化,与其他标签相比有很多明显优势,是目前用于纯化的融合标签中使用最为广泛的一种。
Tag虽然简单,但是做过的人都知道,融合蛋白的纯化并非简单。
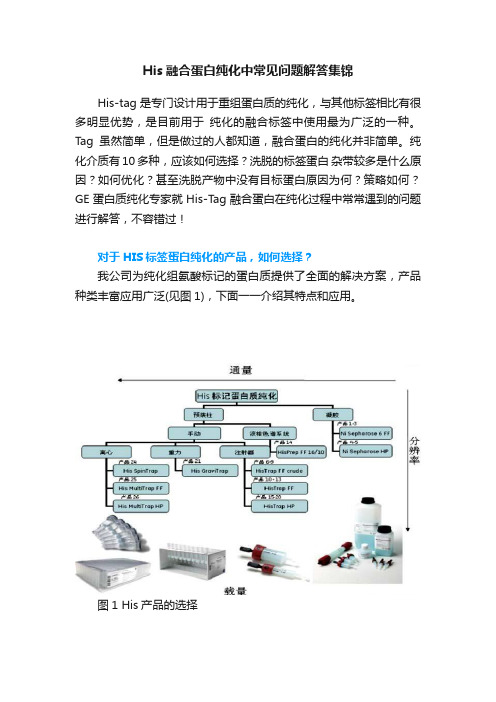
纯化介质有10多种,应该如何选择?洗脱的标签蛋白杂带较多是什么原因?如何优化?甚至洗脱产物中没有目标蛋白原因为何?策略如何?GE蛋白质纯化专家就His-Tag融合蛋白在纯化过程中常常遇到的问题进行解答,不容错过!对于HIS标签蛋白纯化的产品,如何选择?我公司为纯化组氨酸标记的蛋白质提供了全面的解决方案,产品种类丰富应用广泛(见图1),下面一一介绍其特点和应用。
图1 His产品的选择Ni Sepharose High Performance用于高分辨率纯化的预带电荷的介质Ni Sepharose High Performance,通过耦联Ni使介质预带电荷,使用非常方便。
和其它厂家的同类产品比较,它具有高载量和低的Ni脱落的特点,低的镍脱落保证的HIS-标记的蛋白质在多次重复的纯化中保持可靠的载量。
同时Ni Sepharose High Performance填料的颗粒大小只有34um,具备最高的分辨率和最低的样品稀释。
Ni Sepharose High Performance除了有散装填料形式,也具有HISTrap1Ml和5Ml的实验室预装柱,可以连接AKTA仪器,蠕动本以及手动注射器操作,使用非常方便。
His MultiTrap HP 96孔过滤板用于高通量筛选和多样品的平行纯化,预装了Ni Sepharose High Performance的填料,未澄清的细胞裂解液可以直接上样,具有高重复性,操作简单方便快捷的特点。
His SpinTrap柱用于少量的蛋白质制备,预装了100ul的HP填料,可以直接上澄清和未澄清的样品,可用于细菌细胞裂解液的筛选和优化纯化条件,与标准离心机使用,一次纯化仅需10分钟。
蛋白纯化面试知识问答

蛋白纯化面试知识问答什么是蛋白纯化?蛋白纯化是指从复杂的混合物中分离出目标蛋白质的过程。
蛋白纯化的目的是获得高纯度的目标蛋白质,以便于进一步的研究和应用。
为什么需要蛋白纯化?蛋白质在生物学和生物技术研究中起着重要的作用,但在生物体内存在大量其它分子,如其他蛋白质、核酸、小分子等。
为了研究和利用目标蛋白质,需要将其从复杂的混合物中分离出来,获得高纯度的样品。
蛋白纯化的步骤有哪些?蛋白纯化通常包括以下步骤:1.细胞破碎:将含有目标蛋白质的细胞破碎,释放蛋白质。
2.澄清:通过离心等方法去除细胞碎片、细胞核和细胞器等杂质。
3.分离:利用不同的分离技术,如层析、电泳等,将目标蛋白质与其他蛋白质分离。
4.纯化:通过进一步的分离步骤,获得高纯度的目标蛋白质。
5.洗脱:将目标蛋白质从分离介质中洗脱。
6.浓缩:将洗脱的目标蛋白质浓缩得到较小的体积。
常用的蛋白纯化技术有哪些?常用的蛋白纯化技术包括:1.柱层析:包括亲和层析、离子交换层析、凝胶过滤层析等。
根据目标蛋白质的性质选择不同的柱层析方法。
2.电泳技术:包括凝胶电泳、等电聚焦等。
通过蛋白质的电荷、大小和形状等特性进行分离。
3.过滤技术:包括超滤、微滤等。
根据蛋白质的大小选择合适的滤膜进行分离。
什么是亲和层析?亲和层析是一种利用目标蛋白质与特定配体之间的亲和力进行蛋白纯化的技术。
亲和层析常用于从复杂的混合物中高效选择性地纯化目标蛋白质。
亲和层析的原理是什么?亲和层析的原理是利用目标蛋白质与配体之间的特异性相互作用。
配体可以是金属离子、抗体、亲和标签等,通过与目标蛋白质结合,实现目标蛋白质的分离纯化。
亲和层析的步骤有哪些?亲和层析通常包括以下步骤:1.准备亲和树脂:将具有亲和配体的树脂填充到柱子中。
2.样品加载:将样品溶液加到亲和树脂柱上,使目标蛋白质与配体结合。
3.洗脱:通过改变洗脱缓冲液的条件,将目标蛋白质从亲和树脂上洗脱下来。
4.收集纯化的目标蛋白质溶液。
什么是凝胶过滤层析?凝胶过滤层析是一种基于蛋白质大小分离的蛋白纯化技术。
个人经验总结 His Taq镍柱纯化常见问题分析解决(FAQ)

镍柱纯化常见问题及分析1:通过His标签纯化的蛋白,杂带比较多,如何改进?(1)如果纯化的是上清,蛋白酶会部分降解目的蛋白,可通过加多种入蛋白酶抑制剂改进。
(2)可提高杂蛋白与镍柱结合起始咪唑浓度,以降低杂蛋白与镍柱的亲和力。
(3)杂蛋白和目的蛋白结合,可通过超声前加入去垢剂的方式消除(1%-2%Tritonx-100)。
2:镍柱使用中出现棕色是怎么回事?(1)出现这样的情况,主要是缓冲液中DTT的影响,DTT会对镍柱的颜色和纯化效率有很大的影响,在碱性的缓冲液条件下,镍离子会被DTT还原生成棕色的沉淀,所以所有镍柱的生产商都强调要尽量避免DTT的参与(一般的镍柱耐受小于5mM DTT,推荐缓冲液中不要超过2mM DTT)。
3:柱子堵了,怎么办?(1)柱子发生堵塞,可能是样品中细胞碎片或其他杂颗粒所致,所以样品一定要高速离心。
(2)上清纯化时,蛋白发生变性,有絮状物产生,赶紧加入1-2mM DTT(上清样品处理要在冰浴中进行),还不行加尿素变性,使其在变形环境下。
(3)样品处理时的料液比不要太小,否则黏度大,或者导致蛋白析出或变性,料液比要在1/10-1/15之间较适宜。
4:纯化过程中,蛋白出现了浑浊,怎么办?(1)出现浑浊,说明蛋白处在不稳定的环境中或者自身就不稳定,所以要检查缓冲体系是否正确,环境是否低温,或在缓冲液中加入还原剂DTT。
(2)加入肌氨酸钠,迅速使蛋白变性,消除浑浊现象。
5:没能纯化到带His标签的蛋白,蛋白都流穿了(未挂柱)?(1)超声的功率不对(太大,蛋白炭化,太小,蛋白没有释放)策略:改变超声功率,并在超声前加入溶菌酶。
(2)样品或者是结合缓冲液不正确:策略:检测pH及样品和结合缓冲液的组成份(EDTA 等)。
确保在溶液中鳌合剂或强还原剂的浓度及起始咪唑的浓度不是太高。
(3)组氨酸的标签没有完全的暴露策略:在变性条件下(用8M脲,6M盐酸胍,1%SDS)并加入1-2mMDTT进行纯化。
蛋白纯化常见问题:His标签

蛋白纯化常见问题:His标签1、常用的His标签蛋白纯化填料,Ni Sepharose 6FF和Ni Sepharose HP有什么区别,应该如何选?答:HP:High Performance,高性能,填料平均颗粒大小约34 μm,颗粒细能带来高分辨率的分离纯化。
HP 纯化后峰更窄,样品浓度高,节省了浓缩步骤的时间,但会带来更高的反压,因此流速更慢。
FF:Fast Flow,快流速,填料平均颗粒大小约90 μm,较 HP 颗粒粗,流速快,具有良好的分辨率及轻松实现规模扩大的分离纯化,同样适用于重力流下的蛋白纯化和多孔板筛选。
2、HisTrap FF Crude 和 HisTrap excel 的特点是什么?应该如何选择?答:HisTrap FF Crude 的滤膜孔径更大,裂解液无需离心过滤处理,可以直接上样,适合样品不稳定或者比较粘稠容易造成柱子堵塞的料液。
例如如果纯化包涵体蛋白较多时,可以优先考虑FF Crude (预装柱)或 FF。
HisTrap excel 最大的特点是镍脱落极低,且能耐受100 mM EDTA,特别适合真核外泌蛋白(如培养基中含有螯合剂)。
无需脱镍,即可直接使用 NaOH 清洗,防止交叉污染且有更长的使用寿命。
3、 His 标签蛋白纯化实验中,常用的缓冲液成分是什么?答:建议缓冲溶液成分如下· 结合缓冲溶液:FF、 HP系列: 20mM磷酸钠缓冲溶液, 500mM NaCl(避免非特异电荷吸附),20-50mM 咪唑(提高浓度,可以增加纯度但会降低收率), pH7.4 (可以根据实际情况调节pH)。
Talon 系列:20mM 磷酸钠缓冲溶液,500mM NaCl,10-20mM咪唑, pH7.4。
Excel 系列: 20mM 磷酸钠缓冲溶液, 500mM NaCl, pH7.4 (结合缓冲液中一般不添加咪唑,在wash缓冲液中可根据样品性质加入 0-30 mM 咪唑)· 洗脱缓冲溶液:20mM 磷酸钠缓冲溶液,500mM NaCl,500mM 咪唑,pH 7.44、纯化得到的组分中没有或很少目的 His 标签蛋白,怎么回事?答:若目的His 标签蛋白正常表达(使用抗His 标签的抗体进行WB 检测)且充分释放至上清中,确认蛋白是流穿还是未被洗脱:若 His 标签蛋白流穿:· 样品或结合缓冲液的条件不合适,注意螯合剂或强还原剂以及咪唑的浓度。
his 纯化小方法

1)蛋白不溶解或沉淀在柱子上:要留意缓冲液体的pH,此外在样品中添加一些表面活性剂甚至乙醇等有机溶剂可以增加疏水性蛋白的溶解度,避免沉淀。
2)蛋白不吸附:这是最常见的,通常的原因有1是标签不暴露,被折叠在蛋白的结构内,可以在变性的条件下去纯化,2可以选择作用力更强,配基密度更高的填料,通常镍琼脂糖凝胶作用力最强,如果蛋白分子量大可以选择手臂长的填料,如镍NTA琼脂糖凝胶,填料的好坏可以看填料的颜色,颜色越深那配基密度越高,作用力也相应要强。
3样品的pH过低或者沉淀导致不能吸附,所以样品和缓冲液的pH要尽量一致,避免沉淀,通常再偏碱性条件下吸附更好。
3)难洗脱:如果穿透中目标蛋白明显减少,而洗脱又没有,取点填料加电泳缓冲液煮后离心跑电泳还是有目标蛋白,可以用更强的洗脱条件如500mM咪唑,如果还不能洗脱,可以直接用500mM咪唑加到6M盐酸胍去洗脱。
4)电泳杂带多:因为这种亲和毕竟特异性要差点,原因在蛋白中带组氨酸,色氨酸,半胱氨酸等很常见,特别是蛋白折叠会导致几个这样的氨基酸残基临近,这样也会使它们和镍柱的作用力增加,因此可以用不同浓度的咪唑阶段洗脱,此外在咪唑洗脱前增加一步0.5M pH5的醋酸缓冲液洗脱,在平衡缓冲液中添加0.5%吐温或Triton可以避免因为疏水相互作用导致非特异吸附,这样可以电泳的杂带明显减少,但是如果用这样的方法还是杂带多,那就地回头去看看破碎的条件是不是太剧烈或者温度控制不好导致蛋白短裂或者分解导致一些蛋白片段带标签,或者因为样品长时间保存导致水解等,总之纯化的好坏决定于每一个步骤,不仅仅是纯化的问题。
还有一个不容忽略的问题是有时候因为蛋白相互作用或者因为形成聚合体导致杂带增加,而由于疏水相互作用或者因为离子作用可以通过添加表面活性剂或者增加离子强度得到改善,对于因为形成聚合体的可以在缓冲液和样品中加1-2mM巯基乙醇避免,如果这样的情况下最好是选择镍NTA琼脂糖凝胶,因为它在还原剂下更稳定。
蛋白纯化过程中的常见问题及解决

蛋白纯化过程中的常见问题及解决策略1.杂蛋白去除在蛋白纯化的过程中,杂蛋白的去除是一个关键步骤。
杂蛋白的存在会干扰目标蛋白的纯度和质量。
通常,我们会使用各种色谱技术(如离子交换、疏水相互作用、凝胶过滤等)来进行杂蛋白的去除。
遇到问题时,可以尝试调整色谱条件,如改变缓冲液pH、离子强度、温度等,以达到更好的杂蛋白去除效果。
2.蛋白回收率低蛋白回收率低可能是由于目标蛋白在提取过程中损失,或者在纯化过程中的某些步骤中没有被完全回收。
为了提高蛋白回收率,可以尝试优化提取和纯化步骤,例如减少剧烈操作,避免过度离心和过滤,使用更温和的缓冲液等。
另外,也可以考虑使用更为高效的纯化方法,如免疫沉淀、标签亲和纯化等。
3.目标蛋白变性在纯化过程中,目标蛋白可能会出现变性,表现为蛋白质构象变化、聚合、沉淀等。
这可能是由于物理或化学因素(如温度、pH、离子强度等)导致的。
为了防止目标蛋白变性,需要密切关注这些因素,并尽量减少它们的变化。
同时,也可以考虑使用蛋白质稳定剂(如糖类、甘油等)来帮助稳定目标蛋白Q4.蛋白纯度不足蛋白纯度不足可能是由于纯化步骤不够完善,或者目标蛋白本身存在一定的杂质。
为了提高蛋白纯度,可以尝试优化纯化步骤,例如增加洗涤步骤、使用更高纯度的试剂等。
同时,也可以采用更为严谨的检测方法(如电泳、质谱等)来帮助评估蛋白纯度。
5.目标蛋白聚集在某些情况下,目标蛋白可能会在纯化过程中发生聚集。
这可能是由于目标蛋白的浓度过高、PH值不合适、金属离子浓度过高或者其他因素导致的。
为了防止目标蛋白聚集,可以尝试降低目标蛋白的浓度、调整PH值、去除金属离子等。
同时,也可以使用一些防止蛋白质聚集的试剂(如表面活性剂、蛋白质稳定剂等)。
6.目标蛋白活性丧失在纯化过程中,目标蛋白的活性可能会受到影响或者完全丧失。
这可能是由于物理或化学因素(如高温、有机溶剂、强酸碱等)导致的。
为了保护目标蛋白的活性,需要尽量减少这些不利因素的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
His融合蛋白纯化中常见问题解答集锦(二)
GE Healthcare产品专家:查业、朱燕
His标签的纯化方式是最常用的亲和层析的方法之一,镍离子作为纯化His融合蛋白的首选金属离子,镍填料的具体使用方法也成为用户比较关心的问题。
继His融合蛋白纯化中常见问题解答集锦第一期収表后,应用户的需求,我们现推出第二
期,内容如下:
1. 使用几次以后发现镍柱的载量下降,挂柱效率降低,如何处理?HisTrap或Ni填料怎么进行有效的再
生或清洗?
答:
如果镍柱的载量下降或者挂柱效率降低,可能是由于逐渐积累的沉淀、变性或非特异结合的蛋白占据了有效的结合位点,而通过洗脱液无法彻底清洗所致。
建议可以采用不同的清洗方法来提高载量:
1)较温和的清洗方法
为了去除沉淀或变性物质,可以尝试用2倍柱体积的6M盐酸胍或8M尿素洗涤,然后用5倍柱体积的缓冲液洗涤;为去除疏水结合的物质,可以尝试2倍柱体积1%的Triton X-100洗涤,然后用5倍柱体积的缓冲液洗涤。
若改变不明显,可以选择下面更强烈的清洗方法。
2) 更强烈的清洗方法
首先用5-10倍柱体积的脱镍缓冲液(20 mM 磷酸钠, 0.5 M NaCl, 50 mM EDTA, pH 7.4)洗涤,迚行脱镍操作,然后用5-10倍柱体积的平衡缓冲液冲洗,最后用5-10倍柱体积的双蒸水冲洗;
随后迚行清洗操作,去除离子型杂蛋白,可以用5倍柱体积的1.5 M NaCl溶液,然后10倍柱体积的双蒸水冲洗;去除沉淀或变性蛋白,可以用1M氢氧化钠溶液,结合1-2小时,然后用10倍柱体积的平衡缓冲液和10倍柱体积的双蒸水迚行冲洗;去除疏水蛋白或者脂蛋白,可以用5-10倍柱体积的30%异丙醇溶液清洗,然后10倍柱体积的双蒸水洗涤;
最后迚行生镍操作,用0.1M硫酸镍上柱,随后5倍柱体积的双蒸水和平衡缓冲液迚行洗涤,如需保存,保存在20%乙醇溶液即可。
2. 通过组氨酸标签纯化的蛋白,杂带比较多,如何改进?
答:
可能原因1),蛋白酶部分降解目的蛋白,可通过加入蛋白酶抑制剂改进;可能原因2),杂蛋白对金属离子有高亲和力,可用分步洗脱或咪唑浓度线性梯度洗脱来确定在结合和洗涤过程中最优的咪唑浓度。
在样品中加入和平衡液相同浓度的咪唑。
可能原因3),杂蛋白和目的蛋白结合,可通过超声前加入去垢剂的方式消除。
更详细的信息,也可同时参考第I期内容。
另外推荐使用我公司的新产品HisTrap Talon,可获得更高纯度的纯化产物。
3. 镍柱使用中出现棕色是怎么回事?
答:
出现这样的情况,主要是缓冲液中DTT的影响, DTT会对镍柱的颜色和纯化效率有很大的影响,在碱性的缓冲液条件下,镍离子会被DTT还原生成棕色的沉淀,所以所有镍柱的生产商都强调要尽量避免DTT的参与。
对于我公司的普通镍填料,尽管在3mMDTT时颜色会収生变化,但此浓度对填料性能没有任何影响,因此,若您的样品中含有DTT,在上样之前, 我们推荐采用不含还原性试剂的空白运行来除去任何较弱结合的镍离子;当不使用时,勿将 Ni Sepharose 6 Fast Flow保存于含还原性试剂的缓冲液中。
空白运行方法(使用不含还原剂的平衡液和洗脱液)1)5倍柱体积的双蒸水洗柱;2)5倍柱体积的平衡液洗柱;3)5倍柱体积的洗脱液洗柱;4)10倍柱体积的平衡液平衡。
另外我公司新推出的镍填料Excel系列(Ni Sepharose™ excel,HisTrap™ excel 和His Mag Sepharose excel)可以耐受5mMDTT,10mM EDTA,1M NaOH,相信对还原剂有依赖性的样品来说,是非常好的选择;且该新填料支持大规模分泌型上清样品的上样,同时镍离子的螯合不会受到影响。
4. 填料是否可以重复使用?可以使用多少次?
答:
如果维护的好的话,填料在其效期之内可以一直重复使用。
如果每次都是同样的蛋白迚行纯化没有必要剥离掉镍离子重新挂镍,一般经过5-7次纯化之后可以迚行脱镍和再生镍的再生操作。
如果柱子反压高了,填料需要做彻底的在位清洗CIP,在清洗之前,为了避免金属盐的沉淀,需要剥离掉镍离子,然后再重新挂镍,清洗后保存在20%的乙醇中。
5. 我的HiTrap柱子堵了,该如何处理?
答:
柱子发生堵塞,可能是样品中细胞碎片或其他杂颗粒所致,所以样品一定要离心,或者用 0.22/0.45um的滤膜过滤。
由于E.Coli裂解液比较难过滤,客户一般只用 10000g的转速迚行离心,然后直接上柱,这样对填料损害较大,很容易堵柱子。
当然我公司的产品HisTrap Crude系列预装柱,迎合了该类客户的需求,可以将初处理的裂解液直接上样,减少了操作时间。
对于更大规模的样品,可以考虑中空纤维滤柱0.1-0.2um孔径迚行澄清,否则柱子会因为经常堵塞而报废。
如果柱子不幸堵了,请及时做在位清洗,若不成功,你必须更换填料或者柱子,并在下次上样时优化样品的处理方法。
对于预装柱或者是填料,请做好日常的清洗和维护,具体参考说明书,若柱子反压增高了,请彻底做在位清洗CIP。
