第3章 一般有机化学反应机理1-自由基反应
有机化学第三章反应机理

例如:
CH3 CH3
重排
CH3 C H CH2
CH3
C
CH3
由不够稳定的伯碳正离子重排为较稳定的叔碳
正离子。
4、碳负离子
由于烷基是供电子基团,所以碳负离子连接烷基 愈多,则愈不稳定(负电荷集中)。 碳负离子稳定性顺序为:
( CH3)3 C
由不够稳定的碳正离子重排为较为稳定的碳正离子。
CH3 CH3 CH CH CH2
H
CH3 CH3CHCHCH3
Cl
CH3 CH3CHCHCH3 Cl
CH3 CH3CHCHCH3
重排
CH3 CH3CCH2CH3
Cl
CH3 CH3CCH2CH3 Cl
( b ) 与卤素加成 ( Br2反式加成 )
实验事实:
R—X
RCO—X
SO3
(1)卤代反应历程 (Cl2 ,Br2 . FeCl3催化剂)
Br2
+
FeBr3
δ Br
+
δ BrFeBr3
Br
+
H
+
δ Br
+
δ BrFeBr3
-
FeCl4
H
Br
Br
+
H
(2)硝化反应历程
硝化反应通常在混酸(硝酸+硫酸)条件下进行。
H2SO4
+
HONO2
H
ONO2 H
+
HSO4
1° H 氯 代 2 5 ° ,h ν 溴 代 125° , hν 1 .0 1 .0 2° H 3 .8 82 3° H 5 .0 600
有机化学课件 第三章 烯烃3
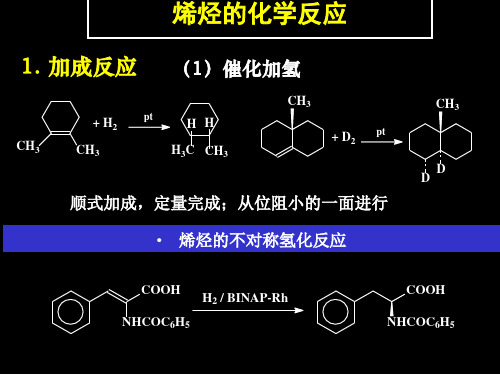
应经历溴 离子、反式加成。 • 反应经历溴鎓离子、反式加成。
Br H C C CH3 H H3C H C Br
+
H3C C C
H
H C
Br2
CH3
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
CH3 CH3 C CH=CH2 CH3 CH3 CH3 C CH CH3 + CH3 H3C Cl CH3 C CH CH3 Cl CH3 83%
HCl
17%
反应经历碳正离子中间体。 反应经历碳正离子中间体。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。
试比较下列分子或离子的超共轭效应大小。 [讨论] (1) 试比较下列分子或离子的超共轭效应大小。 讨论]
1) CH3CH=CH2 CH3CH2CH=CH2 (CH3)2CHCH=CH2 A B C 2) (CH3)3C (CH3)2CH CH3CH2 CH3 A B C D
+ + + +
(2) 试静态分析烯烃双键碳原子上电子云密度的大小。 试静态分析烯烃双键碳原子上电子云密度的大小。
碳正离子稳定性次序: 碳正离子稳定性次序: 3o C+ > 2o C+ > 1oC+ >CH3+
G
C
+
G
C
+
给电子基,使正电荷分散,碳正离子稳定: 给电子基,使正电荷分散,碳正离子稳定: 吸电子基,使正电荷更集中 碳正离子不稳定 碳正离子不稳定; 吸电子基,使正电荷更集中,碳正离子不稳定;
高分子化学导论第3章_自由基聚合机理及分子量链转移
链转移与链终止反应
链转移 自由基与其他非自由基分子的反应
链终止 自由基与自由基的反应
引发 增长
E (kJ/mol)
k
特点
Ed:105~150 Ei: 21~34
Ep=20~34
kd: 10- 4~10- 6s-1 慢引发 kp=102~104l/mol·s 快增长
终止 Et=8~21
kt=106~108l/mol·s 速终止
如:过氧化乙酰环己烷磺酰(ACSP)
2) 无机过氧化物——过硫酸盐 过硫酸钾,过硫酸铵
O
O
KO S O O S OK
O
O
O 2 KO S O
O
K2S2O8
2KSO4
水溶性引发剂
可单独使用,还可与适当的还原剂构成氧化 还原体系,在室温或更低温度下引发聚合
3. 氧化-还原体系引发剂
由氧化剂与还原剂组合在一起,通过电子转移 反应(氧化-还原反应),产生自由基而引发单 体进行聚合 特点: 活化能低,可在室温或更低温度下引发聚合 引发速率快,即活性大 种类多
歧化终止的结果:
Xn与链自由基中的单体单元数相同。
每个大分子只有一端为引发剂残基,
另一端为饱和或不饱和(两者各半)。
终止方式与单体种类、聚合条件有关 St:偶合终止为主 MMA:>60℃歧化终止为主
< 60℃两种终止方式均有
链终止的特点: Et(终止活化能)很低,8-21KJ/mol Rt(终止速率)极高 双基终止受扩散控制
均裂(homolysis) 共价键上一对电子分属两个基团,带独 电子的基团呈中性,称为自由基
RR
2R
异裂(heterolysis) 共价键上一对电子全部归属于某一基团, 形成阴离子,另一缺电子的基团,称做阳 离子
高分子化学第三章 自由基聚合

• 链转移反应前后,自由基的数目未变。
35
1. 向单体转移
· ~~CH2-CH + CH2=CH Cl Cl
· ~~CH=CH + CH3-CH Cl Cl
• 注意CH2=CHCl单体
36
2. 向溶剂或链转移剂转移
X ~~CH2CH · + YS X ~~CH2CHY + S ·
• 溶剂:
• 链转移剂:有较强的链转移能力的化合
1 2
[I ]
1
2
[M ] (3—35式)
注意本方程的适用范围
73
二、温度对聚合速率的影响
• 阿累尼乌斯公式:K=Ae–Ea/RT
其中:K=kp(kd/kt)½ 则:Ea=Ep+Ed/2–Et/2
74
一般情况下: Ep≈29kJ•mol–1, Ed≈126kJ•mol–1 Et≈17kJ•mol–1
10
一、 聚合的可能性
• 主要取决于双键上取代基的空间 效应
11
1.烯类单体: CXY=CMN
(1)一取代( CH2=CHX)
可均聚合
12
(2)二取代
(CH2=CXY、CHX=CHY) (a)1,1——二取代:一般不考虑空 间位阻效应,可均聚合。
注意:CH2=C(Ar)2只能形成二聚体
13
(b)1,2——二取代
54
2.半衰期
[I] ln = Kd t [I0]
• 60℃
ln2 t½ = K d
(3—17)
t½ >6h,低活性引发剂 1h< t½ <6h,中活性引发剂 t½ <1h,高活性引发剂
55
3. 引发效率
第3章自由基聚合反应

高分子化学
第3章 自由基聚合反应
3.3-3.4
3.3.3.2 引发剂效率
引发聚合的引发剂占引发剂分解和消耗总量的分率称为引发 剂效率(initiator efficiency),用f表示。 诱导分解(inducer decomposition) 诱导分解是指自由基向引发剂的转移反应。
f:一般为0.8,?过氧源自二异丙苯高分子化学第3章 自由基聚合反应
3.3-3.4
主要类型: 氢过氧化物:
如:特丁基过氧化氢(t-BHP)、异丙苯过氧化氢(CHP)
过氧化二烷基
如:过氧化二特丁基、过氧化二异丙苯
低活性
过氧化二酰基
如:BPO、过氧化十二酰(LPO)
过氧化酯类
如:过氧化特戊酸特丁酯(BPP)、过氧化苯甲酸特丁酯
Mx + ROOH
Mx OH + RO
过氧化物引发剂容易发生诱导分解,而偶氮类引发剂不 容易诱导分解。 诱导分解的结果:引发效率下降
高分子化学
第3章 自由基聚合反应
3.3-3.4
笼蔽效应(cage effect) 在溶液聚合反应中,浓度很低的引发剂分子被溶剂分子 包围,像处在笼子中一样。引发剂分解成初级自由基后,其 寿命非常短,只有10-11~10-9s,,必须及时扩散出溶剂笼子, 才能引发单体聚合。否则部分初级自由基来不及扩散就偶合 成稳定物质,使初级自由基浓度下降,致使引发效率降低。
3.3-3.4
向溶剂和链转移剂的转移反应也会使引发效率下降。 此外,引发剂、单体的种类、浓度、溶剂的种类、体系粘 度、反应方法、反应温度等都会影响引发效率。
表3-13 偶氮二异丁腈的引发效率(f)
单体 丙烯腈 苯乙烯 醋酸乙烯
f/% 约100 约80 68~82
自由基反应机理分析

自由基反应机理分析自由基反应是一种极其重要的化学反应,它在有机合成中发挥着至关重要的作用。
自由基反应机理复杂多变,涉及到许多不同的步骤和分子间的相互作用。
在这篇文章中,我们将深入探讨自由基反应的机理,并分析其中的关键步骤。
首先,让我们来了解一下自由基是什么。
自由基是一个带有未成对电子的原子或分子,具有非常高的反应性。
由于其不稳定的性质,自由基往往会寻找其他分子中的电子,进行化学反应。
在自由基反应中,通常会有三个基本步骤:引发步骤、传递步骤和终止步骤。
引发步骤是自由基反应中的第一步,也是最关键的一步。
在引发步骤中,一个外部能量源会激发一个分子内部的键,从而生成两个自由基。
这两个自由基将会继续参与到后续的反应过程中,引发更多的反应发生。
传递步骤是自由基反应中的第二步,也是一个非常重要的步骤。
在传递步骤中,两个自由基会发生相互作用,其中一个自由基会将其未成对的电子转移到另一个自由基上,从而形成一个新的分子。
这个过程将会不断重复,直到所有的自由基都参与到了反应中。
终止步骤是自由基反应中的最后一步,也是一个非常关键的步骤。
在终止步骤中,所有的自由基都会通过与其他分子发生反应而被消耗殆尽,从而停止反应的进行。
如果没有足够的终止步骤发生,那么反应将会继续进行下去,导致不必要的副反应发生。
在自由基反应中,反应的选择性和产物的构成往往由引发剂的选择和反应条件的控制来决定。
引发剂的选择将会影响到生成的自由基的种类和数量,从而影响到反应的速率和选择性。
而反应条件的控制则可以调节反应的温度、溶剂、光线等因素,从而影响到反应过程中各种步骤的进行。
总的来说,自由基反应机理是一个非常复杂的过程,涉及到许多不同的步骤和相互作用。
通过深入了解和分析自由基反应的机理,我们可以更好地设计和控制有机合成反应,从而获得更高产率和纯度的产物。
希望通过本文的介绍,读者对自由基反应的机理有了更深入的理解。
有机化学课件(李景宁主编)第3章-单烯烃
总目录
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
1. 构造异构(constitutional isomerism)
构造异构——分子式相同,原子或基团在分子 中连接次序不同。
碳干异构:
位置异构:(官能团变位)
CH3 CH2 CH CH2
CH3 CH2 CH CH2
CH3 C CH2 CH3
CH3 CH CH CH3
a > b;c > d
a > b,c > d
优先基团同侧-(Z) 优先基团异侧-(E)
总目录
Cl >H,Br >CH3 (E)-
I >CH3,Br >H (Z)-
(E)
(Z)
总目录
(E)-2,2,4-三甲基-3-己烯 (E)-2,2,4-trimethyl-3-hexene
(E)-3,4-二甲基-2-戊烯 顺-3,4-二甲基-2-戊烯 (E)-3,4-dimethyl-2-pentene
因为内能:烯烃 > 烷烃,所以氢化反应放热
总目录
烯烃
氢化热 kJ.mol-1
137.2 125.1 126.8 119.7
115.1
总目录
烯烃
氢化热 kJ.mol-1
126.8
119.2
112.5
111.3
总目录
(1)稳定性:反式 > 顺式 (2)C=C连接的烷基越多越稳定 • 稳定性:
• R2C=CR2 > R2C=CHR > RCH=CHR ≈ R2C=CH2 > RCH=CH2 > CH2=CH2
总目录
注意:
• 顺、反与Z、E是两种不同的表示烯烃几 何构型的方法,在大多数情况下,不存 在对应关系。即顺式不一定是Z构型,而 反式不一定是E构型。例如:
有机化学反应机理的研究

-0.27
-0.01 -0.17 0
I
COMe CF3 NO2
+0.352
+0.376 +0.43 +0.71
+0.276
+0.502 +0.54 +0.778
由表可知,凡σ为正值的原子团都是吸引电子的原子团,而 σ为负值的原子团都是排斥电子的原子团。
2、反应常数ρ
取代基常数σ定量地表示取代基的极性效应,只 取决于取代基的结构和位置,与反应类型和反应条 件无关。 • 研究取代苯甲酸酯的水解反应,建立了关系方程 哈密特(Hammett)方程: lgK/K0 = σρ 或 lgk/k0 = σρ K和K0、k/k0分别为取代苯甲酸酯和苯甲酸酯的水 解平衡常数和速率常数 • ρ称为反应常数,是反应对取代基极性效应的敏感 性的定量尺度,ρ决定于反应特性和条件,同一类 型的反应在相同条件下ρ值相同。
五、立体化学证据 从立体化学的信息获得有关机理的证明 根据化合物的构型、构象等变化作出理性的判断
空阻差别不大, 得热力学产物
樟脑衍生物 分子中羰基 的还原
六、动力学证据
• 研究各种反应因素,如浓度、压力、温度、催化剂等对 反应速度的影响。可以提供有关反应过程的信息。 • 反应速度是反应物消失的速度或产物生成的速度 。多步 反应中,决速步骤是反应速度最慢的一步。
第二节 热力学控制及动力学控制
某一反应物A在一定条件下可能转变成两种产物B和C
速率常数 kB<kC (形成C快于B)
平衡常数 KB>KC (B比C更稳定) B
A
C
1、反应初期
⊿G C <⊿GB (活化自由能) kC>kB , A转变成C较容易, [C]>[B] 2、若平衡 主产物为C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上述基元反应中,双分子反应是最常见的;单分子反应次之; 三分子反应为数很少。至今尚未发现三分子以上的基元反应。
2010秋
华东理工大学-王朝霞课件
7
化学反应
化学反应包括由反应物向产物的转化,反应主要以单分子 或双分子反应进行。
1。 3。 CH3 4。 2。 CH3CH C CH2CH2CH3
CH3 CH3
2010秋
华东理工大学-王朝霞课件
22
d. 碳自由基的稳定性
常见碳自由基稳定性顺序
CH2
> ( CH3)3 C > (CH3)2 CH > CH3CH2 > CH3
CH2 CH CH2
2010秋
华东理工大学-王朝霞课件
③ 少量氧可以抑制反应的进行,因生成不活泼的过氧甲基自 由基(CH3OO·)而使反应终止,待一段时间氧消耗完后, 反应还可继续,此段时间称为诱导期。
2010秋
华东理工大学-王朝霞课件
11
反应机理及其所解决的问题
反应机理是由反应物转变为产物的途径,若为基元反应, 则为一步反应得到产物;若不为基元反应,则可以分解为多步 基元反应过程。
碳自由基、碳正离子、碳负离子、键的极性与反应 活泼中间体、过渡态结构。 3. 自由基反应历程:自由基取代反应、自由基加成反 应(烯烃自由基加成、合成有机过氧化物的自由基 加成)。
2010秋
华东理工大学-王朝霞课件
2
教学大纲
4. 亲电反应历程:亲电加成反应(马尔科夫尼科夫规 则、加卤化氢、加卤素、加次卤酸)。亲电取代反 应。
2010秋
华东理工大学-王朝霞课件
26
结论 自由基愈稳定愈容易形成; 烷基取代数目愈多,形成的自由基稳定性愈大; 共轭强度越大,自由基越稳定; 超共轭强度越大,自由基越稳定。
2010秋
华东理工大学-王朝霞课件
27
碳正离子
碳正离子是由键的异裂失去成键电子而产生的。碳正离子极 不稳定,仅存在极短的时间(约10-9 s),不易捕捉,但核磁共 振仪可观察到它的存在。
2010秋
华东理工大学-王朝霞课件
20
快速翻转的角锥体
角
锥
复杂的烷基自由基多为快速翻转的角锥型结构,如叔丁基
构
自由基,转换的能量为2.51 KJ/mol,孤电子处在一个sp3杂
型
化轨道上,烯基取代自由基也容易翻转,反应后手性消失。
刚性角锥体
在二环[2.2.2]-1-辛基自由基中,孤电子也处在一个sp3杂化 轨道上,但由于桥环的原因,碳的构型不能翻转,是一刚 性角锥体结构。
23
从键的离解能推知自由基的稳定性
CH3-H → ·CH3 + H·
435 KJ/mol
难
CH3CH2-H → ·CH2CH3 + H·
410 KJ/mol
CH3CH-H → ·CHCH3 + H·
395 KJ/mol
CH3
CH3
CH3 CH3 CH3C-H → ·CCH3 + H·
CH3 CH3
反应级数与反应分子数的差别
a) 反应分子数和反应级数是属于不同范畴的二个概念,前者为 理论的概念,而后者为实验的概念,必须加以明确地区别。
b) 质量作用定律只适用于基元,不适用于非基元反应和总包反 应,后者的速率方程必须由实验测定。
c) 鉴定一个反应是否是基元反应,往往要做长期的大量的动力 学研究工作。
2010秋
华东理工大学-王朝霞课件
8
反应级数与反应分子数的差别
概念所属 范围
定义或意义
反应 级数
是对宏观 的总包反 应而言的
反应的宏观 速率对浓度 的依赖的方
次
反应 是对微观 参加该反应 分子 的基元反 的反应物微 数 应而言的 粒数目
允许值
整数、 分数、 零或负
数
只可能 是一、 二、三
对指定反应 是否有固定
HCl Cl
HCl
化学反应
CH3Cl Cl
基
元
Cl2
反
应
CH3Cl
CH3CH3
2010秋
华东理工大学-王朝霞课件
10
从各步基元反应我们可以认识到:
① 可通过对反应的原料配比、光照时间、反应温度、投料方 式等的变化来控制反应产物。
② 反应是自由基型,可以被高温、光照、过氧化物所催化, 一般在气相或非极性溶剂中进行。
2010秋
华东理工大学-王朝霞课件
25
CH2 CH2 CHCH2
p-
p-
共轭效应
H
HCHH3 C H
CHH3 CC CHC3
> Leabharlann H3p H H C HH
p-σ超共轭效应
共轭强度越大,自由基越稳定;σ-p超共轭的强度 与C-H键数目有关,σ-p重叠的几率越大,超共轭强度越 大,自由基越稳定。
研究反应机理的意义 了解影响反应的各种因素,最大限度地提高反应的产率。 发现反应的一些规律,指导研究的深入。
2010秋
华东理工大学-王朝霞课件
13
反应热和活化能
反应热是状态函数,仅表示反应物与产物的能量差。反应热 可以通过离解能数据计算得出。
CH3 H
435
Cl Cl
243
CH3 Cl
CH2 CH CH2
2010秋
华东理工大学-王朝霞课件
30
碳正离子是缺电子的,任何使中心原子电子云密度增加的基团都 能使碳正离子稳定,影响碳正离子稳定性的因素有以下四点:
电子效应 空间效应 芳香性 溶剂效应
2010秋
诱导效应 共轭效应 超共轭效应
请同学课后复习相关教材并分 析比较各种碳正离子的稳定性
反应机理(或反应历程)就是对反应物到产物所经历过程 的详细描述和理论解释,特别是对中间体杂化状态、能量变化 的描述。
依据的实验事实越多,则由此作出的理论解释越可靠。一 个反应的历程应经得起实验事实的考验,并应有一定的预见性。
2010秋
华东理工大学-王朝霞课件
12
反应机理所要解决的问题
反应是如何开始的? 反应条件起什么作用? 产物生成的合理途径? 决速步骤是哪一步? 经过了什么中间体? 副产物是如何生成的?
15
第三步反应是一个放热反应,活化能只有4 KJ/mol,很容易进行。
过渡态[H3C···Cl···Cl]
4 KJ/mol
E活化
∆H
Cl-CH3+Cl·
·CH3+Cl-Cl
-106 KJ/mol
反应热(∆H):反应物和产物之间的能量差。 活化能(E活化):过渡态与反应物之间的能量差,
是形成过渡态所需的最低能量。
当碳与三个大的基团相连时,由于碳从sp3杂化(角锥型) 转变为sp2杂化(平面型)可以减少取代基间的排斥力, 有利于碳正离子的形成。
5. 亲核反应历程:亲核加成反应(炔烃亲核加成反应、 羰基亲核加成(与格氏试剂、氨的衍生物、水、 醇)、环醚的亲核加成(酸性下,碱性下)、亲核 取代反应(卤烷 SN1、SN2瓦尔登翻转;醇与氢卤 酸、卤化物;醚的酸解)、芳环上亲核取代、羧酸 衍生物的亲核取代。
2010秋
华东理工大学-王朝霞课件
3
教学大纲
6. 消除反应历程:卤烷(E1、E2、E1CB、影响因素)、醇 (E1、E2)、季铵盐霍夫曼消除(E2)、消除加成(苯 炔)。
7. △氧化还原反应历程:还原历程(双键和叁键催化加氢、 可溶氢化物还原);氧化反应(醇、酮、烯)。
8. △周环反应机理:周环反应分类(电环化反应,环加成 反应,σ键迁移反应),周环反应的特点。
(CH3)3C·
烷基自由基
2010秋
H2C CHCH2
烯丙基型自由基
桥头碳自由基
华东理工大学-王朝霞课件
19
b. 碳自由基的结构
甲基及其他简单的烷基自由基
★
平面构型 sp2杂化 具有平面的或接近平面的构型
自
由
基
结
H
构
HC
角锥构型 sp3杂化
H
平面结构中,带孤电子的碳为sp2 杂化,孤电子占据一个p轨道。
基元反应 化学反应 反应级数与反应分子数的差别 反应机理及其所解决的问题 反应热和活化能
2010秋
华东理工大学-王朝霞课件
6
基元反应
简称元反应,是指反应物分子在碰撞中能够直接转化为生成 物分子的反应。只有基元反应才服从质量作用定律:在定温下,基 元反应的速率与所有反应物浓度的乘积成正比,各物质浓度的方次 等于反应式中相应物质的化学计量数。
2010秋
一些角华东锥理型工的大学自-王由朝基霞课件
21
c. 碳自由基的分类 各种类型碳、氢的表达方式: 按 与 周 围 连 接 的 碳 原 子 个 数 , 分 别 称 为 伯 碳 (1°)、 仲 碳 (2°) 、叔碳(3°) 、季碳(4°),与之相连的氢则称为伯氢(1°)、 仲氢(2°) 、叔氢(3°) 。相应的碳形成相应的自由基。
349
H Cl
431
H=(435+243)-(349+431)= -102 KJ/ mol
用反应热来说明反应的难易程度是不完全的,因为本反应 不是一步完成的。
2010秋
华东理工大学-王朝霞课件
14
Cl Cl
Cl
CH4
CH3
Cl2
Cl
Cl
H= 243 KJ/mol
CH3
HCl H= 435-431 = 4 KJ/mol
