第十一章含氮化合物
第十一章含氮有机化合物 Microsoft PowerPoint 演示文稿

当氮原子上连有4个烃基时, 形成季铵类化合物。
NH4 X
+
-
4R
[R4N] X
季铵盐
+
-
R 可以相同或不同
X 为卤原子或酸根
R4
+ NX
OH
R4
+ N OH
季铵碱
(二)命名
1、简单胺命名时,以胺为母体,
烃基作取代基。 烃基名称+胺
①烃基相同: 烃基数目+烃基名称+胺
H5C2 NH2
乙胺
H3C N CH3 CH3
HO—C—OH
O=
(一)尿素 (脲)
O H2N C NH2
是人和哺乳动物蛋白质代谢的最终产 物,可配成注射液,可降低颅内压及眼 内压,用于治疗急性青光眼和脑水肿。
1.弱碱性
O H2N C NH2
O
+HNO3
H2N
C
NH2
﹒HNO
3
硝酸脲
硝酸脲不溶于水,易结晶,借此可以 从尿液中提取尿素。
2.水解反应
C2H5
H2N COOCH2CH2N+HCl-
C2H5
作用于外周神经产生传导阻滞作
用,依靠浓度梯度以弥散方式穿 透神经细胞膜,在内侧阻断钠离 子通道,使神经细胞兴奋阈值升 高,丧失兴奋性和传导性,信息 传递被阻断,具有良好的局部麻 醉作用。
用于浸润麻醉,溶液浓度多为
0.25%~0.5%,每次用量 0.05~0.25g,每小时不可 超过1.5g。用作腰麻,1次量 不宜超过0.15g,用5%溶液。 用于四肢的局部静脉麻醉, 0.5%溶液40~150ml。神经 传导阻滞时用 1%~2%溶液,1次不超过1g。
O C NH C C O NH O
第十一章胺和生物碱

O
[
S O
NR H
]
-
Na+
S
O
O S O
+
R 2N H
S O
N R 2 N aOH
不溶解
Cl
+
R N
3
不反应
(三)与亚硝酸的反应 不同类型的胺与HNO2反应,生成不 同的产物。由于亚硝酸不稳定,在反应中 用NaNO2与 HCl(或H2SO4)作用产生。 1. 伯胺
芳香伯胺若在低温强酸性溶液与亚
硝酸反应,生成重氮盐,称为重氮化反应。
2-甲基-3-氨基戊烷
CH3 CH3CHCHNHCH3 CH3
2-甲基-3-甲氨基丁烷
4.季铵盐和季铵碱(命名同无机铵类化 合物) [(CH3)3NC2H5 ]+Br [(CH3)4N]+OH氢氧化四甲基铵
溴化三甲基乙基铵
必须注意“氨、胺、铵”字的用法, 氨用来表示气态氨(NH3)或基团,如氨
基(—NH2),亚氨基( NH);胺用来
2. 仲胺
脂肪仲胺与芳香仲胺与亚硝酸反应,
都是在氮上进行亚硝化,生成N-亚硝基
胺类化合物,强致癌物。
CH3CH2NHCH2CH3 + HNO2 CH3CH2 N CH2CH3 + H2O N O N-亚硝基二乙胺(黄色油状)
N=O NHCH3 + HNO2 N CH3 + H2O
N-甲基苯胺
N-甲基-N-亚硝基-苯胺
的性质。
1. 氧化反应 芳胺很容易被氧化,氧化的产物很复
杂,这取决于氧化剂的性质和反应的条件。
NH2 MnO2 + H2SO4 O
O
对苯醌
2. 亲电取代反应 由于氨基使苯环活化,所以苯胺很 容易发生亲电取代反应。
含氮化合物有机化学

其结构简式为:
+
CH 3
CH2 N C12H25 Br -
CH 3
在人体中存在着一种季铵碱,因最初是在胆汁中发
现的,而且有碱性,故称胆碱。
其结构简式为;
CH 3
+
_
HO CH2 CH2 N CH3 OH
CH 3
胆碱广泛分布于生物体内,脑组织和蛋黄内含量
较高。胆碱是卵磷脂的组成部分。在人体内与脂肪代
H3C N CH 3
+ HONO
N,N-二甲基苯胺
H3C N
NO
CH 3
对-亚硝基-N,N-二甲基苯胺
综上所述,根据脂肪族和芳香族伯、仲、 叔胺与亚硝酸反应的不同, 可以鉴别三种胺。
6、氧化反应
胺有还原性,易被氧化。芳香族胺更易被氧化, 空气中氧即可将苯胺氧化。如苯胺可被氧化生成对苯 醌,因此在有机合成中,如果要氧化芳胺环上其它基 团,必须首先要保护氨基。
SO2Cl
NHCOCH3
NH2
H2O(H+或 OH- )
水解
SO2NH2
SO2NH2
四、 季铵盐和季铵碱
氮原子上连有4个烃基的化合物称为季铵化合物。 季铵化合物中的四个烃基可以是相同的,也可是不同 的,分为季铵盐(quaternary ammonium salts)和季铵碱 (quaternary ammonium base)。
与羰基化合物类似,含有α-氢的硝基化合物, 在强碱的作用下,可与醛酮发生缩合反应。
11 含氮有机化合物
11.2
一、分类
胺(amine)
氨、NH3 铵NH4Cl
烃基的数目 伯胺 RNH2 仲胺 R2NH
叔胺 R3N
有机化学课件——Chapter 11 含氮和含磷有机化合物

C6H5NH3+ · Cl氯化苯铵
(C2H5NH3+)2 · SO42硫酸二乙铵
(CH3)3N+CH2C6H5 · Br- [(C2H5)2NH2+]2 · SO42溴化三甲基苄铵 硫酸二(二乙铵)
??? ???
C4H9N+ · OH四丁基氢氧化铵
有机化学课件
(C2H5)2NH2+ · HSO4硫酸氢二乙铵
有机化学课件 22 第11章 含氮和含磷有机化合物
一、胺的碱性
N上的未共用电子对能接受一个质子,能与大多数的无机酸成 盐,所以胺具有碱性.
R
NH2 + HCl
R
+NH Cl 3
碱性强弱顺序: 脂肪胺 > NH3 > 芳香胺 pKb 3—4.5 4.75 9—10
在脂肪胺中: RNH2 < R2NH > R3N 一级 二级 三级
Na+
(2) 与羰基化合物缩合
CH3 NO2
-
CH2 NO2
O + R C R'(H)
H2O
OH R C CH2NO2 R'(H)
有机化学课件
10
第11章 含氮和含磷有机化合物
五、硝基对芳环的影响
硝基是强吸电子基, 当其与苯环直接相连时, 使芳环上的亲电取代 反应活性降低, 以致不能进行(如F-C反应). 但在卤代芳烃卤原子(如-Cl)的邻、对位引入-NO2时,卤原子的 反应活性增加,易于发生亲核取代反应.
有机化学课件 25 第11章 含氮和含磷有机化合物
二、胺的酸性
伯、仲胺中N-H键可以电离.
R2NH
R 2N - + H +
考研科目,动物生物化学 第11章 含氮小分子

意义
此种方式既是氨基酸脱氨基的主要方式,
体内有活泼的转氨酶和L-谷氨酸脱氢酶,
反应可逆,也是体内合成非必需氨基酸的
主要方式。
主要在肝、肾组织进行。
4 嘌呤核苷酸循环
氨 基 酸 转 氨 酶 1 α-酮戊 二酸 转 氨 酶 2 谷氨酸 腺苷酸代琥 珀酸合成酶 天冬氨酸
NH3
次黄嘌呤 核苷酸 (IMP)
第11章 含氮小分子代谢
Metabolism of Small Molecules Containing N
重点:联合脱氨基、尿素合成、嘌呤 核苷酸体内分解代谢; 难点:核苷酸从头合成途径、脱氧核 苷酸合成。
本章主要内容
1 2 3 4 5 6 蛋白质的营养作用 氨基酸的一般分解代谢 氨的代谢 α -酮酸的代谢和非必需氨基酸的合成 个别氨基酸的代谢 核苷酸的合成与分解代谢
在转氨酶的催化下,α -氨基酸的氨基转移 到α -酮酸的酮基碳原子上,结果原来的α -氨 基酸生成相应的α -酮酸,而原来的α -酮酸则 形成了相应的α -氨基酸,这种作用称为转氨 基作用或氨基移换作用。
特点
没有游离的氨产生,但改变了氨基酸代谢 库中各种氨基酸的比例。 催化的反应可逆。 其辅酶都是磷酸吡哆醛。
血清转氨酶活性,临床上可作为疾病 诊断和预后的指标之一。
谷丙转氨酶和谷草转氨酶
谷丙转氨酶 (GPT)
谷草转氨 酶(GOT)
(肝脏)
(心肌 肝脏)
3 联合脱氨基作用 (1) 定义
是指氨基酸与α -酮戊二酸经转氨作用 生成α -酮酸和谷氨酸,谷氨酸经L-谷氨酸 脱氢酶作用生成游离氨和α -酮戊二酸的过 程。
生酮氨基酸 生糖兼生酮氨基酸
3 氧化供能
α-酮酸在体内可通过TAC 和氧化磷 酸化彻底氧化为H2O和CO2,同时生成 ATP。
第十一章 含卤和含氮有机化合物

醇
R-CH=CH2 + NaX + H2O
X X Hβ '
+ 2NaOH
乙醇
+ 2NaX + 2H2O
基础化学
第十一章 含卤和含氮含 磷有机化合物
1)消除反应的活性: 3°RX > 2°RX > 1°RX 2) 2°、3°RX脱卤化氢时,遵守扎依采夫(Sayzeff)规则— —主要产物是生成双键碳上连接烃基最多的烯烃。例如:
基础化学
第十一章 含卤和含氮含 磷有机化合物
2)与金属钠的反应(Wurtz 武兹反应) 2R—X + 2 Na R—R + 2NaX 此反应可用来从卤代烷制备含偶数碳原子,结构对称的烷烃 (只适用于同一伯卤代烷,不同烷基无实用价值)。 3)与金属锂反应 卤代烷与金属锂在非极性溶剂(无水乙醚、石油醚、苯)中 作用生成有机锂化合物:
基础化学
第十一章 含卤和含氮含 磷有机化合物
RMgX与醛、酮、酯、二氧化碳、环氧乙烷等反应,生成醇、 酸等一系列化合物。所以RMgX在有机合成上用途极广。格林 尼亚因此而获得1912年的诺贝尔化学奖(41岁)。
用于合成其它有机金属化合物
3RMgCl + AlCl3 2RMgCl + CdCl2 4RMgCl + SnCl4 R3Al + 3MgCl2 R2Cd + 2MgCl2 R4Sn + 4MgCl2
次
CH3 + CH3
极少
CH3 CH2
基础化学
第十一章 含卤和含氮含 磷有机化合物
3 与金属的反应
卤代烃能与某些金属发生反应,生成有机金属化合物——金属 原子直接与碳原子相连接的化合物。 1)与金属镁的反应
chap有机含氮化合物

第十一章 有机含氮化合物主要内容: 芳香硝基化合物 伯、仲、叔胺的制备方法 胺类化合物的性质 重氮盐性质及其应用(取代反应) 季铵盐和季铵碱( Hofmann消除)一、芳香族硝基化合物及其性质Ar NO2¾ 重要的化工原料 ¾ 多硝基化合物——炸药1. 硝基的还原Fe / HCl orZn / HCl orNH2Sn (SnCl2) /HCl(单分子还原)NO2酸性还原RRZn / NaOHRNH NH碱性还原R氢化偶氮苯(双分子还原)¾ 合成上的应用 —— 制备芳香族胺类化合物 (向芳环上引入氨基)2. 芳环上的亲核取代反应——加成-消除机理¾一般条件下芳环上的亲核取代较难发生例:Cl NaOHOH H+高温,高压为什么?SN2过程ClOH无法翻转SN1过程Cl+ ClC(sp2)-Cl不易断裂 含硝基芳香卤代物的取代XNaOHH+135~160oCNO2XNO2 Na2CO3H+NO2100oCXO2NNO2H2OH+OHNO2 OHNO2¾邻或对位 硝基可促进 取代进行NO2OHO2NNO2¾硝基数目 多,取代更 加容易NO2NO2 取代反应的机理 —— 加成-消除机理XOH 加成慢NO2X OHN OO实验证据:i. 动力学证据:双分子反应 ii. NO2在间位时反应难发生 iii. X 为 Cl, Br, I 时反应的速率接近 iv. X = F 时反应速率较快 v. 邻对位硝基增加,反应更加容易X OHN OO消除-X快OH NaOHNO2X OH NOOONa NO2 硝基芳香卤代烃的亲核取代举例OCH3 NO2NO2NaOCH3Cl NO2NaSHNHNH2 NO2NO2NO2 NH2NH2NH2CH3SH NO2NO2NHCH3 NO2NO2 其它底物的类似取代反应X + NuNu +XWWW: 吸电子基各类吸电子基对反应速率的促进作用比较:W: N2 > NR3 > NO > NO2 > CF3O> CR > CN > COOH二、胺类(Amine)的结构、类型 胺类化合物的结构N RR'快速翻转R"R' RN脂肪胺 N 原子一 般为 sp3 杂化R" 转180o "RN RR'对映关系,但无手性手性胺或手性季铵盐手性中心N N手性中心手性中心R1NR4R2R3 类型R NH2伯胺 (一级胺)R NH R'仲胺 (二级胺)R" R N R'叔胺 (三级胺)R3R1 N R4 X R2季铵盐 (四级铵盐)R = 烷基: 脂肪胺 芳基: 芳香胺 胺类化合物的命名C2H5 C2H5 NH2 C2H5 NH C2H5 C2H5 N C2H5MeN Et乙胺二乙胺三乙胺甲基乙基环丙胺NH2CH3NH3CCH3NH CH3 NNH2苯胺N, N−二甲基 苯胺N, 4−二甲基苯胺 氨基吡啶γ NH2CH2CH2NH2 NH2CH2CH2CH2COOH乙二胺γ −氨基丁酸CH3NH CH(CH2)4CH3 CH32−甲氨基庚烷三、胺类化合物的制备方法1. 脂肪族伯胺的制备 氨的烷基化(卤代烷的取代,SN2 机理)RX+ NH3 过量R NH2 + NH4X副反应RXRRR NH R + R N R + R N R XR¾ 有多取代产物,分离有难度 ¾ 2o 或 3o R-X 可能有消除产物 腈、酰胺、肟、腙的还原H2, Raney NiR CNNH3 LiAlH4R CH2NH2O R C NH2LiAlH4H2ORCH2NH2R C N OHR' 肟R C N NH2R' 腙H2 / Ni 或 LiAH4H2 / NiR CH NH2R' 醛酮的还原氨化NH3 过量伯胺NH3 : 醛酮=1 : 2对称仲胺R CR'H2 / Ni ONH3 (过量)为什么要NH3过量?R CR'NHH2 / NiR CH NH2R'NH3RNH2CR'NH2H2 / Ni - NH3RCH NH2 R'R COR'RRCH N CR'R'RH2 / NiR' CH NHR' CHR Gabriel 伯胺合成法OKOH NHor K2CO3 O邻苯二甲酰亚胺O NKOR X 或 R OTsSN2机理O NR ONH2NH2(肼解) 或水解R NH2 酰胺的 Hofmann 降解( Hofmann重排)O Br2 / NaOHR C NH2 R=烷基、芳基R NH2 + CO22. 脂肪族仲胺的制备(一些方法与伯胺的制备类似) 伯胺的烷基化(卤代烷的取代)RXR' NH2 碱R NH R'此方法在合成上的 主要问题是什么?+ HX (碱吸收) 醛酮的还原胺化(亚胺的还原)R CR'NH2 R" OH+RH2 / NiC N R"R CH NH R"R'R' N-取代酰胺的还原O R C NHR'(1) LiAlH4 (2) H2ORCH2NHR'3. 脂肪族叔胺的制备 仲胺的烷基化RX"R NH R' 碱R' RNR"+ HX (碱吸收)"R NH R'n-BuLi"RN Li R'RX 醚R' RNR"胺的取代基 位阻较小, 产率较高。
重氮化合物和偶氮化合物
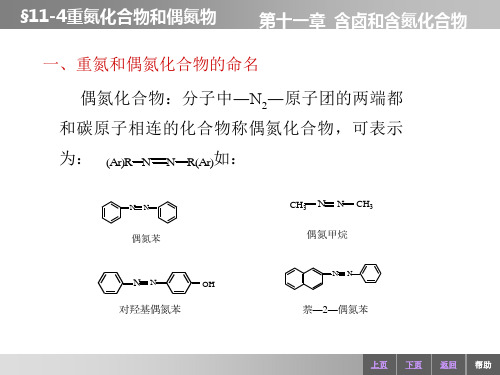
第十一章 含卤和含氮化合物
一、重氮和偶氮化合物的命名 偶氮化合物:分子中―N2―原子团的两端都 和碳原子相连的化合物称偶氮化合物,可表示 为:
(Ar)R N N R(Ar)如:
N N
CH3
N N
CH3
偶氮苯
偶氮甲烷
N
N
N
N
OH
对羟基偶氮苯
萘―2―偶氮苯
上页
下页
返回
帮助
§11-4重氮化合物和偶氮物
产量的50%,在《染料索引》中列入的已超过二千
个品种。从黄到黑各色品种俱全,其中又以黄、橙、
上页
下页
返回
帮助
§11-4重氮化合物和偶氮物
第十一章 含卤和含氮化合物
红、蓝品种最多,色调最为鲜艳。曾广泛用于棉、
毛、丝、麻织品以及合成纤维的染色,也用于塑料、
皮革、橡胶制品的染色。但由于偶氮染料在生产时 使用芳胺等作为原料,在化学染料中某些残留芳胺 也会残存在纺织品上。这些微量的残留芳胺可以通 过汁腺侵入人体致癌,损坏人们的健康。一些国家
第十一章 含卤和含氮化合物
0~5℃
NH3+NaNO2+ HCl
N2Cl +NaCl+H2O
实际制备重氮盐为
三、重氮盐的性质 1.放氮反应 重氮基在一定的条件下,可以被卤素、氰基、 羟基、氢原子等取代,生成相应的芳香族衍生物, 并放出氮气。
(1)被羟基取代 重氮盐和硫酸共热发生水解,
生成酚并放出氮气。
第十一章 含卤和含氮化合物
本节结束
上页
下页
返回
帮助
§11-4重氮化合物和偶氮物
第十一章 含卤和含氮化合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重要中间体, 常用溶剂,缓和氧化剂
(2) 芳香族硝基化合物的物理性质 极性大,b.p高,有苦杏仁味,有毒性,不溶 于水,多硝基物易爆炸,但某些多硝基物有 类似于天然麝香的香气,被称为硝基麝香。
葵子麝香
酮麝香
二甲苯麝香
(3) 芳香族硝基化合物的化学性质 (甲) 还原 硝基化合物被还原的最终产物是胺。还原剂、介质 不同时,还原产物不同。
的磺酰化反应称为Hinsberg reaction(兴斯堡反应) 可用来分离、鉴别伯、仲、叔胺。
百浪多息
ห้องสมุดไป่ตู้
N-二甲基亚硝胺
第二节 酰 胺 命名,和性质都在上一章中介绍过了. 性质补充: 1.酸碱性
酰胺中性,酰亚胺弱酸性
O C C O
NH + KOH
O C C O
K+ + H2O N-
ArN2+为弱的亲电试剂,要求进攻对象的电子云密 度较大。因此,苯环上引入-OH、-NH2、-NHR -NR2等强烈的致活基,可使o-、p-较负,有利于 ArN2+的进攻。
上述反应在pH=8-10进行,是因为ArO-的o-、p-比 ArOH的o-、p-更负;但若pH>10,则重氮盐转变 为氢氧化重氮苯Ph-N=N-OH。 (HO-的)对位有氢,对位偶联;对位无氢,邻位 偶联。
(1) 失去氮的反应
通式:
通过该反应可制得许多芳香化合物。
(甲) 重氮基被氢原子取代
讨论:①用重氮盐的盐酸盐或硫酸盐均可。 ②用H3PO2+H2O作还原剂较好,无副产物。
应用举例:
解: 由
(乙)重氮基被羟基取代
讨论:
①在强酸性介质中进行,以免偶联生成
②用硫酸盐而不用盐酸盐,以免生成 ③ 利用该反应可制备用其它方法难以得到的酚。
[H]:LiAlH4 H2/Ni H2/Pt Fe+HCl SnCl2+HCl
例:
苯胺 重要的染料、药物 中间体
③选择性还原
偶氮苯
偶氮甲烷
4,4'-二羟基偶氮苯
偶氮二异丁腈 (自由基引发剂)
氯化重氮苯 重氮苯盐酸盐
重氮甲烷 (甲基化剂)
氢氧化重氮苯
重氮苯硫酸盐
其中重氮盐在有机合成中有重要意义。
反应条件: ① 强酸性介质,HCl或H2SO4必须过量,否则偶联! ② 低温下进行,否则重氮盐室温下分解! 绝大多数重氮盐对热不稳定,室温下即可分解。干 燥时,重氮盐遇热爆炸。 个别重氮盐室温下稳定。如: 34 °C不分解
(丁) 重氮基被氰基取代
例: 解:
(2) 保留氮的反应 (甲) 还原反应 重氮盐用弱还原剂还原得到苯肼,用强还原剂还原 得到苯胺:
苯肼和苯胺都有重要用途,但都有毒!
(乙) 偶合反应 A.重氮盐与酚的偶合 低温下,重氮盐与酚或芳胺作用,生成偶氮化合物。 重氮盐具有弱的亲电性,偶合反应属于亲电取代反应
第十一章有机含氮化合物
二 胺的结构
NH3(氨)分子中氮原子采取不等性sp3杂化; 有机胺分子中氮原子也是采取不等性sp3杂化:
甲胺
三 胺的物理性质 低级胺有氨味或鱼腥味,高级胺无味。芳胺 有毒! 水溶解度:低级胺可溶于水,高级胺不溶于 水。(氢键、R在分子中所占比重) 沸点:伯、仲胺b.p较高,叔胺b.p较低。 (氢键)
③ HNO2不能过量,否则促使重氮盐分解。 可用淀粉-KI试纸检验过量的HNO2;用尿素除去 过量的HNO2。
NH2CONH2 + 2HNO2
CO2 + 3H2O + 2N2
(二) 重氮盐的反应及其在合成中的应用 重氮盐具有无机盐的性质,如易溶于水、其水溶液 可导电等。 重氮盐的化学性质很活泼,主要发生两大类反应: ① 放出N2的反应;(亲核取代反应) ② 保留N2的反应;(还原或偶联)
2.与亚硝酸的反应
RCONH2 + HNO2 3.脱水反应 RCOOH + N2 + H2O
RCONH2 + P2O5
4.霍夫曼降级反应
RCN + 2HPO3
RNH2 + Na2CO3 + NaX + H2O
RCONH2 + NaOX + 2NaOH
第三节重氮与偶氮化合物
重氮化合物和偶氮化合物都含有-N2-结构片断。 -N2-两端都与C相连者称为偶氮化合物; -N2-只有一端与C相连者称为重氮化合物。
偶合反应的用途:
制备一系列有颜色的化合物(染料、指示剂等)。 例如:
甲基橙 (酸红碱黄,变色范围pH3.1-4.4) 能产生颜色的有机物一般都含有生色基和助色基。
生色基一般含有共轭体系,如
等 助色基一般含有孤对电子
如:
常见染料、指示剂举例:
对位红(染料)
刚果红(染料、指示剂)
萘酚蓝黑B (染棉毛)
例如:
解:
从
(丙) 重氮基被卤素取代 (X=-F、-Cl、-Br、-I) -I取代
-F取代
-Cl取代
-Br取代
Cl
由苯合成
Br
NO2 HNO3 H2SO4 NO2 Cl Zn NaNO2 HBr NH2 Cl HBr CuBr N2Br Br (NH4)2S NH2 NaNO2 NO2 HCl Cl N2Cl HCl CuCl NO2 NO2 Cl
(伯1°)
。
2-甲基-2-硝基丙烷 (叔3°)
③ 根据分子中-NO2的个数:一元、二元、多元 硝基化合物。 对硝基甲苯
间二硝基苯
CH2O NO2 CHO NO2 CH2O NO2
CH3 O2N NO2 NO2
O2N
NO2 NO2
三硝酸甘油酯
2,4,6-三硝基甲苯 1,3,5-三硝基苯
(一) 硝基烷 烷烃分子中一个或几个氢原子被硝基取代的 化合物,称为硝基烷。例如:
CH3NO2
硝基甲烷
C2H5NO2
硝基乙烷
(CH3)2CHNO2
2-硝基丙烷
溶剂、火箭推进剂、赛车燃料
(2) 硝基烷的性质 物性:极性大,b.p高,微溶于水,可做溶剂。 化性:硝基烷最显著的化学性质就是其酸性 (硝基甲烷的pKa=10.2),有α-H的硝基烷 可溶于碱溶液:
(二) 芳香族硝基化合物 (1) 芳香族硝基化合物的制法 芳香族硝基化合物一般采用直接硝化法制备。例如:
分散红玉ZGFL(染料)
第四节硝基化合物 烃分子中的氢原子被硝基取代后的衍生物叫做硝基 化合物。 硝基化合物有三种分类方法:
①根据烃基的不同: RNO2—脂肪族硝基物;ArNO2 —芳香族硝基物
②根据与-NO2相连的碳原子的不同: CH3NO2 硝基甲烷 CH3CH2NO2 硝基乙烷 2-硝基丙烷 ( 仲 2° )
