专题09 强碱滴定三元酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(解析版)
专题01强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(解析版)

专题01强碱滴定⼆元弱酸曲线-2019⾼考复习专题——酸碱中和滴定曲线⼤全(解析版)1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图⽰判断,下列说法正确的是()A. H2A在⽔中的电离⽅程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒⼦浓度的⼤⼩顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,⽤0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所⽰。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中⽔解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加⼊NaOH溶液的体积为20mL,此时反应恰好产⽣NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加⼊NaOH溶液40mL,此时溶液中恰好⽣成亚硫酸钠,根据⽔解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的⼀级电离平衡常数为K a1=c(H+)c(HSO3?)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加⼊NaOH溶液的体积为20mL,此时反应恰好产⽣NaHSO3,为第⼀个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3?)+2c(SO32-)+c(OH-),B正确;C.H2SO3的⼆级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3?)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3?),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3?)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3?),C正确;D.D点为加⼊NaOH溶液40mL,此时溶液中恰好⽣成亚硫酸钠,为第⼆个滴定终点,此时亚硫酸钠⽔解使溶液显碱性,则K h1=K w/K a2=10?14/10?7.19=10-6.81,D正确。
《酸碱中和滴定曲线
酸碱滴定法酸碱滴定曲线全

3)化学计量点
NaOH和HAc定量完全反应,滴定产物为NaAc,Ac1碱性不太弱,则
用最简式计算(P155)
c(OH )/c
K
b
c0
/
c
K
w
c0
/
c
K a
1.001014 0.05 1.8 105
5.3106
pOH 5.27
pH 4.30
3.化学计量点
加入NaOH溶液20.00mL时
c(H )/c c(OH )/c KW 107.00 pH 7.00
4.化学计量点后
加入NaOH溶液20.02mL时
c(OH ) 0.1000mol L-1 20.02mL 20.00mL 5.00105 mol L-1 20.00mL 20.02mL
pH 14.00 5.27 8.73
4)化学计量点后
加入NaOH过量后,溶液的pH由过量的NaOH决定。 加入20.02mL的NaOH后
c(OH 1) (20.02mL 20.00mL) 0.1000mol L1 5.0105 molL1 20.00mL 20.02mL
pOH 4.30 pH 14.00 4.30 9.70
c(H ) 2.001010 mol L-1 pH 9.70
氢氧化钠溶液滴定盐酸溶液时,体系的pH变化
V(NaOH)/mL HCl被滴定% c(H+)
pH 0.00
0.00
0.00
1.00×10-1 1.00
18.00 19.80
90.00 99.00
5.26×10-3 2.28 5.02×10-4 3.30
2)滴定开始至化学计量点
强碱滴定强酸滴定曲线

强碱滴定强酸滴定曲线。
教学要点:酸碱滴定曲线强碱滴定强酸的滴定曲线突跃范围与酸碱浓度的关系(一)酸碱滴定曲线在酸碱滴定中,必须选择合适的指示剂,使滴定终点与计量点尽量吻合。
为此,应当了解滴定过程中尤其是在计量点前后溶液pH值的变化情况。
以滴定过程中混合溶液的pH为纵坐标,以所加入的酸碱标准溶液的量为横坐标,所绘制的关系曲线称为酸碱滴定曲线。
酸碱强度不同,酸碱滴定曲线也不同。
(二)强碱滴定强酸的滴定曲线以O.IOOOmol L-1NaOH 滴定O.IOOOmol L-1HCI 20.00ml 为例说明①滴定前:溶液的pH值取决于HCI的初始浓度[H+] = 0.1000, pH = 1.00②滴定开始至计量点以前:溶液的酸度取决于剩余HCI的浓度。
当滴入NaOH溶液19.98ml (即即滴定误差为-0.1%)时,溶液的[H+]为[H+] = 0.1000 0.02= 5沁0-5, pH = 4.320.00 19.98③化学计量点时:滴入的20.00mL NaOH与20.00mL HCl恰好完全反应,溶液组成为NaCl水溶液,呈中性。
[H+] = [OH -] = 1.00 枪-7, pH = 7.00④计量点以后:溶液的组成为NaCl与NaOH混合溶液,溶液pH取决于过量的NaOH。
当滴入NaOH溶液20.02m1 (即滴定误差为0.1%)时,溶液中的[OH-]为[OH -] = 0.100 0 0.02= 5>l0-5, pOH = 4.3, pH = 9.720.00 20.0219.96 99.80 0.04 0.02 4.00 19.98 99.90 0.02 0.04 4.3 20.00 100.00.000.20 7.00 20.02 100.12.009.7 20.04 100.220.0010.00 20.20 101.010.7022.00110.011.70 40.00 200.012.50酸碱滴定曲线如图i 所示。
酸碱中和滴定曲线图像考点分析

D. 滴定 过程 中可 能 出现 : c( CH。 CO OH ) > f( CH 。 COO一)> C( H )> C( Na )>
c(o H 一 )
解析 : 由图像 中 和 百 分 之 百 时 的 p H 突
跃 可 知 酸 性 最 强 的 是 HA, 最 弱 的 是 HD , 故
一 ( H +) 知 A 项 错
。
因 醋 酸 钠 能 水 解 导 致
HB 两 种 溶 质 , 且 其浓 度 相 等 , 又 因 P 点 时 溶
液呈 酸 性 , 故 可 知 H B 的 电 离 程 度 大 于 Na B
溶液 呈碱 性 , 在点 ② 时 p H 一 7推 知 溶 液 中 含
有 醋 酸
相结 合 思想 的功 能 。
一
= .考 查 溶液 中粒 子浓 度大 小 关系
考 查 电解 质的 强弱 判断
1 1 厂
倒 2 常温下 , 用0 . 1 0 0 0 o t o 1 . L N a O H
溶 液 滴 定 2 0 . 0 0 m L 一
0 . 1 0 0 0 mo l ・L
f( Na 。 。 ) > C( H B) > C( H ) > c( OH )
C ( CH 3 COO H ) +C ( H ) B .点 ② 所 示 溶 液 中 :C ( Na ) 一
c( CH 3 CO O H ) + C( C H 3 CO O 一)
C. p H 一 7时 , 三 种 溶 液 中 : f( A
) 。
器 数 o %
‘ 州日
A. 点 ① 所 示 溶
。
¨ … 川 “
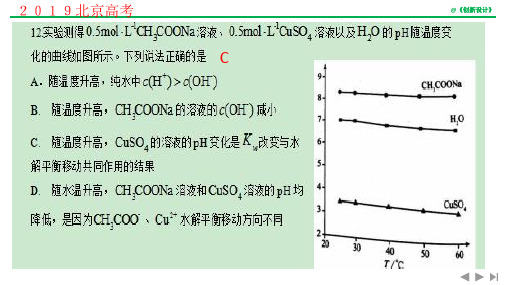
专题10 酸滴定碱的曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。
下列叙述错误的是A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=lgK)B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)C. N2H5Cl溶液中c(H+)>c(OH-)D. K b1(N2H4)=10-62.某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),3.已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。
下列说法错误的是A. n=7B. 水的电离程度先增大再减小C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)4.常温下用0. 1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱XOH、MOH、YOH 溶液中,溶液的pH随加入盐酸体积的变化如图所示。
2020高考化学一轮复习酸碱中和滴定曲线大全专题09强碱滴定三元酸曲线练习

1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液pKa2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)【答案】B【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;B.根据H3AsO4的电离平衡常数计算;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;B.H3AsO4的Ka2=,pH=7时c(HAsO42-)=c(H2AsO4-),Ka2=c(H+)=10-7,pKa2=7,B错误;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度【答案】C3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
专题01 强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(解析版)

1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是()A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10−14/10−7.19=10-6.81,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)【答案】B【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;B.根据H3AsO4的电离平衡常数计算;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;B.H3AsO4的K a2=,pH=7时c(HAsO42-)=c(H2AsO4-),K a2=c(H+)=10-7,pK a2=7,B错误;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH =11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度【答案】C3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是( )A. H3AsO3的电离常数K a1的数量级为10-9B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2OC. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33- )+c(H3AsO3)= 0.1mol·L-1D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)【答案】B4.常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是A. NaH2A水溶液呈碱性B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-)C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O【答案】C【解析】从图像可知H3A 为弱酸,存在电离平衡,H3A H2A-+H+, K a1=[c(H2A-).c(H+)]/c(H3A)=10-2.2;H2A-HA2-+H+;K a2=[ c(HA2-). c(H+)]/ c(H2A-)=10-7,2,H2A-+H2O H3A+OH-水解常数为K= c(H3A).c(OH-)/ c(H2A-),水的离子积常数为K W= c(H+) c(OH-)=10-14,所以K= c(H3A). K W/ c(H2A-). c(H+)=K W/ K a1=10-11.8K a2/K=[ c(HA2-). c(H+)]/ c(H 2A-)=10-7.2/10-11.8=104.6>1,所以电离大于水解,所以NaH2A 水溶液呈酸性,故A错误;B.HA2-A3-+H+;H2O H++OH-,根据电荷守恒c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),B错误;C.因为K a1=[c(H2A-).c(H+)]/c(H3A)=10-2.2;K a1=[c(HA2-).c(H+)]/c(H2A-)=10-7,2,K a1. K a1=[c(HA2-).C2(H+)]/ c(H3A), (K a1. K a2)/ C2(H+)=c(HA2-)/ c(H3A),当溶液至pH=5时, c(H+)=10-5 c(HA2-)/ c(H3A)= (10-2.2. 10-7,2)/ 10-10=10-0.6,故C 正确;D.因为氨水为弱电解质,所以在离子反应方程式中不能拆,故D 错误。
本题答案:C。
5.亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是()A. H3AsO3的电离常数K a1的数量级为10-9B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2OC. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)【答案】B【解析】A. 由图中数据可知,pH=9.3时,c(H2AsO3-)= c(H3AsO3),故H3AsO3的电离常数K a1=,故K a1的数量级为10-10,A不正确;B. 由图可知,pH在8.0~10.0时,H3AsO3的物质的量分数逐渐减小、H2AsO3-的物质的量分数逐渐增大,故反应的离子方程式为H3AsO3+OH-=H2AsO3-+H2O,B正确;C. 根据物料守恒可知,M点对应的溶液中,n(H2AsO3-)+n(HAsO32-)+n(AsO33- )+n(H3AsO3)= 0.1mol,由于不知道此时溶液的体积是多少(或不知道加入KOH 溶液的体积),故无法计算其总浓度,C 不正确;D.由电荷守恒可知,c(H 2AsO 3-)+2c(HAsO 32-)+3c(AsO 33-)+c(OH -)=c(H +)+c(K +), pH=12时,溶液显碱性,由图可知,此时H 3AsO 3主要转化为HAsO 32-和HAsO 32-,说明HAsO 32-和HAsO 32的电离作用小于HAsO 32-和HAsO 32的水解作用,HAsO 32-和HAsO 32水解都产生OH -,故c(OH -)>c(H 3AsO 3),因此,溶液中c(H 2AsO 3-)+2c(HAsO 32-)+3c(AsO 33-)+c(H 3AsO 3)<c(H +)+c(K +),D 不正确。
本题选B 。
6.25℃时,某浓度H 3PO 4溶液中逐滴加入NaOH 溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH 的变化曲线如下图所示:下列说法正确的是:A. 曲线1和曲线2分别表示8(H 3PO 4)和6(HPO 42-)的变化B. 25℃时,H 3PO 4的电离常数K 1=10-2.1C. pH=7.2时,溶液中c(H 2PO 4ˉ)+c(HPO 42-)+c(OHˉ)=c(Na +)+c(H +)D. pH=12.3时,溶液中由水电离出的c(H +)=10-12.3mol/L【答案】B【解析】某浓度H 3PO 4溶液中逐滴加入NaOH 溶液,滴加过程中各种含磷微粒为H 3PO 4、H 2PO 4-、HPO 42-、PO 43-,根据pH 的变化,则曲线1为H 3PO 4,曲线2为H 2PO 4-,曲线3为HPO 42-,曲线4为PO 43-,故A 错误;B 、H 3PO 4的电离常数K 1=()2434P cH O c H c H PO -+(), 25℃当pH 为 2.1时, 24P cH O -= ()34c H PO ,故K 1=()2434P cH O c H c H PO -+()= cH +=10-2.1,故B 正确;C 、pH=7.2时,溶液中微粒为:H 2PO 4-、HPO 42-、OHˉ、Na +、H +,故电荷守恒为:c(H 2PO 4ˉ)+2c(HPO 42-)+c(OHˉ)=c(Na +)+c(H +),故C 错误;D 、pH=12.3时,溶液中含磷微粒有:HPO 42-、PO 43-,此时c (H +)=12.3mol/L ,但水电离出来的c(H +)>10-12.3mol/L ,因为有一小部分在HPO 42-中,故D 错误;故选B 。
7.室温下H 3PO 4溶液中各含磷元素的微粒分布与pH 关系如图所示,下列叙述中不正确的是A. lg[K1(H3PO4)]=-2.2B. 向Na3PO4溶液中滴加稀硫酸至溶液pH=8时,c(HPO42-)>c(H2PO4-)C. 想获得较纯的NaH2PO4溶液,可将溶液pH控制在4~5D. 向磷酸溶液中滴加NaOH溶液至中性:c(Na+)=c(H2PO4-)+c(HPO42-)【答案】D8.柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。
下列说法正确的是A. H3R的第二步电离常数K a2(H3R)的数量级为10-4B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)C. Na2HR溶液中HR2-的水解程度大于电离程度D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)【答案】B【解析】A. 据图可知,随pH的增大,H3R、H2R-、HR2-、R3-在图象中对应的曲线分别为a、b、c、d,H3R的第二步电离常数K a2(H3R)=,由图可知,当c(HR2-)= c(H2R-)时,pH约为4.8,c(H+)=10-4.8mol/L,数量级应为10-5,故A错误;B. 据图可知,pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-),故B正确;C. HR2-大量存在的溶液pH约为5,溶液呈酸性,所以Na2HR溶液中HR2-的水解程度小于电离程度,故C 错误;D. pH=4时,溶液中的阳离子除H+外还有Ca2+、Mg2+等,所以不符合电荷守恒,故D错误;答案选B。
