遗传性大肠癌_CME2011AUG
大肠癌

大肠癌大肠癌包括结肠癌与直肠癌(colorectal carcinoma),是常见的恶性肿瘤。
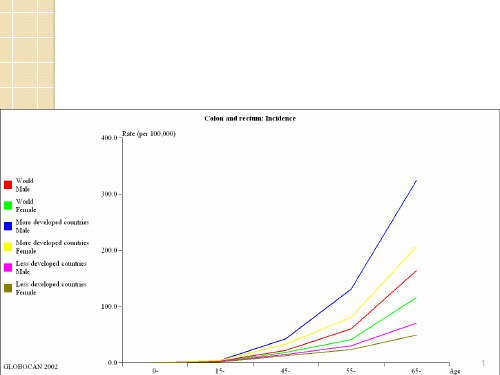
其发病率在世界不同地区差异很大,以北美、大洋洲最高,欧洲居中,亚非地区较低。
我南南方,特别是东南沿海明显高于北方。
近20多年来,世界上多数国家大肠癌(主要是结肠癌)发病率呈上升趋势。
我国大肠癌发病率上升趋势亦十分明显。
【病因和发病机制】大肠癌的病因尚未完全清楚,目前认为主要是环境因素与遗传因素综合作用的结果。
(一)环境因素中国和日本人的大肠癌发病率虽明显低于美国,但移民到美国的第一代即见大肠癌发病率上升,第二代已接近美国人的发病率。
此移民流行病学特点提示大肠癌的发病与环境因素,特别是饮食因素密切关系。
一般认为高脂肪食谱与食物纤维不足是主要相关因素,这已为大量流行病学和动物实验所证明。
(二)遗传因素从遗传学观点,可将大肠癌分为遗传性(家族性)和非遗传性(散发性)。
前者的典型例子如家族性结肠息肉综合征和家族遗传性非息肉病大肠癌。
后者主要是由环境因素引起基因突变(见下述)。
(三)其他高危因素1.大肠息肉(腺瘤性息肉)一般认为大部分大肠癌起源于腺瘤,故将腺瘤性息肉看做是癌前病变。
一般腺瘤越大、形态越不规则、绒毛含量越高、上皮异型增生越重,癌变机会越大。
对腺瘤癌的序列演变过程已有了比较深入的了解,大肠癌的发生是正常肠上皮-增生改变/微小腺瘤-早期腺瘤-中期腺瘤-后期腺瘤-癌-癌转移的演变过程。
在这一演变过程的不同阶段中所伴随的癌基因和抑癌基因的变化已经比较明确,癌基因和抑癌基因复合突变的累积过程被看做是大肠癌发生过程的分子生物学基础。
基因的突变则是环境因素与遗传因素综合作用的结果。
2.炎症性肠病溃疡性结肠炎可发生癌变,多见于幼年起病、病变范围广而病程长者。
3.有报道胆囊切除术后大肠癌发病率增高,认为与次级胆酸进人大肠增加有关。
【病理】据我国有关资料分析,国人大肠癌发生部位约半数以上位于直肠(比欧美为高),1/5位于乙状结肠,其余依次为盲肠、升结肠、降结肠、横结肠。
如何预防遗传性大肠癌

如何预防遗传性大肠癌引言遗传性大肠癌是一种具有明确家族遗传特征的大肠癌。
由于其遗传因素的存在,如果有家族成员曾经患有大肠癌,那么个体患上这种疾病的风险会显著增加。
然而,采取一些有效的预防措施可以降低遗传性大肠癌的风险。
本文将介绍一些预防遗传性大肠癌的方法。
1. 遗传咨询与家族史调查当家族成员中有人患有大肠癌时,应及时寻求遗传咨询。
遗传咨询可以帮助人们了解家族遗传病史,并评估个体患上遗传性大肠癌的风险。
遗传咨询专家可以根据家族史,进行遗传病基因检测,以准确确定遗传性大肠癌的风险程度。
2. 进行定期大肠镜检查定期大肠镜检查是预防遗传性大肠癌的重要手段。
对于家族成员中患有大肠癌的人来说,应该定期进行大肠镜检查,以早期发现和治疗可能存在的癌症病变。
通常情况下,医生会建议每隔1-2年就进行一次大肠镜检查。
3. 保持健康的生活方式保持健康的生活方式对于预防任何类型的癌症都是至关重要的。
以下是一些建议:•合理饮食:增加高纤维食物的摄入,如蔬菜、水果和全谷物;限制肉类摄入,特别是红肉和加工肉制品。
•保持合理体重:肥胖与大肠癌的风险有关。
通过保持适当的体重,可以显著降低遗传性大肠癌的风险。
•运动:进行适当的身体活动可以提高体内免疫系统功能,降低患上大肠癌的风险。
•戒烟限酒:吸烟和过量饮酒都与大肠癌的发病风险相关。
戒烟和限制酒精摄入可以降低遗传性大肠癌的风险。
4. 药物干预对于高风险人群,医生可能会建议药物干预来降低遗传性大肠癌的风险。
药物干预通常包括使用非甾体抗炎药物(如阿司匹林)或选择性环氧化酶-2抑制剂。
这些药物可以减少发炎和抑制肿瘤生长。
5. 学会应对心理压力患有遗传性大肠癌可能会给患者带来心理压力。
因此,学会应对心理压力对于患者的健康至关重要。
可以通过心理咨询、亲友支持、参加支持团体等方式来改善心理健康。
结论遗传性大肠癌是一种具有明确家族遗传特征的疾病。
虽然无法完全消除患上该病的风险,但遵循上述预防措施可以显著降低遗传性大肠癌的患病风险。
林奇综合征名词解释

林奇综合征名词解释
林奇综合征(Lynch syndrome)是一种遗传性肿瘤综合征,也被称为遗传性非息肉病性大肠癌(HNPCC)。
它主要涉及遗传性的DNA修复基因突变,导致家族成员罹患多种癌症的风险显著增加。
这种综合征的特点是家族中有多人患有大肠癌、子宫内膜癌、胃癌、小肠癌、输尿管和肾盂癌、卵巢癌、肝癌、胰腺癌、脑瘤和皮肤癌等多种癌症。
林奇综合征通常是由MLH1、MSH2、MSH6或PMS2等DNA修复基因的突变引起的。
这些基因在维持细胞正常生长和防止肿瘤形成方面起着重要作用。
当这些基因发生突变时,细胞在DNA复制过程中产生的错误无法得到及时修复,从而增加了癌症的风险。
林奇综合征的诊断通常基于家族史和基因检测。
对于有家族史的个体,基因检测可以确定是否存在相关基因的突变。
一旦诊断为林奇综合征,家族成员可以接受定期的筛查和监测,以早期发现和治疗癌症。
预防和管理林奇综合征的主要策略包括定期的癌症筛查、遗传咨询和心理支持。
对于已经确诊的癌症患者,治疗方案通常与常规癌症治疗相同,但可能需要更密切的监测和更频繁的检查,以确保及时发现并处理可能出现的新的癌症病灶。
总的来说,林奇综合征是一种遗传性肿瘤综合征,由DNA修复基因的突变引起,导致家族成员罹患多种癌症的风险增加。
通过基因检测、定期的
癌症筛查和遗传咨询,可以及早发现和管理这种综合征,从而降低癌症的风险和影响。
大肠癌的真面目(真实照片,慎入)

大肠癌的真面目(真实照片,慎入)大肠直肠癌的发生率越来越高,每年台湾约有一万四千人被诊断出大肠直肠癌,所以大家对这个名词一点都不陌生。
许多人都以为大肠直肠癌应该要有血便、便秘、腹胀等症状,其实绝大多数的患者一点症状都没有,几乎都是在定期检查被发现的。
在过去,下消化道摄影是很常使用的检查方式,从*** 灌入显影剂与空气之后,便能检查肠道内是否有异常的病灶。
这张图是由下消化道摄影所发现的大肠癌,原本宽阔、平顺的肠道变得狭窄又凹凸不平,看起来就像吃剩的苹果核。
放个示意图就很容易理解,这就是大肠癌的典型表现。
相信亲眼看过大肠直肠癌的人应该不多,所以会觉得很抽象,其实,只要看过大肠癌的真面目,就能够理解为何会出现某些症状,又为什么有人的肿瘤很大颗却一点症状都没有。
这种大肠癌便会在影像上出现典型的苹果核,厚实的肿瘤沿着肠道长成一整圈,使管径变小,固态粪便就不容易通过。
患者的排便习惯可能变得很紊乱,时而便秘,时而拉稀。
仔细观察肠黏膜,就会发现肿瘤前端与肿瘤后端的肠黏膜颜色不同。
靠近相片上方的肠黏膜是正常的颜色,靠近相片下方的肠黏膜则因为阻塞而变得较不健康。
底下是另一种常见的型态,大肠癌像朵花椰菜般越长越大。
一般来说,长在升结肠的大肠癌较不会造成阻塞,因为这边的粪便很稀,不太会被塞住,所以肿瘤可以长得很大颗,却一点感觉都没有。
这类肿瘤通常都有出血的现象,而使粪便潜血检查呈现阳性反应,但不一定会有血便。
由于大肠癌是由瘜肉发展而来,只要时间足够,就可能出现两颗以上的大肠癌。
所以,完整的大肠镜检查便非常重要,否则可能会遗漏其他正在长大的肿瘤。
(多久做一次大肠镜,才算刚刚好?请医师来解答)刚刚我们提过,大肠直肠癌通常没有特别的症状,所以肿瘤便越长越大,甚至出现转移。
除了肝脏、淋巴结之外,也可能出现腹腔内转移。
肿瘤细胞会像种子一般在腹腔内散播,并于肠系膜、腹膜上落地生根。
图片中可以见到小肠的肠系膜上有多处转移,这种状况非常棘手,预后也很差。
大肠癌的分子病理机制解析

大肠癌的分子病理机制解析大肠癌是一种常见的恶性肿瘤,其发生发展与多个分子病理机制密切相关。
下面将分析大肠癌的分子病理机制。
1.DNA修复基因突变:DNA修复基因突变是导致大肠癌发生的一个重要机制。
在DNA修复基因突变的情况下,DNA中的损伤无法被有效修复,导致遗传物质的错误积累。
具体来说,MUTYH、MSH2、MLH1、MSH6等多个DNA修复基因的突变与大肠癌的发生密切相关。
这些突变可导致细胞遗传物质的变异和不稳定性,促进肿瘤形成。
2. Wnt/β-catenin信号通路激活:Wnt/β-catenin信号通路是一个重要的细胞增殖和分化调控通路,其激活与大肠癌的发生紧密相关。
在正常细胞中,β-catenin与GSK-3β形成复合物,进入细胞核后与TCF/LEF结合从而抑制目标基因的转录。
而在大肠癌中,Wnt信号的激活使得β-catenin稳定并进入细胞核,促进肿瘤相关基因(如c-Myc、Cyclin D1)的转录,从而促进细胞增殖和生长。
3. APC基因失活:APC(腺瘤样息肉病大肠腺瘤相关蛋白)基因是一个重要的抑癌基因,与大肠癌的形成密切相关。
APC基因的突变、缺失或甲基化等异常可导致其失活。
APC基因失活会导致β-catenin稳定,从而使Wnt/β-catenin信号通路持续激活,促进细胞的转化和肿瘤的发生。
4. PI3K/Akt/mTOR信号通路激活:PI3K/Akt/mTOR信号通路的异常活化也是导致大肠癌发生的重要机制之一、PI3K/Akt/mTOR信号通路在细胞的增殖、存活和代谢调控方面起着关键作用。
该通路异常活化可促进肿瘤细胞的增殖、侵袭和转移。
许多人类大肠癌患者表现出PI3K/Akt/mTOR信号通路的异常激活,并与预后不良相关。
5. 基因表达异常:在大肠癌中,许多基因的表达水平异常,包括抑癌基因、促癌基因和调控基因。
例如,抑癌基因p53的突变和丧失可导致基因组不稳定和细胞凋亡的抑制。
遗传性大肠癌综述

遗传性大肠癌2005 蔡三军遗传性大肠癌在大肠癌患者中,约有15%~25%的患者有大肠癌家族史,其中5%~10%的患者的家族史符合孟德尔定律,亦即符合常染色体显性遗传的特征。
临床上依据有无多发性息肉病,可将遗传性大肠癌分为遗传性息肉病和遗传性非息肉病性结直肠癌二大类。
遗传性息肉病又可细分遗传性腺瘤性息肉病和遗传性错构瘤性息肉病,前者包括家族性腺瘤病、Turcot综合征等,后者包括:Peutz-Jeghers综合征、家族性幼年性息肉病、Cowden综合征、Bannayan-Ruvalcaba-Riley综合征等[1,2]。
一、家族性腺瘤病家族性腺瘤病是一组以结直肠多发腺瘤为特征的常染色体显性遗传的综合征,发病率为1/8000至1/10000,约占大肠癌的1%[3,4]。
(一)临床特征1.结直肠病变典型的FAP的定义为:以遍布整个大肠、数目超过100个以上的腺瘤性息肉和微腺瘤为临床表现的常染色体显性遗传综合征。
患者十几岁时开始出现腺瘤,如不治疗,至40岁时100%的患者会转变为结直肠癌[4,5]。
2.上消化道病变超过80%的FAP患者上消化道受累。
胃体、胃底区域的腺瘤称为胃底腺息肉,病理上为增生性息肉,癌变的报道罕见,因此通常不需特殊处理。
与胃底腺息肉不同,胃窦近幽门处息肉大多为腺瘤,属癌前病变,活检证实后应给予完整切除,以防癌变[6,7]。
十二指肠息肉为腺瘤性息肉,好发于十二指肠乳头处,腺瘤有时可以很小而难以发现,有时可很大,以致覆盖一部分十二指肠肠段。
十二指肠腺瘤容易癌变,文献报道FAP患者十二指肠癌的危险为4%;如果十二指肠腺瘤严重或为高危腺瘤,其癌变率更可高达25%。
因此,即便十二指肠乳头外观正常,也应定期对十二指肠乳头以及较大的或疑有癌变的十二指肠息肉进行活检[6~8]。
3.消化道外病变FAP患者可发生甲状腺癌、腹壁韧带样瘤(又称纤维瘤病)等;或皮肤、骨和眼的非肿瘤性生长如骨瘤病、皮脂囊肿、先天性视网膜色素上皮肥大症等非消化道病变[3~5]。
遗传性癌症 基因突变与家族病例分析

遗传性癌症基因突变与家族病例分析在过去的几十年中,癌症已经成为全球最为常见和致命的疾病之一。
虽然大部分癌症是由外界环境因素引起的,但遗传性因素在少数家族中也起到了重要的作用。
本文将探讨遗传性癌症的基因突变与家族病例的分析。
一、遗传性癌症的定义遗传性癌症是指由于遗传突变导致易感基因的功能异常或缺失,从而增加个体患癌风险的一类疾病。
与非遗传性癌症不同,遗传性癌症具有家族聚集性,即相同家族中多个成员患有同一类型的癌症。
二、遗传性癌症的病因遗传性癌症的病因主要与基因突变有关。
目前已发现数百种与癌症相关的遗传突变,其中BRCA1和BRCA2基因突变与乳腺癌、卵巢癌等的发生密切相关,而MLH1、MSH2和MSH6等基因突变与结直肠癌的遗传性发病率较高。
这些基因突变可影响DNA修复、细胞周期调控和凋亡等关键过程,从而导致细胞癌变和肿瘤的发生。
三、家族病例的分析家族病例的分析是识别遗传性癌症的重要步骤之一。
一般而言,具备以下特征的家族可能患有遗传性癌症:①同一家族中多个成员患有相同类型的癌症;②癌症的发病年龄较早;③不同家族成员之间存在亲缘关系。
通过这些特征,我们可以初步判断家族中是否存在遗传性癌症,并进行进一步的疾病基因检测。
四、遗传咨询和遗传测试遗传咨询和遗传测试是对家族病例进行深入分析和评估的重要手段。
遗传咨询师可根据家族病例的情况,提供有关遗传性癌症的相关知识、风险评估和疾病管理建议。
而遗传测试则是通过检测患者的基因组DNA,寻找与癌症相关的突变位点,进一步确认其是否患有遗传性癌症。
五、遗传性癌症的防治对于已经确定患有遗传性癌症的患者,早期预防和治疗至关重要。
根据基因突变的特点,临床医生可以制定个体化的治疗方案,包括手术切除肿瘤、化疗、放疗、靶向治疗等。
此外,定期进行体检和筛查也是预防遗传性癌症的有效手段,例如乳腺癌、卵巢癌患者可以通过定期的乳腺和盆腔超声检查来早期发现病变。
六、遗传性癌症研究的前景随着分子生物学和遗传学的不断发展,对于遗传性癌症的研究也日益深入。
遗传性大肠癌ppt课件
上海市大肠癌发病率
35 30 25 20 15 10 5 0
率(1/10万)
大肠癌的遗传倾向
10-30% 大肠癌患者有家族史 发生大肠癌的概率 (Lovett, Britain)
◦ 一般人群:1/50 ◦ 一名一级亲属患大肠癌:1/17 ◦ 一名一级亲属和一名二级亲属患大肠癌:1/12 ◦ 一名一级亲属患大肠癌,发病年龄<45Y: 1/10 ◦ 二名一级亲属患大肠癌: 1/6
上消化道息肉:
结肠手术后或自20岁开始做上消化道内窥镜检查 定期对十二指肠乳头以及较大的或疑有癌变的十二指肠息肉进行活检
◦ 检查结果正常,每3年做一次 ◦ 发现有高危腺瘤,检查间隔应缩短。
13
衰减型FAP (AFAP)
◦ 属FAP的变异型
◦ 腺瘤数少于100个 (通常在 10-100个之间)
报道为15%(101/680)
◦ 芬兰
报道<3% (4/65)
鉴别诊断
◦ HNPCC
◦ 发病较早的散发性多发性大肠腺瘤
◦ 多原发大肠癌
15
Gardner 综合症
FAP的变异型:APC基因突变 大肠腺瘤病合并多发性骨瘤病、皮肤间叶细胞源性肿瘤
◦ 韧带样瘤 主要死亡原因(肠系膜韧带样瘤) ◦ 皮肤表皮样囊肿(50%-65%) ◦ 皮肤、骨和眼的非肿瘤性病变如骨瘤病(>50%) ◦ 先天性视网膜色素上皮肥大症 ◦ 脂肪瘤
手术方式的选择 :
◦ 结肠切除、回直肠吻合术(IRA,Total Colectomy with ileorectal anastomosis)
适用于直肠腺瘤较少(<20个)的患者。(RC 4-8%@10y & 26-32%@25y)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FAP家族成员的监护
结直肠息肉:
10-12岁起行肠镜检查,间隔:3-12个月
一旦诊断为FAP,选择恰当的时机外科干预
肠镜检查不是有效的防治手段 残留的直肠应每6月肠镜检查,手术或电灼切除新生息肉
24岁后仍未发生息肉,肠镜检查可改为每二年一次,直到34岁,然后每3年一次直到44岁
上消化道息肉:
结肠直肠切除术、回肠造瘘术(TPC,Total Proctocolectomy with permanent ileostomy)
• 适用于伴发直肠癌,无法保肛的患者;或肛门括约肌功能差者。 ASCO/SSO 2006
药物治疗
非甾体类消炎镇痛药(NSAIDs)
Sulinduc(舒林酸) Coxibs
分子生物学检测
基因测序发现有MMR基因缺陷 初步筛查手段
ALLELE 1 CACA(CA)nCACACACACA CACA(CA)nCACACA
可确诊
微卫星稳定性分析
ALLELE 2
免疫组化方法 检测错配修复基因的蛋白表达 (hMLH1、hMSH2、hMSH6)
hMSH2
hMLH1
结肠手术后或自20岁开始做上消化道内窥镜检查
定期对十二指肠乳头以及较大的或疑有癌变的十二指肠息肉进行活检
检查结果正常,每3年做一次 发现有高危腺瘤,检查间隔应缩短。
衰减型FAP (AFAP)
属FAP的变异型 腺瘤数少于100个 发病年龄晚于FAP (通常在 10-100个之间) 腺瘤 44 岁 腺癌 56 岁
•
Turcot 综合症
错构瘤性息肉病
• Peutz-Jeghers综合症
• 幼年性息肉病
• Cowden‘s 综合征 • Bannayan-Ruvalcaba-Riley 综合征
遗传性非息肉病性结直肠癌
FAP
常染色体显性遗传
发生率 1/ 10,000,约占大肠癌的1%
基因突变
APC 种系突变(80%)
4. 除外家族性腺瘤病。
HNPCC发病机理
பைடு நூலகம்
错配修复(MMR)基因的种系突变:
MLH1 MSH2 MSH6 PMS2 PMS1 MSH3, EXO1 TGFβR2 134 (59%) 87 (38%) 3 (1.3%) 2 (0.8%) ? ?
Lynch, de la Chapelle, J Med Genetics, 1999
Amsterdam 标准 II (1998)
亲属中三个以上患有病理证实的HNPCC相关肿瘤(包 括结直肠癌、子宫内膜癌、小肠癌、输尿管癌/肾盂 癌),其中一人为另二人的一级亲属。其中至少一人 发病年龄小于50岁
肿瘤累及连续的二代人。
除外家族性腺瘤病
胃癌
H72
胃癌 62岁
肝癌 60岁
Rare syndromes (<0.1%)
Familial polyposis (FAP) (1%)
了解遗传性大肠癌的目的
发现和诊断遗传性大肠癌
个体化的治疗和随访
家庭成员的监护和治疗
遗传性大肠癌的分类
遗传性息肉病
腺瘤性息肉病
• 家族性腺瘤病(FAP)
– 衰减型FAP – Gardner 综合症
Lynch I型(无肠外肿瘤) Lynch II型(有肠外肿瘤)
对一些常用化疗药耐药
5FU
41个HNPCC家族肠外肿瘤的累计危险度分析(%)
年龄 大肠癌
大肠癌 (美)
胃癌
胃癌 (美)
子宫内膜癌 (女性)
子宫内膜癌 (美)
肝癌
脑癌
小肠癌
30 40 50 60 70 80
3.3 20.7 44.8 68.6 78.6 89.5 78-80
直肠癌 64岁 脑癌 72岁
胃癌 20岁
脑癌 45岁
胃癌 50岁
子宫内膜癌 54岁
子宫内膜癌 34岁 右半结肠癌 39岁
子宫内膜癌 41岁
H130
72岁 胃癌
82岁 胃癌 80岁 胃癌
47岁 直肠癌 50岁 右半结肠癌
48岁 直肠癌 50岁 升结肠癌
肿瘤谱
不同国家肿瘤谱有所不同
西方国家最常见的前十二位肿瘤依次:为前列腺癌、乳腺癌、肺癌、结直 肠癌、膀胱癌、淋巴瘤、子宫癌、恶性黑色素瘤、肾癌、白血病、卵巢癌、 胰腺癌 国内常见前十二种肿瘤依次为:肺癌、胃癌、结直肠癌、肝癌、乳腺癌、 食管癌、胰腺癌、脑癌、膀胱癌、白血病、淋巴瘤、卵巢癌
手术时机的选择:
确诊即手术:腺瘤>1000个,伴重度不典型增生,管状绒毛状腺瘤,直径>5mm
15岁前后:腺瘤<1000个,癌变可能性低者 观察:严重的韧带样瘤家族史,无症状,腺瘤小
手术方式的选择 :
结肠切除、回直肠吻合术(IRA,Total Colectomy with ileorectal anastomosis)
•
•
the relative risk was greater in mutation carrier families than
noncarrier families (3.2-fold versus 1.6-fold).
Young Jin Park, Clinical Cancer Res, 2000
Gardner 综合症
FAP的变异型:APC基因突变
大肠腺瘤病合并多发性骨瘤病、皮肤间叶细胞源性肿瘤
韧带样瘤 主要死亡原因(肠系膜韧带样瘤) 皮肤表皮样囊肿(50%-65%)
皮肤、骨和眼的非肿瘤性病变如骨瘤病(>50%)
先天性视网膜色素上皮肥大症 脂肪瘤
肠外表现常先于大肠腺瘤病
常见肠外肿瘤
子宫内膜癌 葡萄牙 Waston&Lynch 赵波 25% 53例 7/34 17例 11/34 胃癌
王振义
蔡三军
无
9/63
3例
25/63
HNPCC复旦推荐标准
1. 亲属中三个以上患有病理证实的HNPCC相关肿瘤 (包括结直肠癌、子宫内膜癌、胃癌、小肠癌、输尿 管癌、肾盂癌),其中至少一例为结肠癌 2. 肿瘤累及连续的二代人;发病亲属中一人为另二人的 一级亲属 3. 其中至少一人发病年龄小于50岁。
可疑HNPCC患者
提供咨询 MSI或IHC检测
MSH和/或IHC(+) 基因检测(根据IHC结果) 基因突变(+) 基因突变(-)
MSL/MSS和/或IHC(-) 排除
IHC示hMLH1(-)者 MLH1甲基化和/或BRAF突变检测 MLH1甲基化(+)和/或BRAF突变(-) MLH1甲基化和/或BRAF突变(+)
Amsterdam标准的缺陷
没有认识到子宫内膜癌及其他肠外恶性肿瘤对诊断的价值, 部分HNPCC患者可能因此而漏诊 无法发现发生新突变的新发病例 对小家庭和家族史不详者因无法达到足够病例数而漏诊 可能错误地将由于生活方式或地理环境因素造成的好发 CRC的家族诊断为HNPCC
HNPCC的诊断标准
Peel
HNPCC患者12.5% 有家族史的非HNPCC的大肠癌患者5.9% 无家族癌症史的大肠癌患者2.6%
赵波
HNPCC同时和异时大肠癌发生率高达39.5%
蔡三军
Amsterdam组患者28.4%
HNPCC的研究历史
可追溯到1895年 1913年 Aldred Warthin G家族。
0.5 1.5 6.7 11.5 15.4 24.5 19
0 1.2 2.6 8.4 21.7 29.6 43
0.9 1.4 3.2 6.7 8.2 8.2
0 0 0.6 0.6 0.6 4.15
0 0 0 0.9 0.9 0.9
同时和异时多原发大肠癌
Fitzgibbons&Lynch
分别为18.1%和24.2% SCRC患者分别为4.8%和7.7%
尚无明确定义,常见消化道外病变
遗传性非腺瘤病性结直肠癌
(HNPCC, Lynch综合征)
常染色体显性遗传 80-90% 外显率
发病年龄早 (<50Y)
近侧大肠癌多见 (占70%) 同时或异时多原发大肠癌发生率高(35%)
好发某些肠外恶性肿瘤,如子宫内膜癌、胃癌、泌尿系统癌等
MYH种系突变(7.5%)
10-15岁开始出现腺瘤 100% 的患者45岁前发生腺瘤癌变
FAP的诊断
症状: 便血、大便习惯改变、腹痛、贫血、消瘦等 检查:
CF或BE: 结直肠内成百上千的息肉 切取或切除活检,可明确诊断
家族史:60%-70%的家族性腺瘤病患者有明确的家族史
1966年
Lynch
N家族和M家族
癌症家族综合征
80年代末
正式命名为遗传性非息肉病性结直肠癌(Lynch综合征)
强调其遗传性和有别于家族性腺瘤病
H136
I II
脑T(50Y)
头皮癌( 48) 结肠癌( 67)
胃癌
(61)
III
胃癌 51-54y
升结肠癌 (47-) 升结肠癌 (52-55)
• Celecoxib(西乐葆)
• Rofecoxib(万络) NSAIDs不降低FAP腺瘤癌变率
FAP家族成员的监护
强调:对患者的后代定期进行肠道检查
60%-70%的FAP患者有明确的家族史 约30%的FAP患者为没有家族史的新发病例
当先证者的突变已知时,应对其家族成员行基因 检测,以筛选出携带突变基因的高危成员。
