乙酸丁酯的制备
乙酸丁酯生产工艺

乙酸丁酯生产工艺
乙酸丁酯是一种有机化合物,具有广泛的应用领域。
它可以作为溶剂、涂料、香料等方面使用。
本文将介绍乙酸丁酯的生产工艺。
一、原材料准备
乙酸丁酯的生产需要以下原材料:丁醇、乙酸、硫酸和水。
这些原材
料需要经过净化和检验,确保其纯度符合生产要求。
二、反应过程
1.预处理阶段
在反应开始前,需要对反应器进行清洗和消毒。
然后将所需量的丁醇
加入反应器中,并加入催化剂硫酸。
搅拌均匀后,开始加入乙酸。
2.反应阶段
在加入乙酸后,反应温度会逐渐升高,达到80-90℃左右。
此时需要
控制温度不要过高,否则会影响产物质量。
同时也需要控制反应时间,在1-2小时左右即可完成反应。
3.分离阶段
完成反应后,需要进行分离操作。
首先将反应混合物冷却至室温,并加入适量的水进行中和处理。
然后加入碳酸钠,使反应混合物中的硫酸中和。
最后将产物乙酸丁酯和水分离出来,通过蒸馏等方法进行纯化。
三、产品质量控制
在乙酸丁酯生产过程中,需要对产品质量进行严格控制。
主要包括以下方面:
1.原材料纯度:确保原材料的纯度符合生产要求。
2.反应温度和时间:控制反应温度和时间,以确保产物质量稳定。
3.分离操作:通过中和处理和分离操作,保证产物的纯度。
4.产品检测:对产品进行检测,确保其符合国家标准和客户要求。
以上是乙酸丁酯生产工艺的主要内容。
通过科学的生产工艺和质量控制体系,可以生产出高品质的乙酸丁酯产品。
香料乙酸丁酯的制备

三、实验装置与试剂
1、实验药品 丁醇(10ml)、浓硫酸(2 ml) 、冰醋酸(20 ml) 、 10%碳酸钠溶液,盐水,无水MgSO4。 2、实验装置
加热回流装置,普通验步骤
1、在50ml圆底烧瓶中加入1-丁醇(10 ml)、乙酸(20 ml) 、 浓硫酸(2 ml) ,加热回流2h。 2、冷却,将反应混合液转入分液漏斗,分别用盐水(20ml)、 碳酸钠(10%)(15ml)、盐水(20ml)洗涤。 3、有机层干燥(无水MgSO4 )后,蒸馏(所用仪器需干燥), 收集122-126°C的馏分,得乙酸丁酯,称重,计算产率。。
五、实验中的注意事项
1、加药品的先后顺序:丁醇、冰醋酸、浓硫酸。 2、加入硫酸后摇动,混合均匀,避免硫酸局部过浓导致炭 化,溶液变黑。 3、浓硫酸的作用:催化剂(加快反应速率)、吸水剂(使 可逆反应向生成乙酸丁酯的方向移动)。 4、盐水洗涤:减少酯在水中的溶解度,防止乳化,利于分 层。
5、碳酸钠溶液的作用:吸收未反应的乙酸和硫酸。
6、不能用NaOH溶液代替碳酸钠溶液:因为 NaOH溶液碱性强促进乙酸丁酯的水解。
7、提高乙酸丁酯的产率的方法:加入浓硫酸、加 入过量的乙酸或丁醇、延长反应时间。
一、实验目的
1.通过乙酸丁酯的制备,加深对酯化反应的理解;
2.了解乙酸丁酯的分离提纯方法。
二、实验原理
酸和醇起作用,生成酯和水的反应叫做酯化反应。在 浓硫酸催化下,乙酸和丁醇生成乙酸丁酯:
CH3COOH + HO(CH2) 3CH3浓硫酸 CH3COO(CH2)3CH3 + H2O
△
该反应经历了加成-消去的过程。质子活化的羰基被 亲核的醇进攻发生加成,在酸作用下脱水成酯。酯化反应 是可逆反应,为了提高酯的产量,为使平衡向生成酯的方 向移动,常常使反应物之一过量,或将生成物从反应体系 中及时分离出去(将乙酸乙酯及时蒸出或将水吸收)。
乙酸丁酯的制备的化学方程式

乙酸丁酯的制备的化学方程式乙酸丁酯(也称为丁酸乙酯)是一种常见的酯化合物,化学式为C6H12O2。
它是由乙酸和丁醇反应生成的。
乙酸丁酯具有水果香味,常用作溶剂和合成香料的原料。
乙酸丁酯的制备可以通过酯化反应来实现。
酯化反应是一种酸催化反应,将醇与酸酐(酸的酯)反应生成酯。
在乙酸丁酯的制备中,乙酸充当酸酐,而丁醇充当醇。
具体的化学方程式如下:CH3COOH + C4H9OH → CH3COOC4H9 + H2O乙酸和丁醇在酸催化下反应生成乙酸丁酯和水。
反应中酸催化剂可以选择无水硫酸或磷酸等。
这些酸催化剂能够加速酯化反应的进行,并且在反应结束后可以被蒸馏去除。
乙酸丁酯的制备过程可以分为以下几个步骤:1. 准备原料:将乙酸和丁醇准备好,确保它们的纯度和质量符合要求。
2. 反应体系的配置:将乙酸和丁醇按照一定的摩尔比例加入反应容器中。
一般情况下,乙酸和丁醇的摩尔比例为1:1。
3. 添加酸催化剂:向反应容器中添加酸催化剂,常用的酸催化剂有无水硫酸和磷酸。
4. 加热反应混合物:将反应容器中的混合物加热至适当的温度。
酯化反应一般需要在较高的温度下进行,通常为100-130摄氏度。
5. 反应时间控制:根据具体的反应条件,控制反应时间,使反应达到理想的程度。
一般来说,反应时间在数小时至一天之间。
6. 分离产物:反应结束后,将反应混合物进行分离。
由于乙酸丁酯的沸点较低,可以通过蒸馏的方式将其分离出来。
以上就是乙酸丁酯的制备过程及化学方程式的详细描述。
乙酸丁酯作为一种重要的化学品,在化工、制药和香料等领域有广泛的应用。
了解其制备过程有助于我们更好地理解和应用该化合物。
乙酸丁酯反应原理

乙酸丁酯反应原理乙酸丁酯(Butyl acetate)是一种常用的有机溶剂,其化学式为C6H12O2,由乙酸和丁醇反应制得。
乙酸丁酯具有较低的沸点、较好的溶解性和挥发性,广泛应用于涂料、油墨、胶黏剂和清漆等行业。
乙酸丁酯的制备反应是一种酯化反应,即酸与醇反应生成酯的过程。
具体而言,乙酸丁酯由乙酸和丁醇在酸催化剂的存在下发生酯化反应,生成乙酸丁酯和水。
酸催化剂通常采用无机酸如硫酸、磷酸或有机酸如甲苯磺酸。
酸的存在可以加速反应速度,促使酯化反应进行。
酯化反应的原理是羧酸和醇发生酯键形成,同时伴随着水分子的释放。
先由酸催化剂将一分子乙酸质子化,形成乙酸根离子,然后乙酸根离子与丁醇发生亲核取代反应,醇的氧原子攻击碳原子,断裂碳氧单键形成中间物质,最后经过质子转移、断裂醇的σ键和羧酸的π键,形成酯的酯化产物。
乙酸丁酯反应的化学方程式如下:CH3COOH + C4H9OH → CH3COOC4H9 + H2O乙酸丁酯的制备条件和反应速率主要受到以下几个因素的影响:1. 反应物浓度:当乙酸和丁醇的浓度较高时,反应速率较快,但是过高的浓度也会导致产物的回流沉淀,降低反应效率。
2. 反应温度:一般情况下,反应温度越高,反应速率越快,但也要考虑到副反应的发生和安全性。
3. 催化剂选择:选择适当的催化剂对反应速率有重要影响。
硫酸等强酸催化剂能够促进酯化反应,但也容易引起副反应和热分解。
因此,需要选择适当浓度和适宜温度下的催化剂。
4. 反应时间:反应时间越长,反应程度越大,但是过长的反应时间也会导致产物的分解、副反应的增加。
乙酸丁酯的制备反应需要进行适当的控制,以保证产率和纯度。
在实际应用中,还可以通过逆流酯化反应和连续流动酯化反应等工艺来提高乙酸丁酯的制备效果。
总体而言,乙酸丁酯的制备反应是一种经过酸催化剂作用的酯化反应。
通过适当选择反应条件和催化剂,可以得到高产率和高纯度的乙酸丁酯。
乙酸丁酯在涂料和化工等领域具有广泛应用,其制备原理的了解和掌握对于相关行业的发展具有重要意义。
化工专业实验乙酸丁酯的合成与精制

乙酸丁酯的合成与精制一、乙酸丁酯简介1、乙酸丁酯1.1、物化性质:无色有果香气味的液体。
沸点(101.3kPa)126.114℃,熔点-73.5℃,相对密度(20℃/4℃)0.8807,燃点为421℃。
闪点(闭口)27℃;爆炸极限(下限)1.4%(vol),(上限)8.0%(vol)。
乙酸丁酯微溶于水,能与醇、醚等一般有机溶剂混溶。
乙酸丁酯与低级同系物相比,乙酸丁酯难溶于水,也较难水解。
但在酸或碱的作用下,水解生成乙酸和丁醇。
1.2、性质:分子式:C6H12O2 。
分子量:116.16 。
FEMA:2174 。
密度:0.8764熔点(℃):-77.9沸点(℃):126.1闪点(℃):22(闭杯)折射率:1.3907(19℃)色状:无色液体。
溶解情况:溶于醇、醚、醛等有机溶剂,溶于180份水。
稳定性:在弱酸性介质中较稳定。
1.3、用途:乙酸正丁酯是一种重要的化工产品,也是重要的有机合成中间体,广泛用于有机合成、塑料、涂料等工业。
它是化工、军工、医药等行业的主要溶剂,特别是清漆、人造革、塑料等物质的良好溶剂。
此外,它还是制造油漆、飞机漆的主要原料[1],可用于香料、化妆品、食品添加剂、防腐防霉剂和药物的合成工业中。
乙酸正丁酯具有广泛的应用价值和巨大的发展前景。
二、乙酸丁酯的合成2.1、乙酸丁酯的合成乙酸丁酸合成实验是我们有机化学实验教材中一个典型的酯化反应,现行实验教材的合成方法是以液体浓硫酸作催化剂由乙酸和丁醇加热回流而制得,浓硫酸易导致较多的副反应,使得原料消耗量大,选择性差,产率低,实验后处理过程复杂,废水排放量大,这些弊端与日益兴起的绿色化学背道而驰.如何充分利用原材料,减少或消除化工过程对环境的污染,获得对环境友好的新工艺,是每个化学工作者亟待解决的问题,是每个从事化学工作行业无法推却的责任。
近年国内科研单位高等院校和化工企业继续保持对乙酸丁酯合成技术的科研攻关活跃发展的势头,为克服传统浓硫酸催化剂工艺方法的诸多缺点,研究者皆在致力于新型催化剂的筛选和实用工艺的开发,力求达到催化活性高、使用寿命长、可回收重复使用、产(收)率高、产品质量好、设备维护耗费低、节约能源、三废尽量少、投资费用小的目标。
乙酸丁酯工业生产方法

乙酸丁酯工业生产方法
乙酸丁酯是一种常用的有机化合物,主要用于合成有机溶剂、塑料等。
其工业生产方法主要有酯化法和酸酐法。
1.酯化法:
酯化法是最常用的乙酸丁酯生产方法。
其原料为正丁醇和乙酸,在酸
性条件下进行反应。
具体步骤如下:
(1)将正丁醇和乙酸按一定比例加入反应釜中。
(2)在适当温度下,加入催化剂,常用的有硫酸、磷酸等。
(3)调节反应釜的压力和温度,使反应在较高的温度和适当的压力下
进行。
(4)在反应过程中,将产生的水分和未反应的正丁醇等不挥发物质通
过分离装置进行分离。
(5)经过短暂的冷却,收集得到乙酸丁酯。
2.酸酐法:
酸酐法是另一种常用的乙酸丁酯生产方法。
其原料为正丁醇和乙酸酐,在酸性条件下进行反应。
具体步骤如下:
(1)将正丁醇和乙酸酐按一定比例加入反应釜中。
(2)在适当温度下,加入催化剂,常用的有硫酸、磷酸等。
(3)调节反应釜的压力和温度,使反应在较高的温度和适当的压力下
进行。
(4)在反应过程中,将产生的水分和未反应的正丁醇等不挥发物质通过分离装置进行分离。
(5)经过短暂的冷却,收集得到乙酸丁酯。
酯化法和酸酐法在乙酸丁酯的生产中各有优缺点:
酯化法的优点是原料使用较为简单,催化剂也较为常见,容易控制反应条件,适用于大规模生产。
而酸酐法的优点是反应速度较快,反应温度相对较低,产率较高。
但是,酸酐法需要使用乙酸酐作为原料,成本相对较高。
在实际生产中,选择乙酸丁酯的生产方法需要根据生产规模、原料成本、反应速度和收率等因素进行综合考虑。
乙酸正丁酯的制备

乙酸正丁酯的制备乙酸正丁酯是一种常用的有机溶剂,也常用于制备其他有机物。
本文将详细介绍乙酸正丁酯的制备过程。
一、实验原理乙酸正丁酯的制备是通过乙酸和正丁醇的酯化反应实现的。
酯化反应需要催化剂和水的存在。
其中催化剂可以使用浓硫酸或氯化铵二乙酰。
反应的化学方程式如下:CH3COOH + C4H9OH → CH3COOC4H9 + H2O二、实验步骤1、实验器材准备(1) 长颈漏斗(2) 三角瓶(4) 滴管(5) 沸石(6) 醋酸纤维素膜2、制备反应混合液取长颈漏斗中部填充沸石,加入30mL干正丁醇,并在230C油浴内充分加热,使其中加入的干正丁醇完全蒸发为无色清澈液体,冷却至室温,将三角瓶秤重,加入1.5mL浓硫酸,加至室温,将称量的浓硫酸慢慢倒入三角瓶中,瓶口用醋酸纤维素膜密封,将三角瓶放入劳森几上。
将加热后的沸石取出,将其余皆加入在长颈漏斗中已装有滴管的三口瓶中,用膜密封它的口,预热它的全体于油浴内,并反复秒数,直至温度平稳,出水珠完整,达到平衡,称取38.5mL的干乙酸加入三口瓶内,离心,取出水层不要。
3、进行酯化反应将加入浓硫酸的三角瓶立放于沙浴中,将三口瓶的支管以1小时每滴2-3滴的速度,加入全部乙酸,期间温度应维持在35-40℃,反应结束后,分别预加入去离子水、10%的氢氧化钠溶液,由于氢氧化钠溶液与未反应的乙酸起切断反应的作用,所以先加少量氢氧化钠溶液,离心,沉淀物一般为白色或带黄色,水中有些残渣,取上清液,加入适量无水氯化钠溶液,均匀混合,将其均匀装在蒸馏球中止,进行精馏至瓶温为90℃止即可,回收组分收集在含2-3g干氢氧化钠的干彼岸瓶内,并用干燥管通入干燥剂干燥,得到无色透明的液体。
三、注意事项1、实验过程中应注意安全,避免酸性物质对皮肤的损伤。
2、加热操作要进行缓慢,避免反应过程中温度过高。
3、实验中使用的器材应干燥无水,以免影响反应结果。
4、收集精馏的乙酸正丁酯时应加入干燥剂干燥,以去除其中的水份。
乙酸丁酯的制备
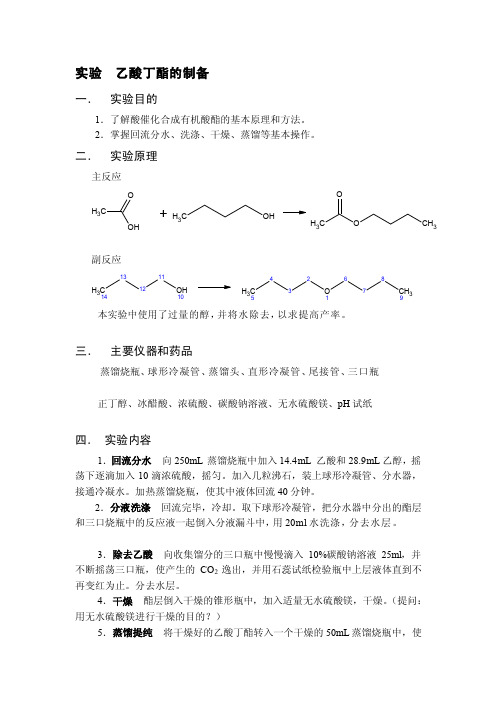
实验乙酸丁酯的制备一.实验目的1.了解酸催化合成有机酸酯的基本原理和方法。
2.掌握回流分水、洗涤、干燥、蒸馏等基本操作。
二.实验原理主反应CH3OOH +C H3OHCH3OO CH3副反应C H314131211OH10CH35432O1678CH39本实验中使用了过量的醇,并将水除去,以求提高产率。
三.主要仪器和药品蒸馏烧瓶、球形冷凝管、蒸馏头、直形冷凝管、尾接管、三口瓶正丁醇、冰醋酸、浓硫酸、碳酸钠溶液、无水硫酸镁、pH试纸四.实验内容1.回流分水向250mL 蒸馏烧瓶中加入14.4mL 乙酸和28.9mL乙醇,摇荡下逐滴加入10滴浓硫酸,摇匀。
加入几粒沸石,装上球形冷凝管、分水器,接通冷凝水。
加热蒸馏烧瓶,使其中液体回流40分钟。
2.分液洗涤回流完毕,冷却。
取下球形冷凝管,把分水器中分出的酯层和三口烧瓶中的反应液一起倒入分液漏斗中,用20ml水洗涤,分去水层。
3.除去乙酸向收集馏分的三口瓶中慢慢滴入10%碳酸钠溶液25ml,并不断摇荡三口瓶,使产生的CO2逸出,并用石蕊试纸检验瓶中上层液体直到不再变红为止。
分去水层。
4.干燥酯层倒入干燥的锥形瓶中,加入适量无水硫酸镁,干燥。
(提问:用无水硫酸镁进行干燥的目的?)5.蒸馏提纯将干燥好的乙酸丁酯转入一个干燥的50mL蒸馏烧瓶中,使用干燥的仪器安装一套蒸馏装置,加入沸石,蒸馏,收集124—126℃的馏分,详细记录蒸馏时馏出物的沸点。
称量产物,计算产率。
五.注意事项1.水不回流到反应体系中就不要放水。
2.反应终点的判断:分水器中不再有水珠下沉,水面不再升高。
反应大约需要40 min 左右。
六.思考题1.反应中生成的水如何除去?2.计算反应安全时应分出的水量?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
★1) 在干燥的50mL圆底烧瓶中,装入11.5mL正丁醇和7.2mL冰醋酸,再
加入3-4滴浓硫酸。混合均匀,投入沸石,然后安装分水器及回流冷凝管,并 在分水器中预先加水略低于支管口,记下预先所加水的体积。在石棉网上加热 回流,反应过程中生成的回流液滴逐渐进入分水器,控制分水器中水层液面在 原来的高度,不致于使水溢入圆底烧瓶内。约40min后不再有水生成,表示 反应完毕。停止加热。 ★2) 冷却后卸下回流冷凝管,将分水器中液体倒入分液漏斗,分出水层,酯 层仍然留在分液漏斗中。量取分出水的总体积,减去预加入的水的体积,即为 反应生成的水量。把圆底烧瓶中的反应液倒入分液漏斗中,与分水器中分出的 酯层合并。分别用10mL水、10mL10%碳酸钠液、10mL水洗涤反应液,用 10mL 10%的碳酸钠洗涤,检验是否仍呈酸性(如仍呈酸性怎么办?),分 去水层。将酯层再用10mL水洗涤一次,分去水层。 ★3) 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥。 ★4) 将干燥后的乙酸正丁酯倾入干燥的30mL蒸馏烧瓶中(注意不要把硫酸 镁倒进去!)加入1-2粒沸石,安装好蒸馏装置,在石棉网上加热蒸馏。收集 124-126℃的馏分。
乙酸丁酯的制备
(5课时)
【实验目的】
认识酯化反应原理,掌握乙酸正丁酯的制备方法。 掌握共沸蒸馏分水法的原理和分水器(油水分离 器)的使用。
【实验原理】
Reaction: CH3COOH + CH3CH2CH2CH2OH Side reaction: CH3CH2CH2CH2OH H+ CH3CH2CH2CH2OCH2CH2CH2CH3 + CH3CH2CH=CH2 H+ CH3COOCH2CH2CH2CH3 + H2O
【注意事项】
1、冰醋酸在低温时凝结成冰状固体(熔点16.6℃)。取用时 可温水浴加热使其熔化后量取。注意不要触及皮肤,防止烫伤。 2、在加入反应物之前,仪器必须干燥。(为什么?) 3、浓硫酸起催化剂作用,只需少量即可。也可用固体超强酸作 催化剂。 4、当酯化反应进行到一定程度时,可连续蒸出乙酸正丁酯,正 丁醇和水的三元共沸物(恒沸点90.7℃),其回流液组成为: 上层三者分别为86%、11%、3%,下层为19%、2%、97%。 故分水时也不要分去太多的水,而以能让上层液溢流回圆底烧 瓶继续反应为宜。 5、本实验中不能用无水氯化钙为干燥剂,因为它与产品能形成 络合物而影响产率。 6、根据分出的总水量(注意扣去预先加到分水器的水量),可 以粗略的估计酯化反应完成的纯度。
附:【操作要点 操作要点】 操作要点
1.加入硫酸后须振荡,以使反应物混合均匀。 2.反应应进行完全,否则未反应的正丁醇只能在最后一步蒸馏时与酯形成 共沸物(共沸点117.6℃)以前馏分的形式除去,会降低酯的收率。 3.反应终点的判断可观察下面两种现象:一是分水器中不再有水珠下沉; 二是从分水器中分出的水量达到理论分水量,即可认为反应完成。 4. 洗涤操作(分液漏斗的使用): (1)洗涤前首先检查分液漏斗旋塞的严密性。 (2)洗涤时要做到充分轻振荡 充分轻振荡,切忌用力过猛,振荡时间过长,否则将形 充分轻振荡 成乳浊液,难以分层,给分离带来困难。一旦形成乳浊液,可加入少量食 盐等电解质或水,使之分层。 (3)振荡后,注意及时打开旋塞,放出气体,以使内外压力平衡。放气时 要使分液漏斗的尾管朝上,切忌尾管朝人。 (4)振荡结束后,静置分层;分离液层时,下层经旋塞放出,上层从上口 倒出。 5.干燥必须完全,否则由于乙酸丁酯与丁醇,水等形成二元或三元恒沸液, 重蒸馏时沸点降低,影响产率。
