氧族元素知识结构图
氧族元素_环境保护知识总结
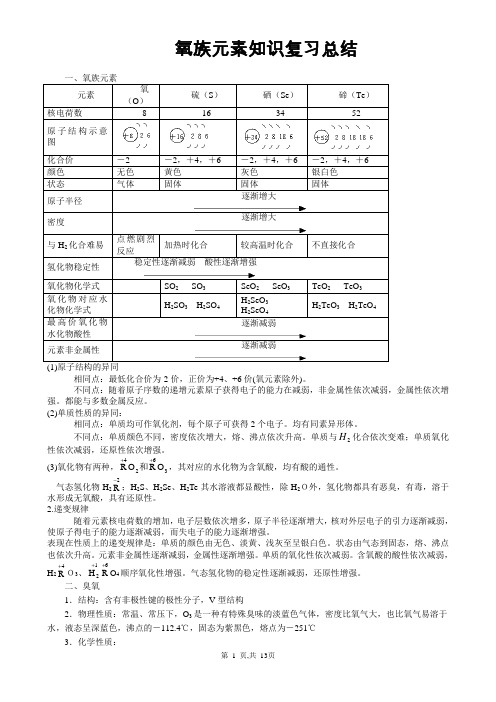
氧族元素知识复习总结相同点:最低化合价为-2价,正价为+4、+6价(氧元素除外)。
不同点:随着原子序数的递增元素原子获得电子的能力在减弱,非金属性依次减弱,金属性依次增强。
都能与多数金属反应。
(2)单质性质的异同:相同点:单质均可作氧化剂,每个原子可获得2个电子。
均有同素异形体。
不同点:单质颜色不同,密度依次增大,熔、沸点依次升高。
单质与2H 化合依次变难;单质氧化性依次减弱,还原性依次增强。
(3)氧化物有两种,3624O R O R ++和,其对应的水化物为含氧酸,均有酸的通性。
气态氢化物H 22R -;H 2S 、H 2Se 、H 2Te 其水溶液都显酸性,除H 2O外,氢化物都具有恶臭,有毒,溶于水形成无氧酸,具有还原性。
2.递变规律随着元素核电荷数的增加,电子层数依次增多,原子半径逐渐增大,核对外层电子的引力逐渐减弱,使原子得电子的能力逐渐减弱,而失电子的能力逐渐增强。
表现在性质上的递变规律是:单质的颜色由无色、淡黄、浅灰至呈银白色。
状态由气态到固态,熔、沸点也依次升高。
元素非金属性逐渐减弱,金属性逐渐增强。
单质的氧化性依次减弱。
含氧酸的酸性依次减弱,H 24R +O3、612R H ++O 4顺序氧化性增强。
气态氢化物的稳定性逐渐减弱,还原性增强。
二、臭氧1.结构:含有非极性键的极性分子,V 型结构2.物理性质:常温、常压下,O 3是一种有特殊臭味的淡蓝色气体,密度比氧气大,也比氧气易溶于水,液态呈深蓝色,沸点的-112.4℃,固态为紫黑色,熔点为-251℃3.化学性质:①不稳定性:常温下分解较慢,在受热、光照和MnO2等作用下迅速分解。
2O3 == 3O2②强氧化性:就氧化能力而言,它介于氧原子和氧分子之间。
能氧化在空气中不能氧化的金属。
臭氧分子与其它物质反应时,常产生氧气。
2Ag + 2O3 =Ag2O2 + 2O2 (常温下反应)O3 + 2KI + H2O = 2KOH + I2注:臭氧能使湿润的KI淀粉试纸变蓝,利用此性质可测定微量O3的含量,也可检验O3。
第六章第一节氧族元素精选教学PPT课件

假如人生不曾相遇,我还是那个我,偶尔做做梦,然后,开始日复一日的奔波,淹没在这喧嚣的城市里。 我不会了解,这个世界还有这样的一个你,只有你能让人回味,也只有你会让我心醉。 假如人生不曾相遇,我不会相信,有一种人可以百看不厌,有一种人一认识就觉得温馨。明知不能相逢,为何魂牵梦系?我又怎能深刻地体会到什么样叫远,什么叫近,远是距离,近在心底。 假如人生不曾相遇,不曾想过会牵挂一个远方的人。我有深切的愿望,愿你快乐每一天。淡淡的情怀很真,淡淡的问候很纯,淡淡的思念很深,淡淡的祝福最真。虽然一切只能给虚幻中的你。 假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。 假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤? 假如人生不曾相遇,我怎么能知道爱情存在的真正意义。必须有缘才能共舞,珍惜今天所爱方能同步。不能和你同途,也不能与你同步。 假如人生不曾相遇,我还是我,你依然是你,只是错过了人生最绚丽的奇遇。
D
)
3根据氧族元素性质推断,硒不可能具有的性质是( C ) A.在通常情况下是固体 B.SeO3对应的水化物是一种酸
C.H2Se比H2S稳定
D.有-2,+4,+6三种化合物
4.用事实说明氧的非金属性比硫强
A.硫在氧气中燃烧
B.硫与铁反应生成硫化亚铁,氧气与铁 反应生成四氧化三铁 C. 2H2S + O2 == S +2H2O
氧族元素

2Ag+2O3===Ag2O2+2O2
2KI+H2SO4+O3===I2+O2+H2O+K2SO4
最后这个反应可用于检验混合气体中是否含
有臭氧。 O3的定量分析(碘量法) KI + O3 (g) + H2O = I2 + 2KOH + O2(g)
臭氧与环境
O3在地面附近的大气层中含量极少,仅占0.001ppm。在 离地面20~40km(平流层)处有个臭氧层,臭氧浓度高达 0.2ppm。它是氧气吸收太阳的紫外线后形成的。 这两种过程最后达到动态平衡,结果形成了一个浓度相 对稳定的臭氧层。正是这臭氧层吸收了高空紫外线的强辐 射,使地球上的生物免遭伤害。但近年由于大气中污染物 (如氯氟烃CFCl3、CF2Cl2和氮氧化物等)不断增加使臭氧层 遭到破坏,从而造成对环境和生物的严重影响。
臭氧空洞
(1) 使动物和人眼睛失明; (2) 使人和动物免疫力减低; (3) 人的皮肤色斑增多,皮肤癌发病率增高; (4) 促进地球变暖。因为海洋中的浮游生物大量被紫外线 杀死后,大气中大量的二氧化碳就不能被海洋吸收了。
原臭 子氧 示分 意子 图被 氯 原 子 夺 去 氧
PbS+2O3===PbSO4+O2 (油画处理)
在酸性溶液中过氧化氢能使重铬 酸盐生成二过氧合铬的氧化物,即 Cr(O2)2O或CrO5,生成的CrO5显蓝 色,在乙醚中比较稳定,检验时在乙 醚层中显蓝色,可以相互检验。
O O
O Cr
O O
4H2O2+H2Cr2O7===2Cr(O2)2O+5H2O 2Cr(O2)2O+7H2O2+6H+===2Cr3++7O2↑+10H2O
第十六章-氧族元素PPT课件
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
§16-1、氧族元素的通性
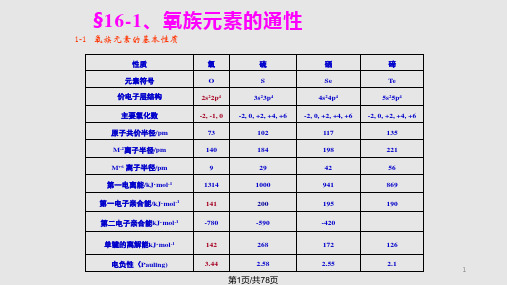
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
第十三章 氧族元素

(The elements of Oxygen groups)
§13-1 氧族元素的通性
氧族元素的性质
元素符号 原子序数
O
Oxygen 8
S
Sulfur 16
原子量
16.00 32.06
原子共价半径/pm
离子半径/pm
M-2 M+6
熔点/K
沸点/K
第一电离能/(kJ·mol-1)
1、H2O2的不稳定性和酸性
H2O2的分解速率随OH-浓度的增大而加快,某些金 属离子也可催化H2O2的分解(如Mn2+、Fe2+、Cu2+)。
H2O2具有弱酸性其K1=1.55×10-12
2、H2O2的氧化性
H2O2+2I-+2H+===I2↓+2H2O
PbS+4H2O2===PbSO4↓+4H2O
(c)高价氧化物的热分解或通氢还原。可以得到低 价氧化物,例如
P b O P b O P b O P b O 563-593K 2
663-693K
23
803-823K
34
(d)单质被硝酸氧化可得到某些元素的氧化物, 这种方法不像上述三种方法具有普遍性。例如
3Sn+ 4 HNO 3 = 3SnO 2 + 4 NO ? 2 H 2 O
1、 和大多数单质直接化合成氧化物
2 Mg + O2 = 2 MgO
S + O2 =SO2
2、 和大多数非金属氢化物反应
2 H2S + O2 =2 S + 2 H2O 2 H2S + 3O2 =2 SO2 + 2 H2O 4 NH3 + 3 O2 =2 N2 + 6 H2O 4 NH3 + 5 O2 = 4 NO + 6 H2O 3、 和低价氧化物反应生成高价氧化物
第十六章-氧族元素PPT课件

1.2V 3
(O2/OH )
0.4V 0
.
5
O2 + NH3 → Fe S H2S HI CH4
H2O + N2 或 NO Fe3O4, FeO, Fe2O3 SO2(g) S 或 SO2(g) I2 CO2、CO 或 C
配位性 人血红蛋白中的血红素Hb是卟啉衍生物与Fe(II)形成的
配合物,具有与O2络合的功能: HbFe(II) + O2 = HbFe(II) O2
H2S的代用品——硫代乙酰胺(TAA)
CH3CSNH2 + H2O = CH3COO- + NH4+ + H2S↑
.
28
硫化物
金属硫化物
M 2S2(H 2S) MS MS MS
颜色:(大多数为黑色,少数需要特殊记忆) SnS 棕, SnS2 黄,As2S3 黄,As2S5 黄, Sb2S3橙,Sb2S5橙,MnS 肉,ZnS 白,CdS 黄
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
.
20
16.3 硫及其化合物
16.3.1 单质硫
结构
S:sp3杂化,形成环状S8分子。
S8分子为分子晶体,不溶 于水,溶于CS2。
.
21
同素异形体
斜方硫
密度/gcm-3 2.06
颜色
黄色
稳定性
< 94.5℃
单斜硫 1.99 H [2 H S x ] H 2 S ( (- g 1 x) )
氧化性
SnSS2 2- Sn3 2-S
还原性 3 F2 e S 82 O F3O e46S 2 O
.
氧族元素一精品PPT教学课件
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
化学复习:氧族元素
2H2 + O2 → 2H2O H2 + S → H2S
△
点燃
二、氧族元素的相似性
⑶ 能与大多数金属直接化合 △ Fe + S → FeS (黑色) △ { 2Cu + S → Cu S (黑色) 2
性质
氧化性
还原性
漂白性
(1)具有酸性氧化物的通性(完成下列反应) SO2 + H2O → 2SO3 H SO2(少量) + 2 NaOH→Na2SO3 +H2O SO2(足量) + NaOH→NaHSO3 + H2O SO2 + Ca(OH)2→CaSO3 +H2O (2) 氧化性 2H2S + SO2 → 2H2O + 3S (3)还原性 催化剂 2SO2 + O2 △ 2SO3 SO2 + Br2 + 2H2O →H2SO4 + 2HBr 2Fe SO2 + 2 H2O + 2Fe3+ → 2++ 4H+ + SO42(4)漂白性:能使品红溶液褪色 但加热以后会恢复原来的颜色
反应:FeS+2HCl→FeCl2+H2S↑
装置:可以用启普发生器. 验满:用湿润的醋酸铅试纸,若使试纸变黑.
五、二氧化硫、三氧化硫 1、二氧化硫的物理性质:无色有刺激性气 味的气体,密度比空气大,有毒,易溶于水。 2、二氧化硫的化学性质:
酸性 从类属和化合价分析: 1.SO2为酸性氧化物为亚硫 酸的酸酐。具有酸性氧化 物的通性,在这点上与 CO2的性质及其相似。 2.处于中间价态,既具有还 原性又具有氧化性,以还原 性为主
第一课时 氧族元素
第一课时氧族元素1.氧族元素的原子结构及性质递变规律【小结】非金属性依次;金属性依次。
2.硫的氢化物、氧化物及其水化物的结构、性质3.金属硫化物的颜色和溶解性 4.硫单质与氢化物、氧化物的性质及化合价关系强还原性 氧化性、还原性 强氧化性特别注意:中间价态的两类硫既有氧化性,又有还原性,SO 2、H 2SO 3、Na 2SO 3以还 5. 原性为主。
硫的四种价态间的含硫物质之间的网络关系①H 2S 是具有臭蛋气味的剧毒气体,其水溶液——氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl 3溶液、HNO 3等氧化。
H 2S 能燃烧,燃烧依反应条件不同而不同。
②硫与Fe 、Cu 反应时,由于其非金属性比氯弱,所以生成低价态的物质FeS 、Cu 2S 。
③硫的氧化物有SO 2和SO 3,其中SO 2是一种有刺激气味的气体,易液化,易溶于水——其水溶液叫亚硫酸、二元弱酸。
SO 2是重要的大气污染物(其危害详见课本),防治方法有排烟除硫燃料脱硫。
6.臭氧的性质:(1)物理性质:在常温常压下,臭氧是一种有 的 色体,密度比氧气 , 溶于水;液态臭氧呈 色,固态臭氧呈 色。
(2)化学性质:①极强的氧化性:O 3 +KI + H 2O = ②不稳定性: ③漂白性:漂白原理是依靠 性,因此臭氧是一种很好的 剂和 剂; ④产生方式: (用化学方程式表示)7.过氧化氢的性质:过氧化氢中氧元素的化合价是 价,因此过氧化氢表现为即有 性又有 性,并以 性为主,过氧化氢的水溶液俗称 呈弱酸性。
a .化学性质:当遇到强还原剂时,体现氧化性,如:SO 2 + H 2O 2 = ; Fe 2+ + H 2O 2 + H + = 当遇到强氧化剂时,体现还原性,如:MnO 4- + H 2O 2 + H + =(3)不稳定性:H2O2= b.用途:[例1] 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
《氧族元素》ppt课件 人教版
氢化物形 成的条件
点燃或放电
S
Se
-2,+4,+6
H2S
H2Se
加热
高温
Te
H2Te
不直接化合
氢化物稳定性
稳定 ——————→极不稳定
氧化物
最高价氧化 物对应水化 物 (H2RO4)
——
SO2,SO3
SeO2,SeO3
TeO2,TeO3
具有酸性 酸性逐渐减弱
非金属性依次减弱 ;金属性依次增强。
思维方式和研究方法
3.现在含硒元素的保健品已开始进 入市场。已知硒元素与氧同主族、
与钾同周期,则下列关于硒的C叙D述
正确的是
▪ A.原子序数为24
▪ B.非金属性比溴强
▪ C.最高价氧化物的化学式为SeO3 ▪ D.气态氢化物的稳定性较H2S弱
O
S
Se
Te
Po
同周期氧族元素和卤素的性质比较
(以S,Cl为例推演)
▪ B.Te的化合物有+4,+6, -2价
▪ C.Te的最高价氧化物对应的水化物是强酸
▪ D. 单质碲为银白色,且能导电
2.下列有关氧族元素的叙述不正 B D 确的是-------
▪ A.随着原子序数的递增,单质熔沸点升高 ▪ B.都能形成+4价和+6价化合物 ▪ C.能跟大多数金属化合 ▪ D.通常都能跟氢气直接化合生成氢化物.
▪
7.从自然生态的角度来看,生态平衡 的维护 就是要 维护其 生物物 种的多 样性, 所以维 护社会 和谐的 基础也 就是文 化的多 样性。
▪
8.作为最深层次的认同,文化的认同 在维护 民族团 结和和 睦之中 具有最 根本的 作用, 因此就 要建设 好各民 族共同 的精神 家园, 培养中 华民族 的共同 体意识 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧族元素知识结构图
本章氧族元素
一.氧族元素概述
(一)氧族元素的基本性质
(二)第二周期————氧的特殊性
1.氧化态
2.电子亲合能
3.单键离解能
A.自身成键
B.与电负性较大,价电子数目较多的元素的原子成键
C.与电负性较小,价电子数目较少的元素原子成键
4.双键离解能
A.第二周期元素特征,
B.第三周期元素特征
5.键型(离子型与共价型)
6.配位数
(三)臭氧和氧
1.氧
A.氧分子形态
B.氧气的化学性质
a.氧化性
b.配位性质
2.臭氧(有鱼腥味的淡蓝色气体)
A.臭氧的分子结构(O3是单质分子中唯一电偶极矩 ≠0的物质,)与NO2-互为“等电子体”。
B.臭氧的制备与存在
C.臭氧化学性质:
(1)强氧化性(分子结构与热力学)(应用:《1》油画处理,《2》含氰废水处理《3》臭氧的定量分析(碘量法))
(四)水与过氧化氢
A.水的结构(杂化类型,几何构型,氢键)
B.过氧化氢的分子结构(几何构型,弱酸性)
C.过氧化氢的化学性质(键能,与电极电势)
(1)氧化性(酸介质突出)——无污染的氧化剂
(2)还原性(碱介质突出)(工业除氯)
(3)过氧化氢的定性检测(重铬酸钾,乙醚或戊醇中,蓝色)
(4)过氧化氢歧化(分解)(过氧化氢的稳定性与分解速率)
(5)过氧化氢的保存(六点)
D.过氧化氢的用途
E.过氧化氢的制备(化学法,电解法,蒽醌法)
(1)用稀硫酸与过氧化钡,过氧化钠反应
(2)工业制备法
(五)硫及其化合物
A.硫的同素异形体(结构)
B.硫的化学性质
(1)碱介质歧化,酸介质逆歧化
(2)氧化性
C.硫属元素氢化物
(1)分子结构
(2)理化性质(硫化氢的饱和浓度,及其有毒性)
(3)还原性(尤其在碱性介质中)
(六)硫化物
S溶解性(四点);规律(硫化物的溶解度随着 A.溶解性(MHS的溶解性;M
2
溶液的酸碱度的变化而变化)
(七)多硫化物
A.形成
B.多硫化物的性质(遇酸不稳定,氧化性,还原性)
C.硫化钠的制备
(八)硫的氧化物
A.分类
B.酸碱性递变规律(三点)
C.二氧化物SO2、SeO2、TeO2
(1)二氧化硫的结构(治理酸雨)
(2)二氧化硫的化学性质(液态二氧化硫的电离平衡与作溶剂的性质)
(3)SeO2、TeO2中强氧化性
D.三氧化物SO3、SeO3、TeO3
(1)结构(次周期性)
(2)化学性质
《1》三氧化硫最高氧化态,强氧化性
《2》酸酐
《3》发烟硫酸
(九)硫的含氧酸及其盐(四大类含氧酸)
A.分子结构特点
(1)含氧酸分子中硫元素的杂化类型
(2)硫酸系含氧的形成于分子结构的特点
(3)过硫酸系含氧酸的形成和分子结构特点
B.△Gθ/F-Z图
(1)热力学稳定
(2)强氧化性(用于检定二价锰离子)
(3)强还原性(S2O32―、S2O42―(连二亚硫酸根),尤其是在碱介质中
*S2O32―的性质:酸性条件下分解,还原性,配位剂
C.各种含氧酸及其盐的特征
(1)亚硫酸及其盐
《1》氧化还原性
a.还原性为主(尤其在碱性介质中)
b.遇强还原剂才显氧化性
c.亚硫酸盐分解
d.亚硫酸盐被氧化
e.亚硫酸盐被还原(获得连二硫酸钠(保险粉))
(2)硫酸及其盐
《1》浓硫酸氧化性、脱水性(干燥剂)
标态下,硫酸氧化性不强(氧化性的次周期性,硒酸,H6TeO6与硫酸的区别,过渡金属硫酸盐加热易分解)
《2》正盐,酸式盐和复盐
《3》热稳定性
(3)焦硫酸及其盐:(制备,四性(酸性,氧化性,吸水性,脱水性))
(4)硫代硫酸及其盐(大苏打,海波)(大苏打的物性,定影液成分)
《1》制备(纯硫代硫酸与硫代硫酸盐)
《2》化性(遇酸分解,强还原性(碘量法的基础,印染工业除氯气)
《3》配合剂
(5)过硫酸及其盐(制备与常见盐)
(十)硒、碲的化合物
1. SeO2,TeO2为中等强度氧化剂
2. H2SeO3、H2SeO4 无色固体
3.碲酸H6TeO6或Te(OH)6八面体,白色固体,弱酸,氧化性比H2SO4强。
(十一)硫属元素卤化物和卤氧化物
A.六氟化硫(实际上不水解,原因:动力学及硫的配位数)
B.四氟化硫(水解的两个原因)
C.卤化亚硫酸酰SOX
2
(1)S-O键能:SOF2>SOCl2>SOBr2(影响共价键的原因3点)
(2)SOF2 , SOCl2, SOBr2系列化合物中,S-O键长
(3)SOF2 , SOCl2
《1》水解(两种物质的对比,SOCl2的作用)
《2》电离
《3》氧化剂和氯化剂
(4)SO2Cl2的水解
(5)卤磺酸(氟磺酸)。
