有机方程式书写(含答案解析)
高中化学全部化学方程式汇总(有机和无机)

高中化学全部化学方程式汇总(有机和无机)【注意】以下是有机和无机化学方程式的汇总,请按需使用或参考。
为了排版整洁,请在使用时进行适当的调整和修改。
一、有机化学方程式1. 碳氢化合物反应方程式1.1 烷烃燃烧反应:CnH2n+2 + (n + (n/2 + 1)/2)O2 → nCO2 + (n + (n/2 - 1)/2)H2O1.2 烯烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O1.3 异构烷烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O2. 醇类反应方程式2.1 醇的燃烧反应:CnH2n+1OH + (n + (n+1)/2)O2 → nCO2 + (n+1)H2O2.2 醇的脱水反应:CnH2n+1OH → CnH2n + H2O3. 酚类反应方程式3.1 酚的燃烧反应:C6H6O + 15/2O2 → 6CO2 + 3H2O 3.2 酚的酸碱中和反应:C6H6O + NaOH → C6H5ONa + H2O 4. 酯类反应方程式4.1 酯的酸水解反应:RCOOR' + H2O → RCOOH + R'OH 4.2 酯的碱水解反应:RCOOR' + NaOH → RCOONa + R'OH 5. 醛和酮类反应方程式5.1 氧化性还原反应:RCHO + [O] → RCOOH5.2 醛的酸碱反应:RCHO + NaOH → RCOONa + H2O 6. 醚类反应方程式6.1 醚的加热裂解反应:ROR' → R'H + R'OH6.2 醚的酸水解反应:ROR' + H2O → ROH + R'OH7. 脂肪酸类反应方程式7.1 脂肪酸的酸碱反应:RCOOH + NaOH → RCOONa + H2O7.2 脂肪酸的酯化反应:RCOOH + R'OH → RCOOR' + H2O二、无机化学方程式1. 钠和氧的反应方程式4Na + O2 → 2Na2O2. 钙和水的反应方程式Ca + 2H2O → Ca(OH)2 + H23. 硝酸和铜的反应方程式Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O 4. 二氧化碳和水的反应方程式CO2 + H2O → H2CO35. 硝酸和氢氧化钠的反应方程式2NaOH + HNO3 → NaNO3 + H2O6. 硫化氢和氯的反应方程式H2S + Cl2 → 2HCl + S7. 氧化锌和硫酸的反应方程式ZnO + H2SO4 → ZnSO4 + H2O8. 氯气和钾溶液的反应方程式Cl2 + 2KOH → KCl + KClO + H2O9. 溴和钾的反应方程式2K + Br2 → 2KBr10. 硫和氧的反应方程式S + O2 → SO2以上是高中化学的部分有机和无机方程式的汇总,希望能对你的学习有所帮助。
(完整版)有机反应方程式归纳(答案)

有机反应方程式书写(请注明反应条件)一、烷烃、烯烃、炔烃1.甲烷的实验室制法C2H5OH CH2=CH2↑+H2O2.甲烷燃烧CH4+2O2CO2+2H2O3.甲烷与氯气CH4+Cl2CH3Cl+HCl CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HCl4.甲烷隔绝空气时高温分解CH4C+2H25.丁烷的裂解(两个方程式)C4H10CH4+C3H6C4H10C2H4+C2H66.乙烯的实验室制法CH3CH2OH CH2=CH2↑+H2O7.乙烯燃烧C2H4+3O22CO2+2H2O8.乙烯使溴水褪色CH2=CH2+ Br2→CH2 Br─CH2 Br9.乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH10.异戊二烯与溴1:1加成(3种产物,分别写三个方程式)11.异戊二烯与足量溴水反应12.乙烯的加聚13.乙烯与丙烯1:1加聚14.异戊二烯聚合15.苯乙烯与异戊二烯1:1加聚16.乙炔的实验室制法CaC2+2H2O CH CH↑+Ca(OH)217.乙炔与足量氢气反应CH CH+2H 2CH3 -CH318.乙炔的聚合19.由乙炔制备聚氯乙烯CH CH+HCl CH2=CHCl二、苯及其同系物20.苯燃烧2C6H6+15O212CO2+6H2O21.苯与液溴反应22.甲苯的硝化反应23.苯与氢气反应24.甲苯与氯气的取代反应(2个方程式)(一个在铁的催化下,一个在光照下)25.甲苯与浓硝酸、浓硫酸反应三、卤代烃的性质26.溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O27.溴乙烷的水解反应CH3-CH2-Br+ NaOH CH3-CH2-OH+NaBr28.氯苯与氢氧化钠水溶液反应29.2,3-二氯丁烷的消去反应四、醇的性质30.乙醇燃烧C2H5OH+3O22CO2+3H2O31.乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑32.乙醇的催化氧化2C2H5OH+O22CH3CHO+2H2O33.乙醇与浓硫酸反应(两个方程式)CH3CH2OH CH2=CH2↑+H2O2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O34.乙醇与乙酸反应C2H5OH+CH3COOH CH3COOC2H5+H2O35.乙二醇与钠反应36.乙二醇的催化氧化37.甘油与硝酸反应五、酚的性质38.苯酚与钠反应39.苯酚与氢氧化钠反应40.苯酚与浓溴水反应41.苯酚钠与二氧化碳反应42.苯酚与甲醛缩聚六、醛的性质43.乙醛与氢气反应CH3CHO+H2C2H5OH44.苯甲醛与足量氢气反应45.甲醛与新制氢氧化铜反应HCHO+4Cu(OH)2CO2+2Cu2O↓+3H2O46.乙醛与新制氢氧化铜反应CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O47.甲醛与银氨溶液反应HCHO+4Ag(NH3)2OH(NH4)2CO3+2Ag↓+6NH3+2H2O48.乙二醛与银氨溶液反应七、羧酸的性质49.乙酸与钠反应2CH3COOH+2Na2CH3COONa+H2↑50.乙二酸与氢氧化钠反应51.甲酸与少量碳酸钠反应HCOOH+Na2CO3→HCOONa+ NaHCO352.甲酸与过量碳酸钠反应2HCOOH+Na2CO3→2HCOONa+CO2↑+H2O53.乙二酸与乙二醇两分子间脱去1份水54.乙二酸与乙二醇两分子间脱去2份水55.乙二酸与乙二醇缩聚56.对苯二甲酸与乙二醇缩聚57.乳酸(2-羟基丙酸)分子内脱去1份水,生成物能使溴水褪色58.2份乳酸分子间脱去1份水59.2份乳酸分子间脱去2份水60.乳酸的缩聚八、酯的性质61.乙酸乙酯酸性水解CH3COOC2H5+H2O CH3COOH+C2H5OH62.乙酸乙酯碱性水解CH3COOC2H5 +NaOH CH3COONa+C2H5OH63.油酸甘油酯酸性条件下水解64.硬脂酸甘油酯碱性条件下水解65.乙酸苯酯碱性条件下水解九、糖、蛋白质的性质66.葡萄糖与新制氢氧化铜反应67.葡萄糖的银镜反应68.由淀粉制乙醇(发酵法)C6H12O6C2H5OH+2CO2↑69.a-氨基乙酸(甘氨酸)与盐酸反应70.a-氨基乙酸(甘氨酸)与氢氧化钠反应71.a-氨基乙酸2分子间脱去1分子水72.a-氨基乙酸2分子间脱去2分子水73.a-氨基乙酸缩聚。
高中经典有机化学反应方程式

章末回顾排查专练(十二)排查一、重要有机反应方程式再书写1.2.2C 2H 5OH +2Na →2C 2H 5ONa +H 2↑; 3.CH 3CH 2OH ―――――――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O ; 4.C 2H 5OH +HBr ――→△ C 2H 5Br +H 2O ;5.2C 2H 5OH +O 2―――――――――→Cu 或Ag △2CH 3CHO +2H 2O ;9.2CH 3CHO +O 2―――――――――→催化剂△2CH 3COOH ; 10.CH 3CHO +H 2――――――――――→催化剂△CH 3CH 2OH ; 11.CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O ;12.CH 3CHO +2Cu(OH)2――→△ CH 3COOH +Cu 2O ↓+2H 2O ;13.CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ;14.CH 3COOC 2H 5+H 2O 稀H 2SO 4△CH 3COOH +C 2H 5OH ;15.乙二醇和乙二酸生成聚酯16.排查二、常考易错再排查 1.按碳原子组成的分子骨架分,有机物可分为链状化合物和环状化合物,环状化合物又包括脂环化合物和芳香族化合物。
按官能团分,有机物可分为烃(烷烃、烯烃、炔烃、芳香烃)和烃的衍生物(卤代烃、醇、酚、醛、酸、酯等)。
( )2.具有相同分子式,不同结构的化合物互为同分异构体。
包括碳链异构(如CH 3CH 2CH 2CH 3与)、位置异构(如CH 3CH===CHCH 3与CH 3CH 2CH===CH 2)、官能团异构(如CH 3CH 2OH 与CH 3OCH 3)、顺反异构(顺2-丁烯与反2-丁烯)、手性异构等。
( )3.发生加成反应或加聚反应的有机物分子必须含有不饱和键。
高考化学陌生方程式的书写练习题(含答案)

高考化学陌生方程式的书写练习题(含答案)1.利用石灰乳和硝酸尾气中的NO、NO2反应可以净化尾气同时获得Ca(NO2)2,但在生产中溶液需要保持弱碱性,因为在酸性溶液中Ca(NO2)2会分解,其中产生的一个产物是NO。
该反应的离子方程式为:Ca(OH)2 + 2NO → Ca(NO2)2 + H2O2.生产硫化钠通常采用无水芒硝(Na2SO4)-碳粉还原法,煅烧所得气体中 CO 和 CO2 的量相等。
该反应的化学方程式为:Na2SO4 + 2C → Na2S + 2CO2 + SO23.向含碘废液中加入稍过量的Na2SO3溶液可以将废液中的I2还原为I-。
该反应的离子方程式为:2Na2SO3 + I2 → 2NaI + Na2S2O64.向含Cr2O7的酸性废水中加入FeSO4溶液可以使Cr2O7全部转化为Cr3+。
该反应的离子方程式为:FeSO4 + Cr2O7^2- + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 +H2O5.当温度高于200℃时,硝酸铝会完全分解成氧化铝和两种气体,其体积比为4:1.该反应的化学方程式为:4Al(NO3)3 → 4A l2O3 + 12NO2 + O26.(1) AgNO3在光照下会分解生成Ag和红棕色气体,其光照分解反应的化学方程式为:2AgNO3 + hv → 2Ag + 2NO2 + O22) 以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。
该反应的化学方程式为:2H2O → 2H2 + O23) 当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中的SO3将NO2转化为NO。
该反应的离子方程式为:2NO2 + CaSO3 + H2O → 2NO + CaSO4·2H2O4) CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜。
该反应的化学方程式为:2CuSO4 + P4 → 2Cu + P4O10 + 2SO25) 工业制法中,将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。
2022年高考化学有机转化关系及反应方程式书写
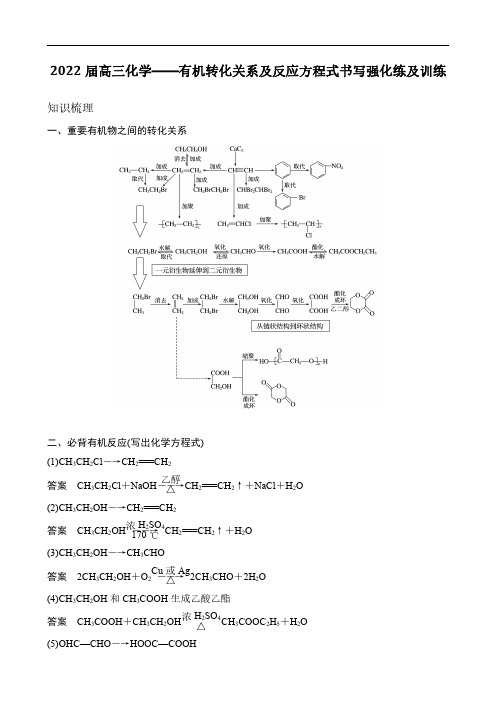
2022届高三化学——有机转化关系及反应方程式书写强化练及训练知识梳理一、重要有机物之间的转化关系二、必背有机反应(写出化学方程式)(1)CH 3CH 2Cl ―→CH 2===CH 2答案CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O(2)CH 3CH 2OH ―→CH 2===CH 2答案CH 3CH 2OH ――→浓H 2SO 4170℃CH 2===CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO 答案2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O(4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC—CHO ―→HOOC—COOH答案OHC—CHO +O 2――→催化剂△HOOC—COOH(6)乙二醇和乙二酸生成聚酯答案n HOCH 2—CH 2OH +n HOOC—COOH――→一定条件+(2n -1)H 2O (7)乙醛和银氨溶液的反应答案CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案(10)答案(11)和饱和溴水的反应答案(12)和溴蒸气(光照)的反应答案(13)和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应三、常考有机物的检验1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
2020年高考化学真题透析2.4 陌生化学方程式的书写(高效演练)(解析版)

高效演练1、为测定水中溶氧量,向一定量水样中加入过量MnSO 4和适量碱溶液,生成MnO(OH)2沉淀,写出O 2将Mn 2+氧化成MnO(OH)2的离子方程式 。
【答案】O 2+2Mn 2++4OH -===MnO(OH)2↓【解析】碱性条件下,O 2将Mn 2+氧化成MnO(OH)2沉淀,离子方程式为O 2+2Mn 2++4OH -===MnO(OH)2↓。
2、在饱和氯水中加块状石灰石,能制得较浓HClO 溶液,同时放出一种气体。
其反应的离子方程式是 。
【答案】2Cl 2 + H 2O + CaCO 3 === Ca 2+ +2Cl -+ 2HClO + CO 2↑【解析】氯气与水反应生成盐酸和次氯酸,盐酸再与石灰石反应生成CO 2,离子方程式为:2Cl 2 + H 2O + CaCO 3 === Ca 2+ +2Cl -+ 2HClO + CO 2↑。
3、煤燃烧排放的烟气含有SO 2和NO ,形成酸雨、污染大气,采用NaClO 2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
反应温度为323 K ,NaClO 2溶液浓度为5×10−3mol·L −1。
反应一段时间后溶液中离子浓度的分析结果如下表。
离子 SO 42− SO 32− NO 3− NO 2− Cl -c /(mol·L −1)8.35×10−46.87×10−61.5×10−41.2×10−53.4×10−3写出NaClO 2溶液脱硝过程中主要..反应的离子方程 。
【答案】4NO+3ClO 2-+2OH-323K4NO 3-+2H 2O+3Cl -【解析】从表中可判断NaClO 2溶液脱硝过程中主要..反应是生成NO 3−,NaClO 2溶液显碱性,离子方程式为:4NO+3ClO 2-+2OH- 323K4NO 3-+2H 2O+3Cl -4、已知:写出该步反应的化学方程式: 。
高三化学选修5选考题剖析:素养1_结构简式、同分异构体及有机反应方程式的书写_word版

【考情导引】多年来,同分异构现象和同分异构体一直是高考化学命题的热点。
它综合性强,考查范围广,不仅能考查考生对同分异构体概念的理解、有机物结构等知识的掌握程度,还能考查考生的思维能力及品质。
特别是思维的严密性、有序性。
同分异构体现象和同分异构体在有机化学知识体系中所占的特殊地位,使得它一直是高考化学命题的热点。
而且命题形式不断变化,先后历经了三个阶段:简单的同分异构体的书写与数目计算阶段给予部分同分异构体要求补充、书写完全阶段;对较复杂有机物所满足特定要求的同分异构体的书写与数目计算。
同分异构体的考查突出体现了“能力立意”的出题思路,仍是今后考查的重要形式。
【精选例题】例1. (1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不.可能为________。
A.醇B.醛 C.羧酸 D.酚(3)与具有相同官能团的同分异构体的结构简式为_______________。
(4)苯氧乙酸()有多种酯类的同分异构体。
其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_____________________ (写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
【参考答案】(1)4(2)D(3)CH2===CHCH2COOH、CH3CH===CHCOOH(5)5【解析】(1)分子式为C4H10O并能与Na反应放出H2,符合饱和一元醇的通式和性质特点,应为一元醇C4H9OH,因—C4H9有4种,则C4H9OH也有4种。
(2)C7H10O2若为酚类物质,则应含有苯环,7个C最多需要8个H,故不可能为酚。
(3)该化合物中有和—COOH两种官能团,由于官能团不变,只将官能团的位置移动即可得其同分异构体:CH2===CHCH2COOH、CH3CH===CHCOOH。
(4)根据题意,符合条件的同分异构体满足:①属于酯类即含有酯基,②含酚羟基,③苯环上有两种一硝基取代物。
化学有机物方程式总结

化学有机物方程式总结有机物是指碳元素为主要组成元素的物质,其构成的化学键主要是碳碳键和碳氢键。
有机物方程式是描述有机物反应和转化的化学方程式,它们对研究有机化学的基本原理和应用具有重要意义。
下面将对一些常见的有机物方程式进行总结。
1.烷烃的燃烧反应:烷烃是由碳氢键构成的最简单的有机物,其分子式为CnH2n+2、烷烃的燃烧反应是指烷烃与氧气反应生成二氧化碳和水。
反应方程式通常表示为:烷烃+氧气→二氧化碳+水。
2.烯烃的加成反应:烯烃是由碳碳双键构成的有机物,其分子式为CnH2n。
烯烃具有较高的反应活性,可以与其他化合物发生加成反应。
例如,乙烯(C2H4)与溴(Br2)反应生成1,2-二溴乙烷,反应方程式为:乙烯+溴→1,2-二溴乙烷。
3.炔烃的加成反应:炔烃是由碳碳三键构成的有机物,其分子式为CnH2n-2、炔烃的加成反应是指炔烃与其他化合物发生加成反应。
例如,乙炔(C2H2)与氢气(H2)反应生成乙烯,反应方程式为:乙炔+氢气→乙烯。
4.醇的酸碱中和反应:醇是一类带有羟基(-OH)官能团的有机物,其分子式为ROH。
醇可以与酸反应生成酯,也可以与碱反应生成醇盐。
例如,乙醇(C2H5OH)与硫酸反应生成乙酯(C2H5OC2H5),反应方程式为:乙醇+硫酸→乙酯+水。
5.醛的氧化反应:醛是由羰基(C=O)官能团连接一个氢原子的有机物,其分子式为RCHO。
醛可以发生氧化反应,生成相应的羧酸。
例如,乙醛(CH3CHO)经过氧化反应生成乙酸(CH3COOH),反应方程式为:乙醛+氧气→乙酸。
6.酮的加氢还原反应:酮是由羰基连接两个碳基团的有机物,其分子式为RCOR'。
酮可以通过加氢还原反应转化为相应的醇。
例如,丙酮(CH3COCH3)经过加氢还原反应生成异丙醇(CH3CHOHCH3),反应方程式为:丙酮+氢气→异丙醇。
以上只是对一些常见有机物方程式进行了简要总结,实际上有机化学领域有着丰富且复杂的方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学二轮复习——有机方程式书写【训练一】写出下列反应的化学方程式(要标注反应条件和配平!):
1、由甲苯制2-溴甲苯:
2、由甲苯制一溴苯基甲烷():
3、由甲苯制TNT(2,4,6-三硝基甲苯):
4、由苯甲醛制苯甲醇:
5、与Br2按1:1发生加成::
6、氯乙烷与NaOH水溶液反应:
7、一氯乙酸与足量NaOH水溶液混合加热反应:
8、与NaOH醇溶液反应:
9、的催化氧化反应:
10、发生消去反应:
11、乙二醇与乙二酸酯化成环反应:
12、乙二醇与乙二酸酯化成高分子化合物:
13、苯酚溶液滴入浓溴水:
14、与溴水反应:
15、乙醛发生银镜反应:
16、与新制氢氧化铜反应:
17、二乙酸乙二酯发生完全水解:
18、一氯乙酸乙酯与足量的NaOH溶液加热反应:
19、2-甲基-1,3-丁二烯发生加聚反应:
20、丙烯酸甲酯发生加聚反应:
【训练二】读懂信息,正确迁移:根据题给信息进行信息迁移是有机综合题的热点。
题给信息理解错了,就无法正确运用信息进行迁移。
平时多做信息题可以提高信息的理解和迁移能力!
1、已知:则苯甲醛与丙醛发生上述反应的方程式为:
__________________________________________________.
2、已知:
则两分子乙醛在上述条件下反应的化学方程式:
_。
3、已知:
请写出实现由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH的方程式:
______________________________________________________________
___________________________________________________________________________________ 4、已知:已知环氧氯丙烷可与乙二醇发生如下聚合反应:
则:环氧氯丙烷与发生类似反应生成高聚物,该高聚物的结构式
是:
5、已知:则:
+
6、已知:则:
+
7、已知:则
8、已知:①②
则:⑴
⑵+→
9、已知:碱存在下,卤代烃与醇反应生成醚(R—O—R‘):
R—X + R‘OH R—O—R ’ +HX 则:
B的结构简式为:
10、已知:通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双
键的结构:
下面是9个化合物的转变关系:
(1)化合物①的名称是它跟氯气发生反应的条件A是
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:
______________ ,名称是
(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。
此反应的化学方程式是
11、已知:此反应称为酯交换反应,常用于
有机合成中。
则聚乙酸乙烯酯()与甲醇进行酯交换反应的化学方程式:
_________________。
12、已知溴乙烷跟氰化钠反应再水解可以得到丙酸:CH3CH2Br CH3CH2CH3CH2COOH,
则CH3CHBrCH3发生上述反应得到的是。
13、已知:CH3COONa+ NaOH Na2CO3+ CH4 ↑则:①+ NaOH+
②+ NaOH+
③用该方法生产乙烯的反应方程式为:
14、已知:则:。
