药学《无机化学》山东大学网络教育考试模拟题及答案
药学《药剂》山东大学网络教育考试模拟题及答案.doc

药剂学一、名词解释1 .倍散是在小剂量的毒剧药中添加一定量的填充剂制成的稀释散,以利于下一步的配制。
2.乳析指乳剂放置后出现分散相粒子上浮或下沉的现象。
3.生物利用度是衡量血管外给药用药剂量中进入体循环的相对数量与在大循环中出现的相对速率。
4.等张溶液是指与红细胞张力相等的溶液.也就是与细胞接触时,使细胞功能和结构保持正常的溶液。
二、写出下列物质在药剂学中的主要作用1.苯甲酸钠:又称:安息香酸钠。
苯甲酸钠是酸性防腐剂,在碱性介质中无杀菌、抑菌作用;其防腐最佳PH是2.5-4.Oo2.焦亚硫酸钠:又称二硫五氧酸钠。
为水溶性抗氧剂。
3.糊精:是淀粉水解中间产物的总称,习惯上亦称其为高糊(高黏度糊精),即具有较强的黏结性,一般很少单独大量使用糊精作为填充剂,常与糖粉、淀粉配合使用。
4.HPMC为羟丙基甲基纤维素简称。
本品选用高度纯净的棉纤维素作为原料,在碱性条件下经专门醍化而制得,是常用的增稠剂、分散剂、乳化剂和成膜剂等材料。
主药 压片1 .物理灭菌法包括干热灭菌法、湿热灭菌法、紫外线灭菌法、过滤除菌法、辐 射灭菌法、微波加热灭法。
2植物性药材的浸出过程一般包括浸润渗透、溶解、扩散和置换四个相互联系的阶段。
3.防止药物氧化的常用措施有煮沸除氧、加抗氧剂、加金属离子螯合剂、通 惰性气体、调节PH 值、避光。
四、简答题1. 简述低温粉碎的特点?在常温下粉碎困难的物料如软化点、熔点低的及热可塑性物料,例如树脂、树胶、 干浸膏等,可以得到较好粉碎;含水、含油较少的物料也能用该法粉碎,可获得 较细的粉末,并且可以保存物料中的香气及挥发性有效成分。
2. 写出湿法制粒压片的工艺流程?辅F 粘合剂粉碎—I —►混合 —L 制软材料—> 制粒3. 热原的污染途径及除去热原的方法有哪些?途径:从注射用水中带入;从原辅料中带入;从容器、用具、管道和设备等带入; 制备过程中的污染;从输液器具带入。
除去方法:高温法;酸碱法;吸附法;超滤法;离子交换法;凝胶滤过法;反渗 透法。
山东大学网络教育学院-药剂试题及答案

药剂学模拟题 2一、名词解释1.制剂防病治病用的药物在应用以前需要制成一定的形式,即剂型。
某一药物按照一定的质量标准,制成某一剂型,所得的制品称为制剂。
2.增溶剂用表面活性剂增大药物在水中的溶解度并形成澄清溶液的过程称为增溶。
用于增溶的表面活性剂称为增溶剂。
3.热原热原是微生物的代谢产物,是一种内毒素,它能引起一些动物与人的体温异常升高。
是由磷脂、脂多糖、蛋白质组成的复合物。
4.栓剂置换价置换价是指药物的重量与同体积基质重量之比。
DV=W/(G-(M-W))二、写出下列物质在药剂学中的主要作用1.卡波普表面活性剂2.微粉硅胶片剂润滑剂3.微晶纤维素片剂的填充剂4.HPMC 缓控释制剂的骨架三、填空题1. 物理灭菌法包括—(干热灭菌法)、(湿热灭菌法)、(紫外线灭菌)、(过滤灭菌)、(其他物理灭菌法)。
2. 植物性药材的浸出过程一般包括(浸润)(溶解)(扩散)(置换)四个相互联系的阶段。
3. 防止药物氧化的常用措施有(煮沸除氧)(通入惰性气体)(加入抗氧剂)(加入金属离子螯合剂)。
4. 气雾剂 由耐压容器 阀门系统 抛射剂 药物和附加剂四部分组成。
四、简答题1. 在药物制剂设计研究时,防止氧化可采取哪些措施?答:防止药物氧化的常用措施有煮沸除氧、加抗氧剂、加金属离子螯合剂、通惰性气体、调节pH 、避光等。
2. 写出湿法制粒压片的工艺流程?混合 润湿剂或粘合剂答 药物、辅料粉碎过筛----物料---------------制粒 干燥软材----湿颗粒----干颗粒----整粒----压片3. 写出Stokes 定律公式,根据Stokes 定律分析,增加混悬液稳定性可采取哪些措施?答 Stokes 定律 ηρρ9)(2212g r V -= 由Stokes 定律可看出,增加混悬剂稳定性的措施有:减少微粒粒径,增加介质粘度,调节介质密度以降低密度差。
五、计算题1.计算下列处方是否等渗?应如何处理?处方:氯霉素 5.0g硼砂 3.0 g硼酸 15.0 g蒸馏水加至 1000ml注:1%氯化钠冰点下降度为0.58℃1%硼砂冰点下降度为0.25℃1%硼酸冰点下降度为0.28℃1%氯霉素冰点下降度为0.06℃解: a=0.06×0.5+0.25×0.3+0.25×1.5=0.48℃加入氯化钠的量=(0.52-0.48)/0.58=0.07克1000毫升中加入0.7克.答1000毫升中加入0.7克氯化钠可调节等渗.2.已知利多卡因的消除速度常数Ke为0.3465h-1, 试求该药物的生物半衰期是多少?解t1/2=0.693/Ke= 0.693/0.3465=2h答该药物的半衰期2小时。
山东大学网络教育学院-药物化学2试题和答案
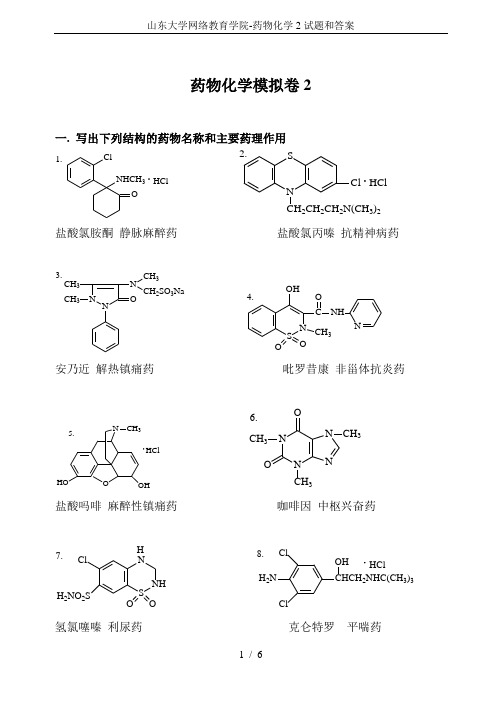
药物化学模拟卷2一. 写出下列结构的药物名称和主要药理作用ONHCH 3ClHCl1.NS 2CH 2CH 2N(CH 3)2Cl HCl2.盐酸氯胺酮 静脉麻醉药 盐酸氯丙嗪 抗精神病药N NO N CH 3CH 2SO 3NaCH 3CH 33.SN OOOHC O NHNCH34.安乃近 解热镇痛药吡罗昔康 非甾体抗炎药HClN N NN O OCH 3CH 3CH 36.盐酸吗啡 麻醉性镇痛药 咖啡因 中枢兴奋药S NH N ClH 2NO 2SOOH 7.ClH 2NClCHCH 2NHC(CH 3)3OHHCl8.氢氯噻嗪 利尿药 克仑特罗 平喘药HSCH 2CH CH 3C O NCOOH9.CH 3卡托普利 抗高血压药 青蒿素 抗疟药二. 写出下列药物的化学结构和主要药理作用 1.盐酸丁卡因 2.苯巴比妥NC 4H 9HCOOCH 2CH 2N(CH 3)2HClNH NHOOO CH 3CH 2局麻药 镇静催眠药或抗癫痫药3.地西泮4.乙酰水杨酸NN CH 3OClCOOHOCOCH 3镇静催眠药或抗癫痫药 解热镇痛药5.布洛芬6.盐酸哌替啶COOHNCH 3COOC 2H 5HCl非甾体抗炎药 镇痛药7.螺内酯 8.硫酸阿托品OO SCOCH 3OCH 2OH2H 2SO 4利尿药 解痉药三.回答下列问题1、如何改善丙戊酸钠的吸湿性?制备片剂时,环境湿度小于41%;加入少量有机酸如硬脂酸,枸橼酸等,生成丙戊酸-丙戊酸钠复合物。
2、比较咖啡因、可可豆碱和茶碱的中枢作用的强弱,并说明原因。
咖啡因> 茶碱>可可豆碱,取代基的多少与位置有关3、肾上腺素、去甲肾上腺素、异丙肾上腺素和沙丁胺醇各作用于什么受体?肾上腺素:αβ受体;去甲肾上腺素:α受体;异丙肾上腺素:β受体; 沙丁胺醇:β2>>>β1受体4、说明利多卡因较普鲁卡因化学稳定性好的原因。
利多卡因以其结构中的酰胺键区别于普鲁卡因的酯键。
药学《药物化学》山东大学网络教育考试模拟题及答案

药物化学一、回答下列问题1. 写出 -内酰胺类抗生素青霉素类和头胞菌素类的结构通式。
书(药物化学第二版主编徐文方)P2132. 写出局麻骨架中中间链对作用时间长短的顺序。
书(药物化学第二版主编徐文方)P18”(二)中间连接部分”这段3. 说明拟肾上腺素药N上取代基对受体选择性的影响。
书(药物化学第二版主编徐文方)P116“4.侧链氨基被非极性烷基R’取代时,……”这段4. 说明苯乙基吗啡较吗啡镇痛作用强的原因。
吗啡17位氮上去甲基,镇痛活性及成瘾性均降低,这是由于分子极性增加,不易透过血脑屏障所致。
氮上甲基若变成乙基后为拮抗剂占优势的药物。
5. 氮芥类抗肿瘤药毒性较大,如何通过结构修饰降低其毒性?根本原理是通过减少氮原子上的电子云密度来降低氮芥的反应性,达到降低其毒性的作用,但这样的修饰也降低了氮芥的抗肿瘤活性。
1、在氮芥的氮原子上引入一个氧原子,使氮原子上的电子云密度减少,从而使形成乙撑亚胺离子的可能性降低,也使毒性和烷基化能力降低,抗肿瘤活性随之降低。
2、将氮原子上的R基进行交换,用芳香环取代结构的脂肪烃甲基,得到芳香氮芥。
芳环的引入可使氮原子上的孤对电子和苯环产生共轭作用,减弱氮原子的碱性。
6. 在肾上腺皮质激素的C-1、C-6、C-9、C-16和C-21位如何进行结构修饰及结构修饰的目的。
1、C-21:21位上的羟基被酯化,可使其作用时间延长以及稳定性增加;2、C-1:1-2位脱氢在A环引入双键,可使A环构型从半椅式变成船式,能提高与受体的亲合力,增加糖皮质激素的活性,不增加盐皮质激素的活性;3、C-9:C-9F取代,提高作用强度,增加糖皮质激素和盐皮质激素的活性;4、C-16:在16位引入基团可消除钠潴溜,16位甲基的引入,降低盐皮质激素的活性,16位羟基的引入,降低糖皮质激素的活性,5、C-6:在C-6引入氟原子后可阻滞C-6氧化失活,其抗炎以及钠潴留活性均大幅增加,而后者增加得更多。
山东大学网络学院无机化学3

无机化学模拟题3一、选择题(只选择一个正确答案):D 1、难挥发性非电解质稀溶液的依数性取决于:A.溶液的体积 B. 溶质的本性C. 溶液的温度D. 单位体积溶液中溶质粒子的数目A 2、在50g水中溶解0.5g非电解质,1000kPa时测得该溶液的凝固点为-0.30℃,则该非电解质的摩尔质量为:(水ΔT f=1.86)A. 62B. 48C. 56D. 34C 3、今有葡萄糖(C6H12O6)、蔗糖(C12H22O11)、KCl、AlCl3四种溶液,其浓度都是1mol.L-1, 其渗透压由高到低的顺序是:A. C6H12O6 > C12H24O11 > KCl > AlCl3B.KCl > AlCl3> C6H12O6 > C12H24O11C. AlCl3 > KCl > C6H12O6 = C12H24O11D. AlCl3 > KCl > C12H24O11 > C6H12O6B 4、用电导法实验测得强电解质溶液的电离度总是小于100%,其主要原因是:A.电解质本身不完全电离B.正、负离子相互吸引C.电解质溶液浓度不准D.电解质的溶剂化作用C 5、在同体积、等摩尔浓度的下列盐溶液中,使BaSO4的溶解度最大者是:A.KNO3 B. Ca(NO3)2C. AlCl3D. Na2SO4D 6、s区元素的价电子层结构特征为:A. (n-1)d1-9ns1-2B. ns2np1-6C. (n-1)d10ns1-2D. ns1-2C 7、已知反应:2NO(g) + Br2(g) = 2NOBr(g)的反应历程是(1) NO(g) + Br2(g) = NOBr2(g) 快(2) NOBr2(g) + NO(g) = 2NOBr(g) 慢则反应的速率方程应为:A. V = k[NO]B. V = k[NOBr2][NO]C. V = k[NO]2[Br2]D. V = k[NO][Br2]B 8、有一基元反应:3A + B = C,V a与V b的关系为:A.V a = V b B. 1/3V a =V bC. 3V a = V bD. V a3 = V bB 9、实验中需要配制pH值等于6的缓冲溶液100ml。
山东大学 药学(无机化学)网络教育答案

•班级:2019年上学期高起专成绩: 90分一.单选题(共30题75.0分)1在乙炔(C2H2)分子中,碳碳原子间的化学键情况为•A、•B、•C、•D、我的答案:D得分: 2.5分2pH=5.75的HAc-NaAc缓冲溶液,其缓冲比是()(已知pKa,HAc=4.75)•A、•B、•C、•D、我的答案:D得分: 2.5分3下列各缓冲体系缓冲容量最大,缓冲能力最好的一组是•A、•B、•C、•D、我的答案:C得分: 2.5分4根据酸碱质子理论认为,下列全部是酸的是•B、•C、•D、我的答案:B得分: 2.5分5向CrCl3·6H2O溶液中加入AgNO3,经测定有2/3的氯被沉淀,据此推知溶液中存在的配离子是•A、•B、•C、•D、我的答案:D得分: 2.5分6下列化合物中,可作螯合剂的是•A、•B、•C、•D、我的答案:C得分: 2.5分7下列各组量子数中,不合理的一组是•A、•B、•C、•D、我的答案:B得分: 2.5分8难溶电解质Ca3(PO4)2,若用S表示其溶解度(mol•L-1),则溶解度与溶度积的关系为•A、•B、•D、我的答案:C得分: 2.5分9在氨水中加入少量固体NH4Ac后溶液的pH值将•A、•B、•C、•D、我的答案:B得分: 2.5分10在Fe—Cu原电池中其正极反应式及负极反应式正确的为•A、•B、•C、•D、我的答案:D得分: 2.5分11用奈斯特方程式计算MnO4-/Mn2+的电极电势E下列叙述不正确的是•A、•B、•C、•D、我的答案:C得分: 2.5分12n,l,m确定后,仍不能确定该量子数组合所描述的原子轨道的()•A、•B、•C、•D、我的答案:D得分: 2.5分13下列说法中不正确的是( )•A、•B、•C、•D、我的答案:C得分: 2.5分14对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是 ( )•A、•B、•C、•D、我的答案:C得分: 2.5分15若把某原子核外电子排布写成ns2np7,它违背了()•A、•B、•C、•D、我的答案:A得分: 2.5分16实验中需要配制pH值等于6的缓冲溶液100ml。
药用无机化学试题及答案

药用无机化学试题及答案一、选择题(每题2分,共20分)1. 下列哪个元素不是人体必需的微量元素?A. 铁B. 锌C. 硒D. 铅答案:D2. 钙离子在体内主要参与哪种生理功能?A. 神经传导B. 肌肉收缩C. 细胞信号转导D. 以上都是答案:D3. 以下化合物中,哪一个不是无机化合物?A. 氯化钠B. 硫酸钾C. 葡萄糖D. 碳酸氢钠答案:C4. 以下哪种物质是胃酸的主要成分?A. 盐酸B. 硫酸C. 硝酸D. 醋酸5. 哪种元素在体内过量会导致氟骨病?A. 钙B. 氟C. 镁D. 钾答案:B6. 以下哪种元素是人体必需的宏量元素?A. 铜B. 铁C. 锌D. 钠答案:D7. 以下哪种化合物不是抗酸药?A. 氢氧化铝B. 碳酸氢钠C. 硫酸镁D. 碳酸钙答案:C8. 以下哪种元素是维生素B12的组成部分?A. 钴B. 铁C. 锌D. 铜答案:A9. 以下哪种化合物是常用的消毒剂?B. 碘化钾C. 过氧化氢D. 碳酸氢钠答案:C10. 以下哪种元素是人体必需的微量元素?A. 钠B. 钾C. 钙D. 碘答案:D二、填空题(每题2分,共20分)1. 人体必需的微量元素包括____、____、____、____、____、____、____、____、____、____。
答案:铁、锌、铜、硒、碘、钴、钼、铬、氟、锰2. 钙离子在体内参与的主要生理功能包括____、____、____。
答案:神经传导、肌肉收缩、细胞信号转导3. 胃酸的主要成分是____,其化学式为____。
答案:盐酸,HCl4. 以下化合物中,____是无机化合物,____是有机化合物。
答案:氯化钠,葡萄糖5. 氟骨病是由于体内____元素过量引起的。
答案:氟6. 人体必需的宏量元素包括____、____、____、____、____、____、____、____。
答案:钠、钾、钙、镁、磷、硫、氯、碳7. 抗酸药主要包括____、____、____、____。
山东大学网络教育 157#——无机化学(化) 考试试题及参考答案

答:既然它们都是反磁性物质,说明在其原子中均不存在成单电子,Pt2+离子的价层电子构型为d8,Pt4+离子的价层电子构型为d6,既然各自的配合物均显示反磁性,证明它们都是内轨型配合物。
答:氢氟酸主要是通过氟化钙与浓硫酸反应制得:
CaF2+ H2SO4= 2HF + CaSO4
盐酸主要是通过氢气和氯气在光照下反应生成HCl,然后用水吸收:
Cl2+ H22HCl
氢溴酸主要是通过:
2P + 3Br2+ 6H2O 2H3PO3+ 6HBr↑
③ 过滤并将滤液浓缩重结晶得到硼砂,后用H2SO4处理使硼砂转化为难溶于水的硼酸:
Na2B4O7+ H2SO4+ 5H2O = 4H3BO3¯ + Na2SO4
④ 过滤、洗涤、晾干硼酸晶体,加热分解得到B2O3
2 H3BO3B2O3+3H2O
⑤ 在高压及三氯化铝催化下,用铝和氢气还原B2O3制得乙硼烷
在cis-PtCl4(NH3)2中中心离子采取d2sp3杂化,Pt4+的6个杂化轨道分别与4个Cl-离子3p轨道和2个NH3分子的sp3杂化轨道重叠形成6个σ键,分子构型为八面体。 在cis-PtCl2(NH3)2、cis-PtCl2(en)中中心离子都是采取dsp2杂化,Pt2+的4个杂化轨道分别与2个Cl-离子3p轨道和2个N原子的sp3杂化轨道重叠形成4个σ键,分子构型为平面四边形。
答:HgI2产生颜色的原因是Hg2+离子半径较大,具有较强的极化作用和变形性,I-离子同样半径较大变形性较大,因此HgI2中正负离子的相互极化作用很强,导致化学键由离子键向共价键转化,电荷迁移明显,吸收的能量处在可见光范围,当可见光照射时,吸收红色光的互补光,从而显红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学一、选择题(只选择一个正确答案):C 1、稀溶液的下列性质中,哪一个性质与溶质的本性有关:A.渗透压B.凝固点降低C.酸碱性D.沸点升高D 2、在高锰酸根(MnO4- )离子中,元素锰(Mn)的氧化数为:A.+4 B.+5C.+6 D.+7B 3、根据酸碱质子理论,下列物质属于两性物质的是:A.NH4+B.H2OC.S2-D.Cl-B 4、改变下列哪一个条件才能使多数反应的速率常数增大:A.降低反应物质的浓度。
B.升高温度。
C.增大压力。
D.增加反应物的浓度。
D 5、AgNO3能从Ni(H2O)3Cl2中沉淀出½的氯,则该配合物的化学式应是:A.〔Ni(H2O)3Cl2〕B.〔Ni(H2O)2Cl2〕(H2O)C.〔Ni(H2O)3〕Cl2D.〔Ni(H2O)3Cl〕ClC 6、在下列物质分子中,存在的化学健既具有方向性又具有饱和性的是:A.MgCI2B.H2OC.NaCI D.KBrA 7、下列四种配合物离子中,空间构型是四面体结构的为:A.[Ni(NH3)4] B.[Ni(CN)4]2-C.[Pt(NH3)2Cl2] D.[PtCl4]2-D 8、某金属离子形成的配合物磁距是4.90 B.M,该配合物离子中的成单电子数为:A.1 B.2C.3 D.4A 9、下列溶液中,不具有缓冲作用的是:A.纯水。
B.0.1mol·L-1HAc溶液和0.1mol·L-1NaAc溶液的等体积混合溶液。
C.新鲜血浆。
D.0.1mol·L-1HAc溶液和0.05mol·L-1NaOH溶液的等体积混合溶液。
D 10、在同体积等摩尔浓度的下列盐溶液中,使BaSO4的溶解度最大者是:A.KNO3B.Al(NO3)3C.BaCl2 D.Na2SO4A 11、将反应Fe2+(c1)+ Ag +(c3)= Fe3 + (c2)+ Ag 组成电池,下列电池符号书写正确的是:A.(-)Pt│Fe2+(c1), Fe3 +(c2)‖Ag +(c3)│Ag (+)B.(-)Fe│Fe2+(c1), Fe3 +(c2)‖Ag +(c3)│ Ag(+)C.(-)Ag│Fe2+(c1), Fe3 +(c2)‖Ag +(c3)│Ag (+)D.(-)Pt │Fe2+(c1), Fe3 +(c2)‖Ag +(c3)│ Pt(+)B 12、已知某元素原子的价电子层结构为3d54s2,则该元素的的元素符号为:A.Zn B.MnC.Fe D.NiD 13、在NH4+ + OH- = NH3 + H2O 平衡体系中,根据质子理论属于酸的物种为:A.N H4+B.NH3 和H2OC.NH4+和OH- D.NH4+ 和H2OB 14、配位数为4的内轨型配合物,其空间构型为:A.正四面体B.正八面体C.三角锥形D.平面正方形A 15、4d5符号表示的意义是:A.第四电子层的d轨道上有五个电子。
B.五个d轨道上有四个电子。
C.第四电子层中的五个d轨道。
D.第四电子层中一个d轨道上的5个电子。
二. 填空(在下列划线空格处填入正确的答案):1、一般来说,缓冲溶液的pH值缓冲范围是pKa±1 。
2、Si原子的价电子层结构是____1S22S22P63S23P2__________;在SiH4分子中,Si原子的一个3S 电子被激发到空的3P 轨道上,激发态的Si原子的价电子层结构为_1S22S22P63S13P x13P y13P z1;在形成SiH4分子时,Si原子中含单电子的一个3P 轨道和三个nP2 轨道首先进行SP3 杂化,因此,形成的SiH4分子的空间构型为正四面体。
3、写出下列元素原子或离子的核外电子排布式:(1)Cu:1S22S22P63S23P63d104S1。
(2)Cl:1S22 S22 P63 S2 3 P5。
(3)Ne:1S22 S22 P6。
(4)Mg2+:1S22 S22 P6。
4、根据题意,写出下列物质的名称或化学式:(1)[Co(NH3)5 SO4] Br 溴化硫酸根五氨合钴。
(2)六氟合硅(Ⅳ)酸钾K[SiF6] 。
(3)[Pt(OH)2(NH3)2Cl2] 氯化二氨二氢氧化合铂。
(4)氯化二氯·二水·二氨合钴(Ⅲ)[Co(NH3)2(H2O)2Cl2]Cl 。
三.判断是非题(对者打√,错者打×):×1、在氧化还原反应过程中,失去电子的过程称为还原,得到电子的过程称为氧化。
×2、在任何条件下,均可以通过直接比较Eθ值的大小,来比较不同的氧化剂氧化能力的相对强弱。
√3、核外电子绕原子核作旋转运动时,具有形状固定的运动轨道,例如:s 轨道是圆形的,p轨道是哑铃形的。
×4、根据量子力学理论,可以用三个确定的量子数n、l、m组成一套参数,来描述核外电子的一种运动状态。
×5、因为在形成PH3分子时,P原子采用的是sp2杂化,所以,分子的空间构型为三角锥型。
×6、色散力是存在于非极性分子之间的分子间力,而取向力是存在于极性分子之间的分子间力。
四、名词解释(举例说明):1、溶度积。
在一定温度下,一种难溶盐电解质的饱和溶液在溶液中形成一种多次离子平衡,其平衡常数称为溶度积。
2、渗透压。
将纯溶剂与溶液隔开时,为了阻止纯溶剂分子向溶液渗透所需施加于该溶液的额外压力。
3、原电池。
利用氧化还原反应,将化学能转变为电能的装置。
4、几率密度。
用于说明原子中的电子在核外空间某处单位体积里出现的机会的多少。
五、计算题:1、在冬季,为了防止汽车冷却水结冰,常常在其中加入甘油以降低水的凝固点。
问:如果将冷却水的凝固点降至271K,则在1000克水中应加入甘油多少克?(甘油的M = 92)水的kf:1.86M B =△Tf/kf×MB=(273-271)/1.86×92=98.92(g)2、在298K时,有如下氧化还原反应发生:Cu2++ Cd = Cd 2++ Cu已知:EθCu2+/Cu = 0.337 V ,EθCd2+/Cd = -0.403 V。
如果利用此氧化还原反应组成原电池,回答:(1)写出标准状态下电池符号及半电池反应式。
(2)判断:在标准状态下,反应能否正向自发进行?(3)当:[Cu2+] = 1.0×10-6 mol.L-1,[Cd2+] = 10.0 mol.L-1时,计算电池电动势,并指出反应进行的方向。
(1) Cu2++ 2e- = CuCd - 2e- = Cd 2+(2) △E=EθCu2+/Cu - EθCd2+/Cd=0.337-(-0.403)=0.71V>0 ,能自发进行.(3) E 池= Eθ池 + 0.059/2 lg[Cu2+]/[Cd2+]=0.71+ 0.059/2*7=0.9165V无机化学一、选择题(只选择一个正确答案):A 1、稀溶液的下列性质中,哪一种性质与溶质的本性无关:A.凝固点下降B.反应速率C.酸碱性D.配位性D 2、在亚硫酸根(SO32- )离子中,元素硫(S)的氧化数为:A.+7 B.+5C.+6 D.+4D 3、根据酸碱质子理论,下列物质不属于两性物质的是:A.氨基酸B.Cl-C.HS-D.NH3B 4、在下列因素中,能影响化学反应速率常数的是:A.浓度。
B.温度。
C.压力。
D.反应物的物质的量。
D 5、对于难溶性强电解质Mg(OH)2,溶解度S与溶度积常数Ksp之间的关系为:A.Ksp = S2B.Ksp = 2S2C.Ksp = 4S2D.Ksp = 4S3A 6、在下列物质的溶液中,能与H2O分子形成氢键结合的是:A.NH3B.CH4C.NaCI D.KBrC 7、配合物[Pt(NH3)2Cl2]的空间构型是:A.直线型B.四面体型C.平面正方型D.八面体型D 8、某金属离子形成的配合物磁距是4.90 B.M,该配合物离子中的成单电子数为:A.1 B.2C.3 D.4B 9、实验中需要配制pH值等于6的缓冲溶液100ml。
现有以下四种pKa不同的缓冲对可供选择,如果不考虑其他因素,选择的最佳缓冲对的pKa应是:A.pKa = 4.75 B.pKa = 5.60C.pKa = 7.50 D.pKa = 8.20A 10、一定温度下,在难溶性强电解质AgI的沉淀溶解平衡中,加入固体Na2SO4使其浓度为1mol.L-1,则有:A.溶液中Ag+的浓度增大。
B.溶液中Ag+的浓度减小。
C.溶液中Ag+的浓度不变。
D.不影响沉淀溶解平衡。
D 11、将反应:Cu2+(c1)+ H2(g)= Cu(s)+ 2H+(c2)设计组成电池,其正确的电池符号书写形式是:A.(-)Pt│Cu2+(c1)| Cu(s)‖H+(c2)│H2(kPa)(+)B.(-)Cu(s)│Cu2+(c1)‖H+(c2)│H2(kPa)(+)C.(-)H2(kPa)│H+(c2)‖Cu2+(c1)| Cu(s)│Pt (+)D.(-)Pt │H2(kPa)│H+(c2)‖Cu2+(c1)│Cu(s)(+)A 12、已知某元素原子的价电子层结构为3d104s2,则该元素的的元素符号为:A.Zn B.ClC.Ca D.CuA 13、根据酸碱电子理论,在配位反应:Cu2+ + 4 NH3 = [Cu(NH3)4]2+中,Cu2+应该属于:B.中心离子B.酸C.碱D.酸碱加和物B 14、在下列配离子中,属于内轨型的配离子是:A.[Fe(H2O)6]2+B.[Fe(CN)6]4-C.[Zn(N H3)4]2+D.[FeF6]4-C 15、4p x2符号表示的意义是:A.第四电子层的p轨道上有2个电子。
B.四个p x轨道上有2个电子。
C.第四电子层的p x轨道上有2个电子。
D.第四电子层中有2个电子。
二. 填空(在下列划线空格处填入正确的答案):1、在多电子原子中,核外电子排布应遵循的三个原则是:保利不相容原理、能量最低原理、洪特规则。
2、C原子的价电子层结构是___1S22S22P2__________________;在CH4分子中,C原子的一个2S 电子被激发到空的2P 轨道上,激发态的C原子的价电子层结构为1S22S12P x1_2P y12P z1___;形成CH4分子时,C原子中含单电子的一个2P 轨道和三个SP2轨道进行SP3 杂化,因此,CH4分子的空间构型为正四面体。
3、写出下列元素原子或离子的核外电子排布式:(1)Co:1S22 S22 P63 S2 3 P63d7 4 S2。
(2)F:1S22 S22 P5。
(3)Mg:1S22 S22 P63 S2。
(4)Fe2+:1S22 S22 P63 S23 P63d6。
