酯自身缩合反应机理
Claisen(克莱森)缩合反应资料
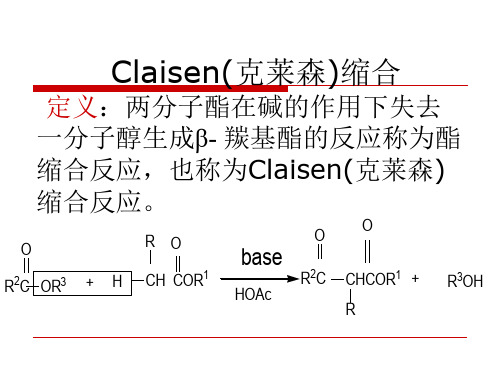
CH2
COOC2H5
①C2H5ONa
COCOOC2H5
+ (COOC2H5)2
CH2
COOC2H5
②H2O
CH
COOC2H5
CH2
COOC2H5
COCOOH
NaOH
H+
CH
Δ
COOH
CH2
COOH
CH2COCOOH CH2COOH
2.3 甲酸酯与其它酯的反应
与甲酸酯发生酯缩合反应后,即在α碳原子上引入一 个甲酰基。
O O
C2H5ONa
O O
CH3C CHCOC2H5
H
H+
CH3C CCHOC2H5 Na
关键因素:
酯的缩合物与碱生成盐是缩合反应完成的关键 一步。
为使反应顺利进行,两个羰基之间的碳上必须 有活泼氢。因此原料酯上的α碳上至少需要两个 氢。一个用于被碱夺取,另一个用于生成盐。
假如原料酯的α碳上只有一个活泼氢,则缩合反 应必须在更强碱的作用下才能完成。如:异丁 酸乙酯在乙醇钠作用下,不能发生酯缩合反应, 但在三苯甲基钠的作用下就可进行缩合。
CH3CHCOOC2H5 COCOOC2H5
注:
草酸酯的缩合产物有一个α-羰基酸酯的集团,加热即失
去一分子一氧化碳,变成取代的丙二酸酯。苯基取代的
丙二酸酯,不能用溴苯进行芳基化取代,但可用此法制
得:
C6H5CH2COOC2H5
+ (COOC2H5)2
①C2H5ONa ②H+
C6H5CHCOOC2H5
Claisen(克莱森)缩合
定义:两分子酯在碱的作用下失去
一分子醇生成β- 羰基酯的反应称为酯
Claisen酯缩合反应及机理
Claisen(克莱森)酯缩合反应
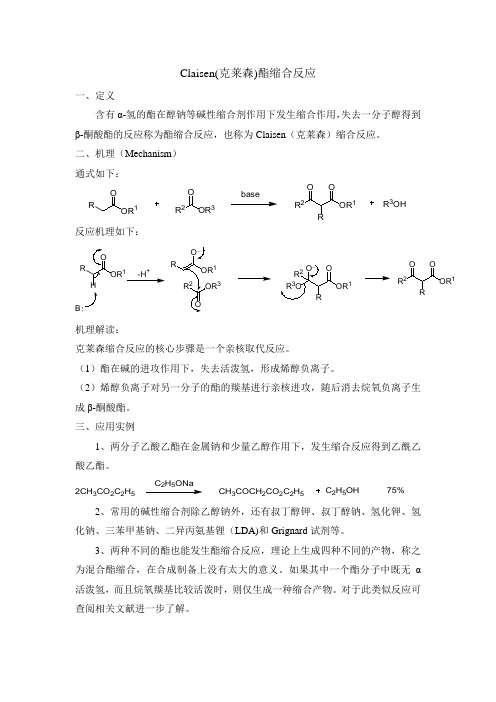
一、定义
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯的反应称为酯缩合反应,也称为Claisen(克莱森)缩合反应。
二、机理(Mechanism)
通式如下:
R O
OR1R2OR3
O base
R2OR1
O O
R3OH
反应机理如下:
1
B
-H+
1
3
1R
2OR1
O O
机理解读:
克莱森缩合反应的核心步骤是一个亲核取代反应。
(1)酯在碱的进攻作用下,失去活泼氢,形成烯醇负离子。
(2)烯醇负离子对另一分子的酯的羰基进行亲核进攻,随后消去烷氧负离子生成β-酮酸酯。
三、应用实例
1、两分子乙酸乙酯在金属钠和少量乙醇作用下,发生缩合反应得到乙酰乙酸乙酯。
2CH3CO2C2H5C2H5ONa
CH3COCH2CO2C2H575%
C2H5OH
2、常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二异丙氨基锂(LDA)和Grignard试剂等。
3、两种不同的酯也能发生酯缩合反应,理论上生成四种不同的产物,称之为混合酯缩合,在合成制备上没有太大的意义。
如果其中一个酯分子中既无α活泼氢,而且烷氧羰基比较活泼时,则仅生成一种缩合产物。
对于此类似反应可查阅相关文献进一步了解。
claisen缩合反应

claisen缩合反应一、Claisen缩合反应的概念和原理Claisen缩合反应是一种重要的有机化学反应,其基本原理是通过两个酯或一个酯和一个醛/酮之间的羰基加成,形成β-羰基酯。
这种反应常用于有机合成中,可以制备出许多重要的有机化合物。
二、Claisen缩合反应的分类1. Claisen酯缩合反应:两个不同的酯在碱性条件下发生缩合反应,生成β-羰基酯。
2. Claisen内酯缩合反应:一种环状的β-羰基酮在碱性条件下发生内部环化,生成环状的β-内酯。
3. Dieckmann环化反应:两个相同的β-羰基酸酯在碱性条件下发生内部环化,生成环状的β-内酯。
三、Claisen缩合反应机理1. 首先,在碱性条件下,一个羰基亲核试剂(如乙氧根离子)攻击一个羧基碳上的电子不稳定位点,形成一个临时的α-羟基负离子中间体。
2. 然后,在第二个羰基试剂的作用下,这个中间体的负电荷被转移到第二个羰基碳上,形成一个新的负离子中间体。
3. 最后,经过质子化和消除水分子,生成β-羰基酯产物。
四、Claisen缩合反应的影响因素1. 碱催化剂:碱催化剂可以促进反应进行,并且影响反应速率和产物选择性。
2. 温度:温度对反应速率和产物选择性都有影响。
通常,较高温度可以加快反应速率,但也可能导致产生不良产物。
3. 反应物浓度:较高浓度的反应物可以加快反应速率,但也可能导致不良产物的生成。
4. 反应时间:反应时间也会影响反应速率和产物选择性。
通常,较长的反应时间可以增加产量和纯度。
五、Claisen缩合反应在有机合成中的应用1. 制备β-羰基酸酯:Claisen缩合反应是制备β-羰基酸酯的重要方法。
这些化合物在医药、香料和杀虫剂等领域都有广泛的用途。
2. 制备环状化合物:Claisen内酯缩合反应和Dieckmann环化反应是制备环状化合物的常用方法。
这些化合物在药物、农药和天然产物的合成中具有重要作用。
3. 制备α,β-不饱和羰基化合物:通过Claisen缩合反应可以制备出α,β-不饱和羰基化合物,这些化合物在有机光电子学、涂料和高分子材料等领域具有广泛的用途。
有机化学缩合反应

反应不可逆
O
C
H
RO
C
酯
强碱
O CC
RO
R' X
O
C
R'
RO
C
缩合反应
应予以考虑的问题: ➢ 反应的活性问题(一般酮和酯类化合物 α 氢的酸性不够强,
须强碱作用,反应条件较为苛刻) 。 ➢ 反应的区位选择性问题(不对称酮有两种反应位置)。 ➢ 酮或酯的自身缩合问题(醇醛缩合和Claisen缩合)
例1: O
否则会发生酯 交换而开环.
(2)草酸酯
OO
O
H5C2O C C OC2H5 + H CH2COC2H5 EtONa H2O
缩合反应
OO
O
HO- H+
H5C2O C C CH2COC2H5
175 oC
O
O
H5C2O C CH2COC2H5
丙二酸酯
OO HO C C CH2COOH
OO HO C C CH3
缩合反应
第十五章 缩合反应(1)
主要内容
▪ 酯的缩合反应(Claisen缩合,Dieckmann缩合,交叉 酯缩合),酯缩合反应机理
▪ 酮的酰基化 ▪ 酮或酯的酰基化反应在合成中的应用 ▪ b - 二羰基化合物的互变异构现象 ▪ 酮和酯类化合物 a 位的烷基化
一.复习:烯醇负离子及其部分反应
O
R' C CHR
CH2CH2CH3
例 2 (反合成分析)
a
a CO2C2H5
bO
b
缩合反应
a
原料易得
2 CH3(CH2)3CO2C2H5 合成方便
O
O
b
克莱森酯缩合反应机理

克莱森酯缩合反应机理克莱森酯缩合反应是一种重要的有机合成反应,被广泛应用于生物化学、有机合成和药物合成等领域。
这种反应的基本原理是以β-酰基联合物(如乙酰乙酸和苯酚)为底物,经过酸催化下的水解和缩合反应,生成新的酰化产物。
本文将从反应机理以及主要反应步骤两个方面详细介绍克莱森酯缩合反应。
一、反应机理克莱森酯缩合反应的机理较复杂,主要可分为三个步骤:酸催化水解、质子转移和羰基加成。
(1)酸催化水解首先,β-酰基联合物在酸的作用下发生水解反应,生成相应的酸和醇。
例如:乙酰乙酸与苯酚可以在硫酸的作用下水解成苯基丙酮和水。
(2)质子转移随着底物的水解,产生的苯基丙酮分子中的一个羰基带有正电荷,另一个羰基则带有负电荷。
为达到中性,α碳上的氢离子会向带负电荷的羰基迁移,形成稳定的偶电子共轭结构。
质子转移反应是本反应中最重要的步骤。
(3)羰基加成最后,由于酮与酯基序列相连,可能发生Ⅰ型加成,形成的β-酰羰基联合物是反应产物的主要组成部分。
二、主要反应步骤1、准备反应底物首先需要准备出乙酰乙酸和苯酚这两种反应底物。
其中,乙酰乙酸是一种有机酸,常为无色无臭的液体,可以通过将醋酸称为之后脱水得到。
苯酚则是一种无色透明的液体,可通过苯的氢氧化反应制得。
2、加入催化剂将乙酰乙酸和苯酚按照一定的比例混合,加入适量的硫酸作为催化剂,用磁力搅拌器搅拌至混合均匀。
3、反应将混合物放置在用于加热的反应器中,加热至适宜的温度继续搅拌,持续反应1-2小时。
反应结束后,用硫酸中和反应产物酸,然后用冰水洗涤,干燥后得到产物。
综上所述,克莱森酯缩合反应具有较高的化学反应性和广泛的应用前景,是有机合成和化学生物学领域不可或缺的重要反应之一。
酯基成环反应

酯基成环反应酯基成环反应是有机化学中一种常见的反应类型,也被称为酯内环化反应。
它是指酯分子中的羰基和羟基之间发生缩合反应,生成环状的化合物。
这种反应通常需要催化剂的存在,如酸或碱等。
下面将详细介绍酯基成环反应的机理、影响因素和应用。
一、机理酯基成环反应的机理可以分为两个步骤:首先是羟基与羰基发生加成反应,生成一个临时中间体;然后是临时中间体内部亲核攻击,形成环状产物。
具体来说,在催化剂(如硫酸)存在下,羟基会先与羰基发生加成反应,形成一个稳定的过渡态。
在这个过渡态中,羟基上带有一个负电荷,而羰基上带有一个正电荷。
接着,在这个过渡态内部,负电荷会被邻近的羰基吸引,并向其移动。
这样就形成了一个稳定的临时中间体。
在这个临时中间体中,由于负电荷已经转移到了邻近的羰基上,因此原来带有负电荷的羟基就变成了一个亲核物。
这个亲核物会攻击临时中间体中的羰基,形成环状产物,并释放出一个催化剂分子。
二、影响因素酯基成环反应的影响因素主要包括以下几个方面:1. 催化剂:不同的催化剂对反应速率和选择性都有很大影响。
常用的催化剂有硫酸、氢氧化钠等。
2. 反应条件:包括反应温度、反应时间、溶剂等。
通常情况下,较高的温度和较长的反应时间可以促进反应进行,但也可能导致产物分解或杂质生成。
3. 底物结构:不同结构的酯分子对反应速率和选择性都有影响。
一般来说,含有较活泼羟基或较易形成稳定临时中间体的酯分子更容易进行酯基成环反应。
4. 其他因素:如溶液pH值、浓度等也会对反应产率和选择性产生影响。
三、应用酯基成环反应在有机合成中具有广泛的应用。
一些常见的例子包括:1. 合成环状化合物:酯基成环反应是制备环状化合物的重要方法之一。
例如,可以用这种反应来合成内酯、内酰胺等化合物。
2. 合成药物:许多药物分子中都含有环状结构,因此酯基成环反应可以用于制备药物前体或中间体。
例如,一些抗癌药物和抗生素就是通过这种反应合成的。
3. 合成天然产物:许多天然产物也含有环状结构,因此酯基成环反应也被广泛用于天然产物的全合成。
Claisen 酯缩合反应

C 6 H 5 C H 2 C O 2 C H 3 + (C O 2 C 2 H 5 ) 2
C 2H 5O N a
H
+
1 75 ℃
C 6 H 5C H C O 2 C 2H 5 C O 2C 2H 5
8 0~ 8 5 %
脂缩合也可在分子内进行,比如典型的狄克曼反应
O O O O E tO N a H3O+
N a C H 2 C (O )C H 2 C (O )C H 3 +
E tO H
N aC H 2 C (O )C H 2 C (O )C H 3 +
H Cl
C H 3 C (O )C H 2 C (O )C H 3 +
N aC l
3.脂肪酸的合成 在酶的催化下,通过克莱森缩合反应不断地将丙二酰 辅酶A中的二碳单元添加到延伸中的碳链上,最终生成脂 肪酸。
反应通式
O R R O
'
O + R O R
'
R 'O + H 3O
-
O R R
O O R
'
+
R OH
'
反应机理
• 克莱森缩合反应的核心步骤是一个亲核取代反应,它的具 体步骤如下: • 1. 一分子羧酸酯在强碱的进攻下失去酰基的一个α -氢原 子,这是一个E2消除反应,并得到碳负离子A。
O R 'O + H α H R O R' H R
C 6H 5 C O 2C H 3 + C H 3 C H 2 C O 2C 2H 5 NaH H+ O C 6H5C CH3 C H C H 2 O 2C O 2 C 2H 5 56%
有机化学基础知识点整理酯的反应机理

有机化学基础知识点整理酯的反应机理酯的反应机理酯是有机化合物的一种重要类别,广泛存在于生物和化学领域中。
它们具有丰富的化学反应性质,可以通过各种方式进行合成和转化。
本文将整理酯的反应机理,旨在帮助读者更好地理解和应用有机化学基础知识。
一、酯的形成酯的形成主要是通过酸催化下的醇和羧酸(或酸酐)的缩合反应实现的。
该反应通常在常温下进行,生成酯与水。
反应机理如下:1. 酸性催化剂(一般为无水无矿酸)提供质子(H+)。
2. 质子攻击羧酸(R1-COOH)中的羟基(-OH),形成氧化羫离子(R1-CO+H2O)。
3. 氧化羫离子进一步与醇(R2-OH)发生缩合反应,生成过渡态(R2-O-CO-R1)。
4. 过渡态失去质子,生成酯(R2-O-CO-R1)。
总的反应方程式如下:R1-COOH + R2-OH → R1-COOR2 + H2O二、酯的水解酯的水解是指酯与水在碱性或酸性环境中发生反应,将酯分解为羧酸和醇。
酯水解在生物体内广泛存在,是一种重要的代谢途径。
1. 酸性条件下的水解当酯与较强的酸(如浓硫酸或盐酸)反应时,水分子先离解为质子(H+)和水合氢离子(H3O+)。
质子攻击酯中的羧基(-COOR),生成对应的酸酐。
通过这个步骤,酯可以转化为羧酸和醇。
反应机理如下:1. 水分子离解为质子(H+)和水合氢离子(H3O+)。
2. 质子攻击羧酸酯(R-COOR),生成酸酐(R-CO-OH2+)。
3. 酸酐发生水解,脱去酯中的羟基,生成羧酸(R-COOH)。
总的反应方程式如下:R-COOR + H+ → R-COOH2+ + ROHR-COOH2+ + H2O → R-COOH + H3O+2. 碱性条件下的水解酯在碱性条件下水解主要经历乌尔曼水解反应。
在碱性介质中,羧酸酯先与羟氧化钠(NaOH)反应生成羟基钠盐和酸酐。
接着,经过水分子的进一步攻击,酸酐转化为羧酸和相应的醇。
反应机理如下:1. 羧酸酯与碱反应生成羟基钠盐和酸酐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应内容:
羧酸酯在碱性催化剂作用下,与含有活泼亚甲基化合物 缩合而成 β-羰基化合物的反应。Claisen 缩合反应常用的催 化剂为 RONa、NaNH2、NaH 等该反应是制备 β-酮酸酯和 β-二酮的重要方法。
+ CH3COOC2H5 HCH2COOC2H5 C2H5ONa + CH3COCH2COOC2H5 C2H5OH
产物。是最有实用意义的缩合反应。
(4) 酯内环化反应( Dicekmann 缩合):二元酸酯若分子中的 酯基被四个以上的碳原子隔开时,就发生分子内酯缩合反应, 形成五元环或更大环的酯。
反应应用:
1. α-乙酰基 -γ-丁内酯(维生素B1中间体)的乙酰化法合成
原料:γ -丁内酯 、乙酸乙酯
参考文献:薛永强,张建平,崔子祥,闫济民,李文杰,α-乙酰基-γ-丁内酯的制 备法 CN201110123819.3[P],2011-11-02.
原料:丙酮、甲酸甲酯、甲醇
羧醛化反应
参考文献:许青青,徐丽丽. 4,4-二甲氧基-2-丁酮的合成研究[J]. 化学世界, 2008,03:166-168+171
7. 香料化合物3-甲基-2-羟基-环戊-2-烯-1-酮的合成
原料:丙酸乙酯、草酸二乙酯
3-甲基-2-羟基-环戊-2-烯-1-酮是高档、广泛的食用香料化合物,具有焦糖 和咖啡的天然香味,是一种良好的增香剂。
原料:硫代二甘酸二乙酯、草酸二乙酯
参考文献:陆秀凤,廖喜慧,刘于民.3,4-二羟基钠-2,5-二甲酸二乙酯噻吩的合成 [J]. 精细石油化工,2012,01:60-62.
5. 苯巴比妥的合成
苯巴比妥( Phenobarbital) , 属中枢神经系统药物, 为长效巴比妥类, 具 有镇静、催眠、抗惊厥作用。
共轭碱
反应类型:
(1)酯自身缩合 (2)含α-H 的酯/酮与含α-H 的酯/酮缩合:生成交叉缩合产物
O
O
+ CH3CH2CCH3 CH3CH2COEt
NaH Et2O
H3O+
OO
OO
+ CH3CH2CCH2CCH2CH3 CH3CH2CCHCCH3
CH3
(3)不含α-H 的酯/酮与含有α-H 的酯/酮:纯度较高的单一
原料:丙酸乙酯、草酸二乙酯
Michael加成 Dicekmann缩合
脱羧反应
参考文献:阎峰,姜岚,周永昌. 香料化合物-3甲基-2-羟基-环戊-2-烯-1-酮的合 成[J]. 沈阳化工学院学报,2005,01:1-4.
8. 1-甲基-3-正丙基-5-吡唑羧酸的合成
1-甲基-3-正丙基-5-吡唑羧酸是合成一种治疗心血官疾病的医药中间体。
原料:2-戊酮、草酸二乙酯、肼、
甲基化、水解 参考文献:俞海,徐宝财. 1-甲基-3-正丙基-5-吡唑羧酸的制备[J]. 精细石油 化工,2000,03:20-22.
原料:苯乙酸乙酯、碳酸二乙酯、脲
缩环反应 参考文献:张国福,王喜存,彭亮.苯巴比妥合成方法的绿色化研究[J]. 甘肃高师 学报,2007,02:37-38.
6. 4,4-二甲氧基-2-丁酮的合成
4,4-二甲氧基-2-丁酮,在医药、农药、染料等领域具有广泛的应用价值, 可合成医药、农药重要中间体2-巯基-4-甲基嘧啶等。
柠檬酸西地那非是一种 5-磷酸二酯酶抑制剂,使海绵体内血管平滑肌松 弛而充血。
原料:2-戊酮、草酸二乙酯、肼
缩环反应
4. 3,4-二羟基钠-2,5-二甲酸二乙酯噻吩(聚乙撑二氧噻 吩单体)的合成
聚乙撑二氧噻吩是一种导电聚合物,在固体电容器、抗静电涂层、通孔 线路板电镀、光伏电池等工业领域方面有大的应用。
酯-酯自身缩合
反应机理:
+ CH3COOC2H5 C2H5O
O
O
+ CH3COC2H5 CH2COC2H5
亲核取代
O
+ CH2COC2H5 C2H5OH
碳负离子
O
O
CH3
C CH2COC2H5 OC2H5
O
O
CH3 C CH2COC2H5 OC2H5
+ CH3COCH2COOC2H5 C2H5O
2. (4-甲Βιβλιοθήκη 苯甲酰基)-3.3.3-三氟代丙酮(塞莱昔布Celecoxib 中间体)的合成
塞莱昔布是一个环氧合酶抑制剂,主要用于治疗类风湿关节炎和骨关节炎。
原料:对甲基苯乙酮 三氟乙酸乙酯 对氨基磺酰基苯肼
缩环反应
3. α,β-二氧代庚酸乙酯的 α-位烯醇式 (钠盐柠檬酸西地那非 Sildenafil Citrate 中间体)的合成
