游离甲状腺素(FT4)校准品产品技术要求华科泰
抗甲状腺球蛋白抗体(TG-Ab)测定试剂盒(化学发光免疫分析法)产品技术要求华科泰

抗甲状腺球蛋白抗体(TG-Ab)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人血清中抗甲状腺球蛋白抗体(TG-Ab)的含量。
1.1 包装规格96人份/盒。
1.2 主要组成成分主要组成成分见表1。
表1注:校准品靶值批特异、具体浓度详见标签。
2.1 物理性能试剂盒的各液体组分应澄明,无沉淀或絮状物。
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度试剂盒内校准品与相应浓度的中国食品药品检定研究院的标准品(编号150556)同时进行分析测定,用Log(x)-Log(y)模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以中国食品药品检定研究院的标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.3 剂量-反应曲线的线性在企业线性范围内[120,2400]IU/ml,剂量-反应曲线的相关系数应(r)应不低于0.9900。
2.4 重复性重复性(CV%)应不高于10.0%.2.5 批间差2.5.1 批间差批间差(CV%)应不高于15.0%。
2.5.2 批内瓶间差校准品各浓度点(除零外)批内瓶间差(CV%)应不高于15.0%。
2.6 空白检测限试剂盒的空白检测限应不高于100IU/mL。
2.7 特异性表2交叉反应2.8 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的标准品(编号:150556)。
2.9 稳定性2℃~8℃保存,有效期12个月,效期后2个月内分别检测2.1~2.4、2.6项,其结果应符合各项要求。
甲状腺素(T4)作业指导书

校准品:
Cal 1 定标液(白盖),2瓶,1ml/瓶,T4的浓度约为50nmol/l,牛血清, 含防腐剂
Cal 2 定标液(黑盖),2瓶,1ml/瓶,T4的浓度约为230nmol/l,牛血清,含防腐剂
Elecsys1010或2010、e411分析仪所需耗品:
Elecsys 系统缓冲液(ProCell)货号11662988
Elecsys测量池清洗液(CleanCell)货号11662970
Elecsys 添加剂液(SysWash)货号11930346
Elecsys 系统清洗液(SysClean)货号11298500
6.质量控制
Elecsys 通用质控品(PreciControl)1和2。质控品1和质控品2至少每24小时或每一次定标后测定一次。质控间隔期应适用于各实验室的具体要求。检测值应落在确定的范围内,如出现质控值落在范围以外,应采取校正措施。
7.计算方法
对每一个标本,仪器会自动计算TSH的含量,单位是nmol/l、μg/dl。
5.1 校准操作步骤:
在编缉各项目的参数时,已经在Application—Calib菜单中定义好了定标类型和几点定标。因此在对各项目进行定标时,只需在定标菜单Calibration中进行即可。进入Calibration—Status菜单,用鼠标选择需定标的项目,再根据需要点单点定标(BLANK键)或两点定标(TWO POINT键)、跨距定标(SPAN键)、多点定标(FULL键),再选择其它项目进行相应选择,最后点SAVE,将定标物放入在Calibration—Calibrator中定义好的位置,点Start,再点Start,仪器开始定标。
Elabscience 游离甲状腺素(fT4)酶联免疫吸附测定试剂盒 说明书

2022年修订第一版(本试剂盒仅供体外研究使用,不用于临床诊断!)产品货号:E-EL-0122c产品规格:96T/48T/24T/96T*5Elabscience 游离甲状腺素(fT4)酶联免疫吸附测定试剂盒使用说明书fT4(Free Thyroxine) ELISA Kit使用前请仔细阅读说明书。
如果有任何问题,请通过以下方式联系我们:销售部电话技术部电话************电子邮箱(销售)********************电子邮箱(技术)**************************网址:具体保质期请见试剂盒外包装标签。
请在保质期内使用试剂盒。
联系时请提供产品批号(见试剂盒标签),以便我们更高效地为您服务。
Copyright ©2021-2022 Elabscience Biotechnology Co.,Ltd. All Rights Reserved目录用途 (3)基本性能 (3)检测原理 (3)试剂盒组成及保存 (4)试验所需自备物品 (5)样品收集方法 (5)注意事项 (6)■ 试剂盒注意事项 (6)■ 样品注意事项 (6)样本稀释方案 (6)检测前准备工作 (7)操作步骤 (8)结果判断 (10)技术资源 (10)典型数据 (10)性能 (11)■ 精密度 (11)■ 回收率 (11)■ 线性 (11)声明 (12)Intended use (13)Character (13)Test principle (13)Kit components & Storage (14)Other supplies required (15)Sample collection (15)Note (16)■ Note for kit (16)■ Note for sample (16)Dilution Method (17)Reagent preparation (17)Assay procedure (18)Calculation of results (20)Technical resources (20)Typical data (20)Performance (21)■ Precision (21)■ Recovery (21)■ Linearity (21)Declaration (22)用途该试剂盒用于体外定量检测 血清、血浆或其他相关生物液体中fT4浓度。
游离三碘甲状腺原氨酸(FT3)质控品产品技术要求华科泰

游离三碘甲状腺原氨酸(FT3)质控品
组成:
游离三碘甲状腺原氨酸(FT3)质控品为冻干粉,由高、低两水平质控品组成,基质液为含添加0.1%生物防腐剂的牛血清。
适用范围:游离三碘甲状腺原氨酸(FT3)质控品与本公司生产的游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光法)配套使用,用于游离三碘甲状腺原氨酸(FT3)测定项目的室内质量控制。
2.1 外观
质控品包装标签应清晰,无磨损;冻干粉呈疏松体,加入纯化水复溶,溶解后的液体澄清透明,无沉淀或絮状物。
2.2 预期结果
测定高值、低值浓度质控品,其结果均应在质控范围内。
2.3 均匀性
2.3.1 瓶内均匀性
取同批号的一定数量(n≥10)最小包装单元的高、低值质控品,分别重复检测3次,变异系数(CV)应不高于10%。
2.3.2 瓶间均匀性
变异系数(CV)应不高于15%。
2.4 稳定性
2.4.1 复溶稳定性
质控品复溶后,-20℃以下储存,有效期15天,稳定期末质控品与新复溶质控品检测结果的差异不显著。
2.4.2 效期稳定性
质控品原包装2℃~8℃储存,有效期12个月,效期后两个月内检测2.2项,其结果应符合要求。
游离甲状腺素(FT4)测定试剂盒(时间分辨荧光免疫分析法)产品技术要求beifang

游离甲状腺素(FT4)测定试剂盒(时间分辨荧光免疫分析法)
)的含量。
适用范围:用于体外定量测定人血清中游离甲状腺素(FT
4
1.1包装规格
试剂盒包装规格为96人份/盒,具体组成见表1:
表1 试剂盒主要组成成分
2.1外观和物理检查
液体组分应澄清,无沉淀或絮状物;所有组分应无包装破损。
各组分装量不少于表1中要求。
2.2准确性
试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用百分结合率对数(Log-Logit)数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测效价与标示值效价的比应在
0.900~1.100之间。
2.3线性
用Log-Logit数学模型拟合,在2.8~80pmol/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4精密度
2.4.1批内精密度(CV%)应不高于15%。
2.4.2批间精密度(CV%)应不高于15%。
2.5最低检出限
应不大于1.4pmol/L。
2.6质控血清测定值
每次检测结果均应在允许范围之内。
2.7特异性
)结果不大于4pmol/L。
检测浓度为5000ng/ml的三碘甲腺原氨酸(T
3
2.8稳定性
2.8.1 37℃放置7天后,测定结果应符合上述2.1~2.7要求。
2.8.2 2~8℃放置12个月后,测定结果应符合上述2.1~2.7要求。
甲状腺功能复合定值质控品产品说明书 (3)

甲状腺功能复合定值质控品产品说明书
以下是甲状腺功能复合定值质控品的产品说明书:
产品名称:甲状腺功能复合定值质控品
产品型号:XXXXXXXX(根据具体产品而定)
生产商:XXXXXXXX(根据具体产品而定)
产品介绍:
甲状腺功能复合定值质控品是一种用于评估甲状腺功能检测方法准确性的标准物质。
该产品包含了各种甲状腺相关的生化指标,如TSH、T3、T4等,具有稳定性好、准确性高的特点。
产品特点:
1. 稳定性好:甲状腺功能复合定值质控品经过严格的制备工艺,能够保持长期的稳定性,确保每次使用的结果准确可靠。
2. 准确性高:该产品与国际标准物质进行比对,保证了结果的准确性。
3. 使用方便:甲状腺功能复合定值质控品提供了详细的使用说明,操作简便,适用于各种甲状腺功能检测方法。
适用范围:
甲状腺功能复合定值质控品适用于各种临床实验室、检验机构以及医疗机构中进行甲状腺功能检测方法的质量控制和准确性评估。
可以用于监测各种甲状腺功能检测方法的日常检测结果是否准确,并提供比对结果。
注意事项:
1. 请按照使用说明书中的指导操作,确保结果的准确性。
2. 在使用前,请检查产品的外观是否完好,如果有破损或其他异常情况,请勿使用。
3. 请在规定的温度和时间范围内存储该产品,避免受潮或高温等情况。
以上是甲状腺功能复合定值质控品的产品说明书,如有其他需要,请联系生产商进行咨询。
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)产品技术要求mairui
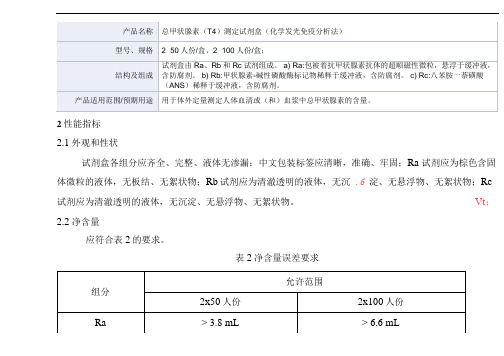
2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;Ra 试剂应为棕色含固体微粒的液体,无板结、无絮状物;Rb试剂应为清澈透明的液体,无沉.6 淀、无悬浮物、无絮状物;Rc 试剂应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
Vt;
2.2净含量
应符合表2的要求。
表2净含量误差要求
2.3准确度
对由国家标准品制备的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
2.4最低检测限
应不大于0.5卩g/dL。
2.5线性
试剂盒在1卩g/dL〜30卩g/dL范围内,其相关系数(r)应不低于0.9900□
2.6重复性
变异系数CV应<10%0
2.7批间差
变异系数CV应<10%o
2.8分析特异性
当样品中甘油三酯浓度与1800 mg/dL,胆红素浓度匕10 mg/dL,血红蛋白浓度%500 mg/dL时,测试结果的干扰偏差在±10%范围内。
样品中反T3浓度为100卩g/dL时,交叉反应率应<10%,当样品中L-三碘甲状腺氨酸浓度为500卩g/dL, —碘酪氨酸浓度为5000卩g/dL,二碘酪氨酸浓度为5000 gg/dL时,交叉反应率应<3%o。
游离甲状腺素测定试剂盒(磁微粒化学发光法)产品技术要求中生北控

游离甲状腺素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中游离甲状腺素的浓度。
1.1包装规格100人份/盒,50人份/盒。
1.2 主要组成成分2.1 外观2.1.1 试剂盒中的液体组分应澄清,无沉淀和絮状物,外包装完整无破损。
2.1.2 磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 准确度)检测试剂盒作为比对系统,以中生试以西门子公司已注册游离甲状腺素(FT4剂盒作为待测系统,分别测定40个在测定范围内的样本,计算两组数据的相关系数r,要求r≥0.975;2.4空白检测限应不大于1.0 pg/mL。
2.5 线性范围在[1.0,60]pg/mL测量范围内,线性相关系数r应≥0.9750。
2.6 重复性重复测试高、低浓度样本,变异系数(CV)应≤10%。
2.7 批间差测试同一样本,批间变异系数(CV)应≤15%。
2.8 特异性2.8.1 与三碘甲状腺原氨酸(T)3在本试剂盒上的测定结果应不高于5pg/mL。
浓度为10ng/mL的T3)2.8.2 与反三碘甲状腺原氨酸(rT3浓度为10ng/mL的rT在本试剂盒上的测定结果应不高于5pg/mL。
32.9稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6的要求。
2.10校准品溯源性校准品溯源性应符合GB/T 21415《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,并提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至工作校准品,工作校准品采用西门子公司同类产品比对定值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
游离甲状腺素(FT4)校准品
组成:
游离甲状腺素(FT4)校准品S0-S5为冻干粉,校准品S0含添加0.1%生物防腐剂的牛血清,校准品S1-S5为在含0.1%生物防腐剂的牛血清中添加游离甲状腺素(FT4)抗原。
适用范围:游离甲状腺素(FT4)校准品与本公司游离甲状腺素(FT4)测定试剂盒(磁微粒化学发光法)配套使用,用于人血清中游离甲状腺素(FT4)测定系统的校准。
2.1 外观
校准品包装标签应清晰,无磨损;冻干粉呈疏松体,溶解后的液体澄清透明,无沉淀或絮状物。
2.2 溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度
检测企业工作校准品,其测量结果的相对偏差应在±10%范围内。
2.4 均匀性
2.4.1 瓶内均匀性
各浓度点(除零外),变异系数(CV)应不高于10%。
2.4.2 瓶间均匀性
各浓度点(除零外),变异系数(CV)应不高于15%。
2.5 稳定性
2.5.1 复溶稳定性
校准品复溶后,-20℃以下储存,有效期15天,在效期内赋值结果的变化趋势不显著。
2.5.2 效期稳定性
校准品原包装2℃~8℃储存,有效期12个月,在效期内赋值结果的变化趋势不显著。
