二组分固液相图
大连理工大学 3.4 二组分系统固液平衡相图

Ge(A)
xB
Si(B)
图a Ge(A) - Si(B)系统的熔点-组成图
t/℃
l(A+B)
p/102kPa
t=55.1℃
l(A+B)
l+s
g(A+B)
s(A+B)
HgBr2 (A)
wB
HgI2 (B)
图a 最低熔点的液固相图
CHCl3(A)
yB
C3H6O (B)
图b 最低恒沸点气液相图
t/℃
l(A+B)
t/℃
80
l(A+B)
•t
* B
液相线(凝固
60
点降低曲线)
• 40 t
* A
s(A)+l(A+B)
l (A+B)+sB
固相线
20 C
•E s(A)+s(B)
共晶线
D
(温度、三个相的
0.0 0.2 0.4 0.6 0.8 1.0 组成都不变)
邻硝基氯苯(A) xB
对硝基氯苯(B)
E点:液相能存在的
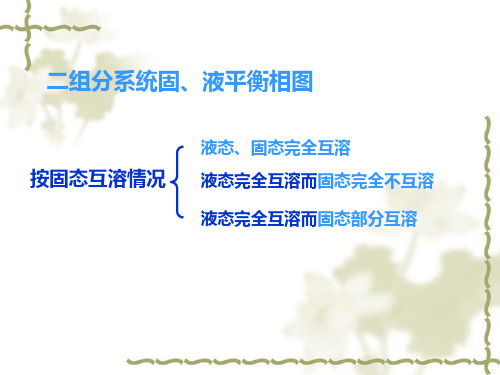
二组分系统固、液平衡相图
按固态互溶情况
液态、固态完全互溶 液态完全互溶而固态完全不互溶 液态完全互溶而固态部分互溶
1、 二组分固液态完全互溶的固-液平衡相图
T/K
t/℃
p一定
g(A+B)
t
* A
g(A+B) l(A+B)
l(A+B)
•t
* B
s(A+B) +l(A+B)
l(A+B)
t
* B
•t
实验5二组分固液相图的绘制

实验7
二组分固-液相图的绘制
物理化学研究室
何广平
实验目的
(1)学会用热分析法测绘Sn—Pb二组分金属 相图,了解固-液相图的基本特点。 (2) 掌握热电偶测量温度的原理及热电偶的 校正方法。 (3) 了解热分析法测量技术。
实验评注与拓展
绘制固液二组分相图的方法通常有溶解度法和热分析法。
溶解度法
指在确定的温度下,直接测定固液两相平衡时溶液的 浓度,然后根据测得的温度和相应的溶解度数据绘制相图, 这种方法使用于常温下易测定组成的体系,如水-盐二组分体 系等。 热分析法 适用于常温下不便直接测定固液平衡时溶液组成的体系(如合 金和有机化合物凝聚体系),通常利用相变时的热效应来测定组 成以确定体系的温度,然后根据选定的一系列不同组成的二组 分体系所测定的温度绘制相图.此种方法简单、易于推广,对 于一些二组分金属体系,若挥发的蒸汽对人体健康有害,则 可采用热分析法的另一种差热分析(DTA)或差示扫描( DSC)法绘制相图。
提问与思考
(1) 对于不同组成混合物的步冷曲线,其转折点与水平 段有什么不同? (2) 步冷曲线上为什么会出现转折点?纯金属、低共熔 混合物及合金的转折点各有几个?曲线形状有何不同? 为什么? (3)试从实验方法比较测绘气-液相图和固-液相图的 异同点。
参考文献
(1)清华大学化学系物理化学实验编写组编.物理化学实验.北 京:清华大学出版社, 1992 (2)复旦大学等编 庄继华等修订 物理化学实验(第三版).北京 高等教育出版社2005 (3)傅献彩 沈文霞 姚天扬编 .物理化学(第四版).北京:高等教 育出版社,1994 (4) McGRAW HILL, Experiments in physical chemistry, 7thed. 2003
3.4 二组分系统固液平衡相图
t/℃
80
l(A+B)
•t
* B
液相线(凝固
60
点降低曲线)
• 40 t
* A
s(A)+l(A+B)
l (A+B)+sB
固相线
20 C
•E s(A)+s(B)
共晶线
D
(温度、三个相的
0.0 0.2 0.4 0.6 0.8 1.0 组成都不变)
邻硝基氯苯(A) xB
对硝基氯苯(B)
E点:液相能存在的
l+s s(A+B)
p/102kPa
t=60℃ l(A+B)
lg g(A+B)
d-香芹(A) wB
l-香芹(B)
图a 最高熔点液固相图
H2O(A)
yB
C2H5OH(B)
图b 最高恒沸点气液相图
2 液态完全互溶而固态完全不互溶
t/℃ 80
60
• 40 t
* A
20
C
•E
•t
* B
t/℃
•t
* A
p=101 325Pa
出的t-xB图,列表回答系统在5C,30C,50C时的
相数、相的聚集态及成分、各相的物质的量、系统所 在相区的条件自由度数。
解:
系统 相数
温度
t / C
5
2
相的聚集态 及成分
s (A), s (B)
30 2 s (B), l (A+B)
50 1
l (A+B)
各相的物量
ns(A) = 2 mol ns(B) = 8 mol
t
* B
l (A+B)
第4节 两组分固-液系统相图

4、溶解度法
常用于水盐系统相图的测定。
*热分析法测定液-固系统相图
首先将某一定组成二组分固相系统加热熔化,记录冷 却过程中温度随时间的变化曲线,即步冷曲线
当系统有新相凝聚,放出相 变热,步冷曲线的斜率变小
出现转折点
出现水平线段
据此在T-x/(T-w)图上标出对应的 位置,得到二组分低共熔温度-组成图
一 形成简单低共熔混合物的液固系统相图
Cd-Bi二元相图的绘制
t/s
一 形成简单低共熔混合物的液固系统相图
纯Bi的步冷曲线
1. 加热到a点,Bi全部熔化 P = 1 f *= C -P+1= 1
温度可以下降 2. 冷至A点,固体Bi开始析出
P = 2 f *= C -P+1= 0 温度不能改变,为Bi熔点 3. 全部变为固体Bi后 P = 1 f *= C -P+1= 1 温度又可以下降
*相图的实验测定
相图的实验测定常用的方法有:
1、蒸气压(组成)法 测定一定温度下蒸气的压力及各相的组成。这 种方法通常用于气液平衡系统p - x 图的测定。
2、沸点组成法
在一定压力下测定溶液沸腾温度及各相的组成。
在双液系T - x 图的测定中通常使用该法。
3、热分析法
该法的要点是:配制不同组成的一系列样品加热 到熔化温度以上,然后让其缓慢而均匀地冷却, 测定温度随时间的变化,画出温度-时间关系曲线, 称为冷却曲线或步冷曲线(cooling curve)。当系统 内有相变化时步冷曲线上将出现拐点或平台。
一 形成简单低共熔混合物的液固系统相图
图上有4个相区:
1. AEH线之上, 熔液(l)单相区 f *= 2
2. ABE之内, Bi(s)+ l 两相区 f *= 1
55二组分固液系统

(2) 温度最低可降至-36oC
E1 H2O 0.2 0.4 0.6 0.8 Mn(NO3)2
BW6 BW3
• 制备Mn(NO3)2·3H2O的合理步骤: (1) 浓缩在浓度>E2之间; (2) 温度不可低于23.5oC,否则会同时有
Mn(NO3)2·6H2O和Mn(NO3)2·3H2O 生成
0 -10 冰+溶液
f=2-3+1=0
-20
E
-30 f=2-2+1=1 Ice+ (NH4)2SO4
H2O 0.2
0.4
0.6
w(NH4 )2 SO 4
0.8
水-硫酸铵相图
(NH4)2SO4
一、简单低共熔相图
2. 溶解度法绘制相图 某些盐和水的最低共熔点
盐
NaCl NaBr NaI KCl KBr
二、有化合物生成的固-液系统
2. 生成不稳定化合物
a b c
液相
a bc
T 液相+Na S G
Na2K +液 K +液 Na+Na2K
K+Na2K
Na
Na2K
K
化合物加热时,在熔点以下就发生分解,形成一新固相和一个组 成与化合物不同的液相.
二、有化合物生成的固-液系统
2. 生成不稳定化合物
因为形成的液相的组成与化合物的组成不同,故称此化合物 为“具有不相合熔点”的化合物.这种分解反应称为“转熔反 应”.
H2O(W) 0.2
0.4 0.6
wNa I /%
0.8 NaI(B)
H2O-NaI相图:形成不至一种稳定化合物
三、有固溶体生成的相图
二组分固液相图

⼆组分固液相图5.4⼆组分系统的固?液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及⽓相⽽仅涉及固相和液相时,则体系常称为"凝聚相体系" 或"固液体系"0固体和液体的可压缩性甚⼩,⼀般除在⾼压下以外,压⼒对平衡性质的影响可忽略不计,故可将压⼒视为恒量。
由相律:/="= C-^+2-n r=2-d> + 2-l = 3-£Z>因体系最少相数为①=1,故在恒压下⼆组分体系的最多⾃由度数 f * =2,仅需⽤两个独⽴变量就⾜以完整地描述体系的状态。
由于常⽤变量为温度和组成,故在⼆组分固液体系中最常遇到的是T?x (温度?摩尔分数)或T?①(温度?质量分数)图。
⼆组分固?液体系涉及范围相当⼴泛,最常遇到的是合⾦体系、⽔盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况°这类体系在液相中可以互溶,⽽在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
进⼀步分类可归纳如下:F『形成简单低共熔物休系固相完全不互溶体棗形成化合物体系⼻相合熔点化合物怵系不相合熔点化合物俸系EM体疾「没有最1■嚴最⾼熔点型固相完全互熔体茶最瞬点型最⾼熔点型■1固相部分互熔体系,⼀低共熔点型、转熔点型研究固液体系最常⽤实验⽅法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验⽅法,然后再对各种类型相图作⼀简介。
(⼀)⽔盐体系相图与溶解度法1 ?相图剖析图5-27为根据硫酸铵在不同温度下于⽔中的溶解度实验数据绘制的⽔盐体系相图,这类构成相图的⽅法称为 "溶解度法" 纵坐标为温度t 「C ),横坐标为硫酸铵质量分数(以①表⽰)。
图中FE 线是冰与盐溶液平衡共存的曲线,它表⽰⽔的凝固点随盐的加⼊⽽下降的规律,故⼜称为⽔的凝固点降低曲线。
二组分固态不互溶系统液-固平衡相图(共10张PPT)
★ 一般比例的混合物液体冷却得到不均匀的多相固体
9 二组分固态互溶系统液-固平衡相图
解答: (1)以含C6H675%为例,分析可知首先析出
C6H6,设最多析出x
(100g-x)× (75-64)=x ·(100-75)
请将该题做在作业本上
§6.8 二组分固态不互溶系统液 -固平衡相图
• 8.1 相图分析 • 8.2 热分析法 • 8.3 溶解度法 • 8.4 相图应用 (1)结晶分பைடு நூலகம் (2)其他应用
(3)步冷过程分析和共晶体结构
★ 纯A、纯B液体冷却得到均匀 的单相固体
★ 一般比例的混合物液体冷却得 到不均匀的多相固体
★ 低共熔混合物液体冷却得到匀称
的多相固体
§6.8 二组分固态不互溶系统液
-固平衡相图
• 8.1 相图分析 ★ 纯A、•纯B液8体.冷2却热得到分均匀析的单法相固体
例题:HAc-C6H6的凝聚系统相图如左图所示:由图可知, 该系统的低共熔点为-8℃,低共熔混合物的组成含C6H664%
§6.9 二组分固态互溶系统液固平衡相图
• 9.1 固态完全互溶系统
两组分固态互溶称固溶体或固态溶液,它通常
(2)由步冷(曲1线)绘步制相冷图曲线
由于两种组分分子、原子或离子大小接近, 在晶格中能够彼此取代而形成。
因此选用含(联苯2醚)7相3. 图
分析:明确各相区的相态→复习由系统点找相点的方法→用杠杆规则求相量
(质量百分数,下同)。
固相线----表示固相组成与熔点关系S1S2
• 8.3 溶解度法 分(析2):由明步确冷各曲相线区绘的制相相态图→复习由系统点找相点的方( 的法→1固)用体杠将为杆含规何C则6物求H?相67量最5% 多和析2出5该%固的体溶多液各少1克0?0g由20℃冷却,首先析出
二组分固态不互溶系统液固平衡相图
二组分固液系统,C = 2 ,指定压力不变,
F’=C-P+1 =3 -P
P =1, F’=2,双变量系统 P =2, F’=1,单变量系统 P =3, F’=0,无变量系统
6.9.1 热分析法(thermal analysis)绘制低共熔相图
首先将二组分系统加热熔化,记录冷却过程中温度 随时间的变化曲线,即步冷曲线(cooling curve)或称 为冷却曲线。当系统有新相凝聚,放出相变热,步冷曲 线的斜率改变。F’=1,出现转折点;F’=0,出现水平 线段。据此在T-x图上标出对应的位置,得到低共熔T-x 图。
6.9.2 溶解度法 以 H2O - (NH4 )2 SO4 系统为例,在不同温度下测定 盐的溶解度,根据大量实验数据,绘制出水-盐 的T-x图。 图中有四个相区:
LAN以上,溶液单相区
LAB之内,冰+溶液两相区
NAC以上, (NH4 )2 SO4 (s) 和溶液两相区
BAC线以下,冰与 (NH4 )2 SO4 (s) 两相区
三条步冷曲线预示的相变化为:
(1) 从a点开始冷却,到b 点有组成为C的固溶体 (1)析出,继续冷却至d 以下,全部凝固为固溶体 (1)。
(2) 从e点开始冷却,依 次析出的物质为:
熔液L → L +(1)→(1)→(1)+(2)
(3) 从j点开始,;(1)→ (1)+(2)+L(组成为E) → (1)+(2)
3.作含40%Cd的步冷曲线 将含40%Cd,60%Bi的体系加热熔化,记录步冷
曲线如C所示。开始,温度下降均匀,到达E点时, Bi(s),Cd(s)同时析出,出现水平线段。
F’=C-P+1 =2-3+1 =0 当熔液全部凝固, 温度又继续下降,
实验二二组分固-液相图的绘制(共9张PPT)
邻-、对硝基(xiāo jī)氯苯的相图,步冷曲线
简单( jiǎndān)低共熔点固-液相图
步冷曲线示意图
第四页,共九页。
实验 步骤 (shíyàn)
1. 样品配制 在五个样品管中分别加入Sn100、70、42、20、0g,在分别加入Bi0、 30、58、80、100g。称量准确至0.1g。样品上分别加入少量石
Bi
260
280
(3)在计算机上运行“金属相图(步冷曲线)测绘程序”,设定连接串口,使计算机
能实时接受测量装置(zhuāngzhì)传来的数据。 (4)设定好步冷曲线的横、纵坐标,开始数据采集。
(5)按下测量装置上的“加热”键,程序开始绘制样品的温度-时间曲线。 (6)样品的温度到达设定的最高加热温度后,测量装置自动停止为加热装置供电。此时
第九页,共九页。
第二页,共九页。
实验 原理 (shíyàn)
测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使之 均匀冷却,每隔一定时间记录一次温度。表示温度与时间关系的曲线叫步冷曲线。当熔 融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一光滑的冷却曲线; 当体系内发生相变时,则因体系产生之相变热与自然冷却时体系放出的热量相抵偿,冷 却曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成合金的相变温度。 利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成, 纵轴上标出开始(kāishǐ)出现相变的温度,把这些点连接起来,就可绘出相图。
墨粉。
2. 绘制步冷曲线
(1)将样品管放入加热装置的加热孔中,在样品管中插入(chā rù) 热电偶,将加热装置的加热孔选择旋钮旋至要测的样品管所在 的位置。
二组分固态互溶系统液固平衡相图(共9张PPT)
(1)等边三角形表示法
F=C-P+2=5-P
当Fmin=0 时,Pmax=5,最多可以 有五相共存
当 Pmin=1时, Fmax=4,这四个
变量是T、P和组成x1和x2
★ 等边三角形的三个顶点分别代 表纯组分A、B、C
★ 三条边则代表A-B、B-C、C-A 三个两组分系统
• 11.1 三组分系统相律分析
• 11.2 三组分系统图解表示法 • 11.3 三组分系统一对液体部分互溶的恒温液-液相图
★ 水与醋酸、氯仿与醋酸以任意 比例互溶,水与氯仿部分互溶。 ★ 共轭溶液:氯仿层、水层 ★ d→C过程分析:
连结线---实线、非平行线 会溶点---不是最高点、不止一
个
10 ★
生d→成C化过合程物分的析二:1组-分--凝l 聚系统相2图---α
3---β
2 三组分系统图解表示法
(1)等边三角形表4示-法--α+l 5---β+l 6--- α+β
F=C-P+2=5-P
111三三组组分分系系统统相液律-液分S平析1衡S相2-图-- α+β+l
2 三组分系统图解表示法
F=C-P+2=5-P 11 三组分系统液-液平衡相图 11 三组分系统液-液平衡相图
M g 2 S i(s) 1 1 0 2 C M g 2 S i(l) NaCl2H2O(s) 0 .15 CmNaCl(s)(m1)l
§6.11 三组分系统液-液平衡相图
• 11.1 三组分系统相律分析
§6.9 二组分固态互溶系统液固平衡相图
• 9.1 固态完全互溶系统
• 当Fmin=0 时9,.Pm2ax固=5,态最多部可以分有五互相溶共存系统
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.4二组分系统的固~液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及气相而仅涉及固相和液相时,则体系常称为"凝聚相体系"或"固液体系"。
固体和液体的可压缩性甚小,一般除在高压下以外,压力对平衡性质的影响可忽略不计,故可将压力视为恒量。
由相律:因体系最少相数为Φ=1,故在恒压下二组分体系的最多自由度数f*=2,仅需用两个独立变量就足以完整地描述体系的状态。
由于常用变量为温度和组成,故在二组分固液体系中最常遇到的是T~x(温度~摩尔分数)或T~ω(温度~质量分数)图。
二组分固~液体系涉及范围相当广泛,最常遇到的是合金体系、水盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况。
这类体系在液相中可以互溶,而在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
进一步分类可归纳如下:研究固液体系最常用实验方法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验方法,然后再对各种类型相图作一简介。
(一)水盐体系相图与溶解度法1.相图剖析图5-27为根据硫酸铵在不同温度下于水中的溶解度实验数据绘制的水盐体系相图,这类构成相图的方法称为"溶解度法"。
纵坐标为温度t(℃),横坐标为硫酸铵质量分数(以ω表示)。
图中FE线是冰与盐溶液平衡共存的曲线,它表示水的凝固点随盐的加入而下降的规律,故又称为水的凝固点降低曲线。
ME线是硫酸铵与其饱和溶液平衡共存的曲线,它表示出硫酸铵的溶解度随温度变化的规律(在此例中盐溶解度随温度升高而增大),故称为硫酸铵的溶解度曲线。
一般盐的熔点甚高,大大超过其饱和溶液的沸点,所以ME不可向上任意延伸。
FE线和ME线上都满足Φ =2,f *=1,这意味温度和溶液浓度两者之中只有一个可以自由变动。
FE线与ME线交于E点,在此点上必然出现冰、盐和盐溶液三相共存。
当Φ=3 时,f*=0 ,表明体系的状态处于E点时,体系的温度和各相的组成均有固定不变的数值;在此例中,温度为 -18.3℃,相应的硫酸铵浓度为 39.8%。
换句话说,不管原先盐水溶液的组成如何,温度一旦降至 -18.3℃,体系就出现有冰(Q 点表示)、盐(I点表示)和盐溶液(E点表示)的三相平衡共存,连接同处此温度的三个相点构成水平线QEI,因同时析出冰、盐共晶体,故也称共晶线。
此线上各物系点(除两端点Q和I外)均保持三相共存,体系的温度及三个相的组成固定不变。
倘若从此类体系中取走热量,则会结晶出更多的冰和盐,而相点为E的溶液的量将逐渐减少直到消失。
溶液消失后体系中仅剩下冰和盐两固相,Φ=2,f*=1,温度可继续下降即体系将落入只存在冰和盐两个固相共存的双相区。
若从上向下看E点的温度是代表冰和盐一起自溶液中析出的温度,可称为"共析点"。
反之,若由上往下看E点温度是代表冰和盐能够共同熔化的最低温度,可称为"最低共熔点"。
溶液E凝成的共晶机械混合物,称为"共晶体"或"简单低共熔物"。
不同的水盐体系,其低共熔物的总组成以及最低共熔点各不相同,表5-7列举几种常见的水盐体系的有关数据。
表5-7 某些盐和水的最低共熔点及其组成FE线和EM线的上方区域是均匀的液相区,因f *=3-Φ=3-1=2,故只有同时指定温度和盐溶液浓度两个变量才能确定一个物系点。
FQE是冰~盐溶液两相共存区。
MEIJ是盐与饱和盐溶液两相共存区。
在受制约的两相区内Φ=2,f*=1 ,只能有一个自由度,即液相的组成随温度而变。
而QABI为一不受制约的区域,温度及总组成可以任意变动。
但因各相组成(纯态)固定,故常选温度为独立变量,即仍f*=1 。
为确定两相区内某物系点的两相点,可通过该物系点作水平线(即结线)交于两端点,例如MEIJ区内的物系点g的两个相点就是y和z,y为浓度约 44% 的饱和盐溶液相,z为固相纯盐,两相质量比应遵守杠杆规则,即〔例5〕试计算 200 克含 (NH4)SO4 60% 的溶液冷至10℃ 时(图5-27中的x 点),各相中各组分的质量?〔解〕按图5-27可知根据杠杆规则:从中解出固相(NH4)2SO4质量为液相质量为:∴液相中(NH4)2SO4的质量:液相中水的质量为:2.相图的应用水~盐体系的相图可用于盐的分离和提纯,帮助人们有效地选择用结晶法分离提纯盐类的最佳工艺条件,视具体情况可采取降温、蒸发浓缩或加热等各种不同的方法。
例如,欲自80℃,20%(NH4)2SO4溶液中不能得到纯净的 (NH4)2SO4晶体应采取哪些操作步骤?此物系点即图5-27中的P点,显然,若单纯降温,则进入FQE冰~液两相区,得到 (NH4)2SO4晶体。
因为继续降温,冰不断析出,溶液的组成往FE线下滑,至E点(-18.3℃)出现三相共存。
此时体系的温度及溶液的组成均恒定不变,直至全部液相变为固相为止,最终得到的只能是冰和固体 (NH4)2SO4的混合物。
由此可见,当溶液的组成落在ME线左边时,用单纯降温的方法是分离不出纯粹的盐。
唯一可取的途径是先将此溶液蒸发浓缩,使物系点P沿水平方向移至c点,此时溶液中 (NH4)2SO4含量约达 50%,冷却此溶液到K点(约50℃),溶液已成饱和。
若再降低温度,无疑将析出 (NH4)2SO4固体,当温度降至g点(10℃),体系中则有组成为y的溶液和纯盐共存。
若降至 -18.3℃ 则整个体系又成三相共存状态,析不出纯盐。
故最佳方案是先行浓缩而后降温,但温度又不能降至冰~盐共析点,同时,也不必将温度降得太低,因为根据相图分析,10℃ 时体系中固相所占的百分率与0℃ 时所占的百分率相差无几,所以一般以冷却至 10~20℃ 为宜。
根据上述原则,就可以利用相图确定 (NH4)2SO4的纯化条件;如c点代表粗盐的热溶液组成,先滤去杂质,然后降温,由冷至50℃ 即K点时,便有纯 (NH4)2SO4晶体析出,继续降温,结晶不断增加,至10℃ 时,饱和液浓度相当于y点。
至此,可将晶体与母液分开,并将母液重新加热到H点,再溶入粗 (NH4)2SO4,适当补充些水分,物系点又自H移到C,然后又过滤、降温、结晶、分离、加热、溶入粗盐……如此使溶液的相点沿HCgyH路程循环多次,从而达到粗盐的提纯精制目的。
循环次数多少,视母液中杂质浓缩程度对结晶纯度的影响而定。
水~盐相图具有低共熔点特征,可用来创造科学实验上的低温条件。
例如,只要把冰和食盐(NaCl)混合,当有少许冰熔化成水,又有盐溶入,则三相共存,溶液的浓度将向最低共熔物的组成E逼近,同时体系自发地通过冰的熔化耗热而降低温度直至达到最低共熔点。
此后,只要冰和盐存在,且三相共存,则此体系就保持最低共熔点温度(-21.1℃)恒定不变。
(二)合金体系相图与"热分析"原理现以二组分合金体系为例说明相图的另一种实验方法"热分析"的原理。
对于象锑~铝,铋~镉等合金体系及两种化合物(如 KCl~AgCl,C6H6~CHBr3)体系,都可以组成形成低共熔物的固相互不相溶体系,以Sb~Pb体系为例,其相图如图5-28所示,ME、NE线分别为金属 Sb(即 A )和金属 Pb(即 B )熔体的凝固点曲线,由其斜率可知,各自的熔点都随着第二种组分的增加而降低。
由式(4-155):其中x指某组分的摩尔数,Δfus H m指纯组分时的溶解焓变,T f*指纯组分熔点,T f为某组分当其摩尔分数为x时的熔点。
图中E点是两条熔点曲线的交点,在此点上,固态 Sb 和 Pb 以及溶液三态共存,常称为金属 Sb 和 Pb 的"最低共熔点"。
最低共熔点温度为246℃,其质量分数为含 Pb88%,含 Sb12%,此溶液所析出之固体混合物称为"共熔合金"(普遍情况下称为"最低共熔物")。
显然,MQE为金属溶液和固体金属 Sb 的两相平衡区。
NEI为溶液和固体金属 Pb 的两相平衡区。
水平线QEI则为纯固体 Sb、纯固体 Pb 和组成E的熔液平衡共存的三相线,此线下面则是纯 Sb 和纯 Pb 的两相区。
此类相图能提供制备低熔点合金的方法;如在水银中加入铊(Tl),能使水银凝固点(-38.9℃)降低,但通过相图可明断最低只能降到 -59℃,若想进一步降低,则需采用更多组分的体系。
其他如保险丝,焊锡等低熔点合金均可参照这类相图的实验数据配制。
表5-8列出一些二组分简单最低共熔型相图体系中低共熔物的熔点与组成(摩尔分数)。
表5-8 某些简单低共熔型相图体系热分析法研究固液平衡体系相图主要是依据体系发生相变时伴随着相变潜热的吸收或放出,导致体系冷却速度的变化,来研究相变过程的规律。
由实验数据所绘制的温度(T)与时间(t)的曲线,称为“步冷曲线”,由步冷曲线斜率的变化可提供相的产生、消失、和达成相平衡的信息。
下面以Sb~Pb 合金体系为例,讨论绘制步冷曲线及由此确定相应的温度~组成图的方法。
首先配好一定组成的混合物,如含 Pb 量 0.0%、40%、60%、88%、95%、100%等六个样品,加热使其全部熔解,然后让其缓慢地自行冷却,分别记录每个样品温度随时间变化的数据作出如图5-29(a)的六条步冷曲线。
其中样品①是纯 Sb 属单组分。
其步冷曲线可分析如下:由恒压下凝聚体系相律表达式可得f *=C-Φ+2-1=1-Φ+1=2-Φ。
可见,温度若在凝固点以上,则Φ=1,f *=1,体系温度可变化而不影响其单相特征,若仅有降温可得出曲线上部的平滑段。
当降温至 Sb 的凝固点(631℃)将有固相析出,固液两相平衡存在Φ=2,f*=0 ,此时温度应维持不变,这就出现如曲线上所示的平台线段。
直到液体全部凝固,体系又变成单一固相,其自由度f *=1,温度可以变化,冷却过程可用曲线下部的平滑段表示。
同理,曲线⑥为 Pb 单组分步冷曲线,形状与曲线①类似,而差别在于其凝固点较低(327℃),出现平台段较迟。
曲线②为含 Pb40% 的二组分体系,C =2,由相律,高温时为熔融液相,温度和组成在一定范围内均可变化而不影响其单相特征。
当组成恒定时,温度仍可均匀下降,如曲线的上部平滑线。
当温度降至 H 点时,熔液中的金属 Sb 达饱和而析出固体 Sb,出现了固~液两相平衡,此时,温度仍可不断下降,而平衡液相含Pb量逐增浓度,另固体析出所放出凝固潜热,可部分抵偿环境吸走的热,于是冷却速度较前缓慢,出现斜率较小的中间平滑线Ha,步冷线上拐点(或转折点)H 的出现意味着新相的产生。
