由苯胺设计合成对硝基苯胺
对硝基苯胺的制备及纯化

对硝基苯胺的制备段东斑(武汉大学化学与分子科学学院湖北武汉430072)目录一、实验目的-------------------------------------------------------3二、实验原理-------------------------------------------------------32.1合成-----------------------------------------------------------32.2产品的分离与纯化-------------------------------------------4三、主要试剂及产物的物理常数--------------------------------5四、主要试剂规格、用量-----------------------------------------6五、实验装置图-----------------------------------------------------6六、实验步骤与现象-----------------------------------------------66.1苯胺的乙酰化--------------------------------------------------76.2乙酰苯胺的硝化---------------------------------------------76.3硝基乙酰苯胺的水解-----------------------------------------76.4柱层析与薄层层析------------------------------------------86.5蒸馏-----------------------------------------------------------8七、产品的表征与纯度分析-------------------------------------97.1熔点的测定--------------------------------------------------97.2薄层色谱(TLC)---------------------------------------------107.3核磁共振氢谱1HNMR -------------------------------------10八、产率计算及分析---------------------------------------------11九、讨论------------------------------------------------------------12十、其他合成方法------------------------------------------------13十一、参考文献---------------------------------------------------14一、实验目的1.以苯胺为初始原料,通过连续合成得到对硝基苯胺。
对硝基苯胺的合成
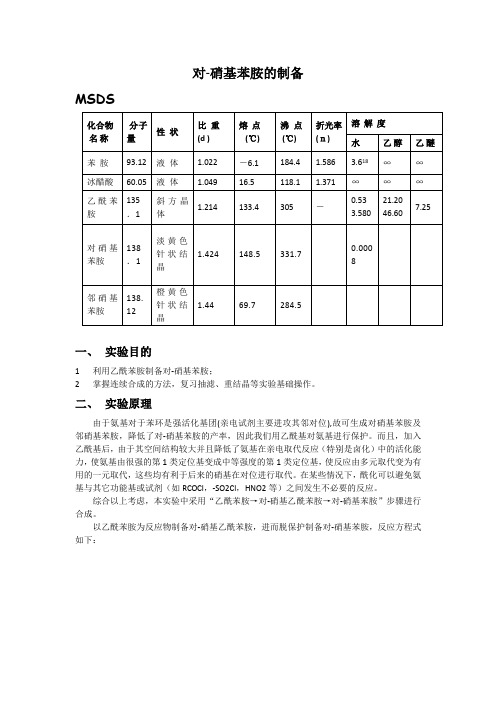
对-硝基苯胺的制备MSDS化合物名称分子量性状比重(d )熔点(℃)沸点(℃)折光率(n)溶解度水乙醇乙醚苯胺93.12 液体 1.022 -6.1 184.4 1.586 3.618∞∞冰醋酸60.05 液体 1.049 16.5 118.1 1.371 ∞∞∞乙酰苯胺135.1斜方晶体1.214 133.4 305 -0.533.58021.2046.607.25对硝基苯胺138.1淡黄色针状结晶1.424 148.5 331.70.0008邻硝基苯胺138.12橙黄色针状结晶1.44 69.7 284.5一、实验目的1利用乙酰苯胺制备对-硝基苯胺;2掌握连续合成的方法,复习抽滤、重结晶等实验基础操作。
二、实验原理由于氨基对于苯环是强活化基团(亲电试剂主要进攻其邻对位),故可生成对硝基苯胺及邻硝基苯胺,降低了对-硝基苯胺的产率,因此我们用乙酰基对氨基进行保护。
而且,加入乙酰基后,由于其空间结构较大并且降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使氨基由很强的第1类定位基变成中等强度的第1类定位基,使反应由多元取代变为有用的一元取代,这些均有利于后来的硝基在对位进行取代。
在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。
综合以上考虑,本实验中采用“乙酰苯胺→对-硝基乙酰苯胺→对-硝基苯胺”步骤进行合成。
以乙酰苯胺为反应物制备对-硝基乙酰苯胺,进而脱保护制备对-硝基苯胺,反应方程式如下:NHCOCH3+HNO3H2SO4HOAcNHCOCH3NHCOCH3+NO2NO2NHCOCH3NHCOCH3+NO2NO2NH2NH2+NO2NO2+H2O KOHEtOH+CH3COOK在制备对-硝基乙酰苯胺时,用醋酸做溶剂同时可以防止乙酰苯胺或对-硝基乙酰苯胺水解。
对于产物来说,酸或碱都能够促使其水解,为了将粗产物中残留的酸中和掉而又不过量,实验中使用磷酸二氢钠,其中和结果是一种pH接近中性的缓冲溶液。
苯胺如何合成对硝基苯胺方程

苯胺如何合成对硝基苯胺方程对硝基苯胺是一种重要的有机化合物,它具有广泛的应用领域,如配位化学、染料合成、药物合成等。
对硝基苯胺的合成有多种方法,下面将以亲核芳香取代反应为例,介绍几种常见的合成方法。
1. 邻硝基硝化法(Sulfonation-Nitration Method)邻硝基硝化法是一种常用的合成对硝基苯胺的方法,它包括苯胺的磺酸化和硝化两个步骤。
具体合成步骤如下:(1)苯胺的磺酸化:将苯胺与浓硫酸反应,生成对苯胺磺酸。
反应方程式如下:C6H5NH2+H2SO4→C6H5NH3+SO4^-(2)硝化:将对苯胺磺酸与硝酸反应,生成对硝基苯胺。
反应方程式如下:C6H5NH3+SO4^-+HNO3→C6H4(NO2)NH3+SO4^-2. 硝基化还原法(Nitration-Reduction Method)硝基化还原法是另一种常见的合成对硝基苯胺的方法。
该方法通过苯胺的硝基化和还原两个步骤来合成对硝基苯胺。
具体合成步骤如下:(1)硝基化:将苯胺与浓硝酸反应,生成对硝基苯胺。
反应方程式如下:C6H5NH2+HNO3→C6H4(NO2)NH2+H2O(2)还原:可以用亚硝酸盐(如亚硝酸钠)或亚硫酸盐(如亚硫酸氢钠)将对硝基苯胺进行还原,生成对硝基苯胺。
反应方程式如下:C6H4(NO2)NH2+2NaNO2+H2O→C6H4(NH2)NO2+2NaOHC6H4(NO2)NH2+NaHSO3+HCl→C6H4(NH2)NO2+NaCl+H2O3. 氨基氧化法(Amination-Oxidation Method)氨基氧化法是一种基于氨基化反应与氧化反应的合成对硝基苯胺的方法。
具体合成步骤如下:(1)氨基化:将苯胺与氨气反应,生成苯胺氨基化物。
反应方程式如下:C6H5NH2+NH3→C6H5NH2NH2(2)氧化:将苯胺氨基化物与过氧化氢或过硫酸盐反应,生成对硝基苯胺。
反应方程式如下:C6H5NH2NH2+H2O2→C6H4(NH2)NO2+2H2OC6H5NH2NH2+Na2S2O8→C6H4(NH2)NO2+Na2SO4+H2SO4这些是常见的合成对硝基苯胺的方法,但值得注意的是,其中部分反应条件较为苛刻,需要在应用时根据实际情况进行调整。
设计实验-对硝基苯胺的制备-zh娜

由乙酰苯胺制备对硝基苯胺武汉大学化学与分子科学学院化学基地班摘要芳环上的氨基易被氧化,通常不能用苯胺直接制备对硝基苯胺,而是先将其酰化最后在水解从而保护酰基。
实验中,我们直接用已经酰化的乙酰苯胺来制备对硝基苯胺,实验过程可分为三步:乙酰苯胺的硝化、对硝基乙酰苯胺的酸性水解、对硝基苯胺和邻硝基苯胺的分离。
并且,为了探讨纯化邻硝基苯胺的最佳方法,我们采取了先重结晶再水解、先水解再重结晶、先水解再水蒸气蒸馏三种方法的到产品,并对产品进行测定熔点及TLC分析来对对应方法进行评价。
关键词对硝基苯胺硝化水解熔点TLC分析对硝基苯胺是重要的染料中间体,同时,还可以用作分析试剂,检测空气中的氮。
[1]工业生产对硝基苯胺。
可采用乙酰苯胺硝化、水解的方法,也可用对硝基氯苯氨解的方法。
实验室中由乙酰苯胺制备对硝基苯胺有两步:一是硝化,此过程中通过控制温度主要生成对硝基乙酰苯胺,也会生成邻硝基乙酰苯胺;二是水解,生成对硝基苯胺(同时可能含有邻硝基苯胺),使保护基——乙酰基水解,恢复氨基的本来面目,水解在酸性和碱性条件下均可进行。
由于产物中不可避免的含有邻硝基苯胺,故需要进行第三步——邻硝基苯胺和对硝基苯胺的分离。
通常的分离方法有重结晶、水蒸气蒸馏、柱层析。
[2][3][4]该实验中,控制温度在5摄氏度以下来进行硝化,使产物中有尽可能多的对位产物;由于柱层析需要大量有机溶剂淋洗,不适合整个实验室大规模的实验,故只进行了重结晶和水蒸气蒸馏两种方法进行分离和比较。
1. 实验部分1.1对硝基乙酰苯胺的制备在50mL锥形瓶内放入5g乙酰苯胺和5mL冰醋酸。
用冷水冷却,一边摇动锥形瓶,一边慢慢地加入10mL浓硫酸。
乙酰苯胺逐渐溶解。
将所得溶液放在冰盐浴中冷却到0~2℃。
一边摇动锥形瓶,一边用滴管慢慢地滴加混酸(2.2mL浓硝酸+1.4mL浓硫酸),保持反应温度不超过5℃。
混酸加完后,从冰盐浴中取出锥形瓶,在室温下放置30min,并时时搅拌,使反应趋向完全。
实验八_对硝基苯胺的制备(修改2)

宜超过25℃。
硝化反应中注意控制温度并充分搅拌。 水解时要彻底。
思考题
硝化反应为什么要控制在低温?
碳酸氢钠洗涤的目的是什么? 酸催化水解有什么优点?
放映结束
3. 滴完混酸后,温度保持5℃以下, 继续搅拌0.5个小时 。 4. 将反应物倒入盛有100ml水的烧杯 中,析出固体。 注解:
1)滴加混酸大约需20min。 2)搅拌下缓慢的将反应物倒出,不要太快, 否则可能结成大块,影响产物质量。
5. 抽滤,先用30ml的冰水洗涤三次,充 分挤压后,再用10ml 3%的碳酸氢钠溶液 洗涤三次。得到产品。
实验步骤
(一)对硝基乙酰苯胺的制备:
1. 在盛有15ml冷浓硫酸的100ml烧杯中, 加入4g干燥乙酰苯胺并溶解。 注解: 1)硫酸冷却后再向其中加入乙酰苯胺, 目的是防止其在大于25℃时部分水解, 2)充分搅拌下分批加入乙酰苯胺,使其 完全溶解,大约需20-30min 。
2.
冰盐浴冷却到5℃以下。然后滴加混酸, 控制反应温度不要超过5℃ 。
注解: 1)乙酰苯胺与混酸在5℃以下作用,主要产物为对 硝基乙酰苯胺,随着温度升高,邻位产物增加, 40℃以上作用则生成25%的邻硝基乙酰苯胺。 2)混酸应提前配置好,冷却后使用。 3)冰块越碎越好,让小烧杯尽可能多的浸在碎冰中。 4)整个过程必须保证充分搅拌,使之反应充分,而 且使烧杯中温度均匀。
NO2
副反应:
O NH C CH3 H2O H2SO 4 + NH3 + CH3CO2H
O NH C CH3 H2SO 4 HNO3
O NH C CH3
以苯胺为起始原料合成对溴苯胺 有机实验实验报告最终版剖析

2012级化教专业《有机化学实验》设计性实验以苯胺为起始原料合成对溴苯胺摘要:对溴苯胺(BrC6H4NH2 )是非常重要的有机化工原料,其合成过程要经历硝化、还原、保护、溴代、去保护等多个步骤。
本实验由硝基苯合成对溴苯胺,形成了中间体苯胺、乙酰苯胺、对溴乙酰苯胺,过程包括硝基的还原、氨基的保护与去保护、芳烃卤化,采用了水蒸气蒸馏、简单蒸馏、重结晶、减压过滤、分馏、测定熔点等方法。
通过控制温度、酸碱度、反应时间等合成目标产物,获得较高的生产率。
关键词:对溴苯胺;硝基苯;有机合成The Synthesis of 4 - Bromoanilines Abstract: 4 - Bromoanilines is an important organic chemical material,its synthetic process includes nitration, reduction,protection of function group, bromination and de - protection of protected groups,etc.In this experiment, 4 - Bromoanilines was synthesized by initial material Nitrobenzene,its intermediates including Aniline,Acetanilide,and p - Bromoacetanilide.Besides,several methods are used, such as wet distillation ,reduced pressure distillation,recrystal , and fractionation, etc. We tried to synthesize 4 - Bromoanilines and improve productivity by controlling temperature, pH and reacting time. Keywords: 4 - Bromoanilines; Nitrobenzene; Synthesis;一、前言对溴苯胺(BrC6H4NH2 )也被称为4 - 溴苯胺或对氨基溴化苯,是非常重要的有机化工原料。
有机实验习题答案

有机实验习题答案实验1 常压蒸馏1.为什么蒸馏瓶所盛液体的量一般不超过容积的2/3,也不少于1/3(多于2/3,易溅出;少于1/3,相对多的蒸汽残留在烧瓶中,收率低)2.温度计水银球应处于怎样的位置才能准确测定液体的沸点,画出示意图;水银球位置的高低对温度读数有什么影响(参见图2-2,温度计水银球处于气液平衡的位置。
位置高,水银球不易充分被馏出液润湿,沸点偏低,位置低,直接感受热源的温度,结果偏高。
)3.为什么蒸馏时最好控制馏出液的速度为1~2 滴/秒(保持气液平衡)4.如果加热后发现未加沸石,应如何处理如果因故中途停止蒸馏,重新蒸馏时,应注意什么(停止加热,稍冷,再补加沸石。
重新蒸馏时,一定要补加沸石,原来的沸石表面的空隙已充满液体而失效)5.如果某液体具有恒定的沸点,能否认为该液体一定是纯净的物质你提纯得到的乙醇是纯净物吗(不一定,可能是恒沸物;蒸馏得到的乙醇不是纯净物,是恒沸物,参见附录5)6.在蒸馏过程中,火大小不变,为什么蒸了一段时间后,温度计的读数会突然下降这意味着什么(瓶中的蒸气量不够,意味着应停止蒸馏或者某一较低沸点的组分已蒸完。
)7.蒸馏低沸点或易燃液体时,应如何防止着火(严禁用明火加热。
收集瓶中的蒸气应用橡皮管引入桌下、水槽或室外。
参见P50 图2-3)实验2 水蒸气蒸馏1.应用水蒸气蒸馏的化合物必须具有哪些条件水蒸气蒸馏适用哪些情况(参见“二)2.指出下列各组混合物能否采用水蒸气蒸馏法进行分离。
为什么(1)乙二醇和水;(2)对二氯苯和水(对二氯苯和水可以用水蒸气蒸馏分开)3.为什么水蒸气蒸馏温度总是低于100℃(因当混合物中各组分的蒸气压总和等于外界大气压时,混合物开始沸腾)4.简述水蒸气蒸馏操作程序。
(当气从T形管冲出时,先通冷凝水,再将螺旋夹G夹紧,使水蒸气通入D,参见图2-7;结束时,先打开螺旋夹G使体系和大气相通,方可停止加热)。
5.如何判断水蒸气蒸馏可以结束(当蒸馏液澄清透明时,一般即可停止蒸馏。
对硝基苯胺的制备及纯化

对硝基苯胺的制备段东斑(武汉大学化学与分子科学学院湖北武汉430072)目录一、实验目的-------------------------------------------------------3二、实验原理-------------------------------------------------------32.1合成-----------------------------------------------------------32.2产品的分离与纯化-------------------------------------------4三、主要试剂及产物的物理常数--------------------------------5四、主要试剂规格、用量-----------------------------------------6五、实验装置图-----------------------------------------------------6六、实验步骤与现象-----------------------------------------------66.1苯胺的乙酰化--------------------------------------------------76.2乙酰苯胺的硝化---------------------------------------------76.3硝基乙酰苯胺的水解-----------------------------------------76.4柱层析与薄层层析------------------------------------------86.5蒸馏-----------------------------------------------------------8七、产品的表征与纯度分析-------------------------------------97.1熔点的测定--------------------------------------------------97.2薄层色谱(TLC)---------------------------------------------107.3核磁共振氢谱1HNMR -------------------------------------10八、产率计算及分析---------------------------------------------11九、讨论------------------------------------------------------------12十、其他合成方法------------------------------------------------13十一、参考文献---------------------------------------------------14一、实验目的1.以苯胺为初始原料,通过连续合成得到对硝基苯胺。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由苯胺设计合成对硝基苯胺(实验报告)
第一部分:由苯胺合成乙酰苯胺
一、实验目的:①掌握苯胺以酰化反应的原理和实验操作
②掌握重结晶的方法和操作
③熟悉固体样品熔点的测定方法
二、实验原理:
NH2
+
CH3O
O
O
CH3
OH
O
CH3NH C
O
CH3
+OH
O
CH3
苯胺可以与乙酰氯、乙酸酐和冰醋酸作用,生成乙酰苯胺。
苯胺和乙酸酐反应是实验室常用的方法,且得到的产物纯度高,产率高,用乙酸做乙酰化试剂反应比较平缓,虽然反应周期长,但乙酸的价格相对较便宜,且比较容易获得。
三、主要药品及其用量
苯胺(NH2
,5.0mol),冰醋酸(CH3COOH,10ml),乙酸酐((CH3CO)
2
O,6ml),冰水
四、实验装置图
反应装
置静置冷却装
置抽滤装
置五、实验步骤及现象
理论产量为:7.41克
产率为:(5.89/7.41)×100%=79.79%
由苯胺制备乙酰苯胺的反应,其转化率本不可能达到百分之百,因为该反应为可逆反应。
同时,在反应过程中,由于温度的控制差异,反应过程中可能存在某些副反应,也会降低乙酰苯胺的产率。
实验最后,对乙酰苯胺粗产品进行重结晶的过程,也会损失部分的乙酰苯胺。
七、思考题
1.实验过程中为什么要温和回流15分钟?
答:因为溶解时温度不宜超过25摄氏度,防止生成的乙酰苯胺水解,同时,在此温度下完
全溶解需要15分钟。
2.为什么实验过程中需要再加5毫升并且煮沸?
答:目的是使乙酸酐水解获得乙酸,提供足量的酰化试剂,提高苯胺的转化率,使反应更加充分。
3.为什么要将反应液倒入30毫升冰水中? 答:根据乙酰苯胺在不同温度时水中溶解度的差异,将反应获得的产品乙酰苯胺从反应体系中分离出来。
第二部分:由乙酰苯胺合成对硝基苯胺
一、实验目的:①了解芳香族硝基化合物的制备方法,尤其是由芳胺制备芳香族硝基化合物
的方法
②掌握邻硝基苯胺和对硝基苯胺的分离方法
二、实验原理
硝化反应
H N O
CH 3
HNO 324
H N
NO 2
C
O CH 3
+
H N
C
O CH 3
NO 2
水解反应
H N
NO 2
C
O CH 3
+
H N
C
O CH 3
NO 2
1.H SO ,H O
2.NaOH,H 2O
NH 2NO 2
NH 2
O 2N
+
三、主要药品及其用量 乙酰苯胺(2.4克),冰醋酸(4毫升),浓硫酸(5毫升),混酸(2.0毫升浓硫酸,1.5毫升浓硝酸),40%的硫酸(10毫升),20%的氢氧化钠溶液 四、实验装置图
硝化反应实验装
置水解反应装
置
六、产品与产率
理论产量:2.45克
产率为:(1.01/2.45)×100%=41.22%
乙酰苯胺经硝化、水解制得对硝基苯胺和邻硝基苯胺,这两步都不是完全反应,此为产率达不到100%的主要原因。
其次,由于乙酰苯胺中滴加混酸的速率有差异,可能导致一小部分产品碳化。
同时,在多次抽滤洗涤滤渣的过程中,多少仍旧会有一部分产品的损失。
七、思考题
1.催化剂的用量一般为多少?
答:一般催化剂的量占1%-5%(摩尔比),如果底物翻倍,催化剂应该要翻倍的,催化剂的量主要跟催化剂的催化活性有关系,如果是贵金属催化剂,比如钌,钯,铑等催化剂,一般用量为0.5%,若是铜,镍,铬之类的,为3%-10%。
第三部分:水蒸气蒸馏和薄层层析
一、实验目的:①掌握水蒸气蒸馏的基本操作和原理
②掌握薄层层析的基本操作和原理
③学会用水蒸气蒸馏和薄层层析分离对硝基苯胺和邻硝基苯胺的原理和操作
二、实验原理
水蒸气蒸馏的原理:水蒸气蒸馏是分离和纯化有机物的常用方法之一,尤其是在反应产物中有大量树脂状或焦油状杂质的情况下,效果较一般的=蒸馏或重结晶为好。
使用这种方法时,被提纯物质应该具有下列条件:不溶或几乎不溶于水,在沸腾下长时间与水共存而不起化学变化;在100摄氏度左右时必须具有一定的蒸汽压,一般不小于1.33kpa。
当与水不相混溶的物质与水一起存在时,它们的蒸汽压力P根据道尔顿分压定律,应为水蒸气压PA和此物质蒸汽压PB之和,即P=PA+PB。
P随温度升高而增大,当温度升高到使P等于外界大气压时,该体系开始沸腾,这时的温度为该体系的沸点,此沸点必须较体系中任一组分的沸点都低。
蒸馏时,混合物沸点保持不变,直至该物质全部随水蒸出,温度才会上升至水的沸点。
蒸出的是水和与水不混溶的物质,很容易分离,从而达到纯化的目的。
薄层层析的原理:薄层色谱分为薄层吸附色谱和薄层分配色谱两种。
薄层色谱是将吸附剂均匀的涂在玻璃板(或某些高分子薄膜)上作为固定相,经干燥、活化后点上待分离的样品,用适当极性的有机溶剂作为展开剂(即流动相)。
当展开剂在吸附剂上展开时,由于样品中各组分对吸附剂吸附能力不同,发生了无数次吸附和解吸附的过程,吸附能力弱的部分(极性较弱的)随流动相迅速向前移动,吸附能力强的组分(极性较强的)移动慢。
利用各组分在展开剂中溶解能力的不同,最终将各组分分开。
如果各组分本身有颜色,则薄层板干燥后会出现一系列高低不同的斑点,如果本身无色,则可用各种显色方法使之显色,以确定斑点的位置。
三、主要药品及其用量
对硝基苯胺粗产品(0.4克),展开剂(石油醚:乙酸乙酯=2:1),二氯甲烷(60毫升),无水硫酸镁
四、实验装置图
水蒸气蒸馏:
萃取装置
薄层层析:
五、实验步骤及现象
第四部分:柱层析
一、实验目的:①了解柱层析的基本原理
②掌握柱层析的基本实验操作
③用柱层析分离对硝基苯胺和邻硝基苯胺,得到其溶液 二、实验原理 柱层析原理:本实验中使用的柱层析属于吸附柱层析。
将吸附剂均匀致密地填充在层析柱中,使其呈一圆柱状,为固定相;将待分离的样品制成溶液样,从柱顶加入,混合物各组分即吸附在吸附剂颗粒表面。
选取合适的溶剂自柱顶向下均匀淋洗,对样品中的各组分的分子,溶解度大的易分配进入流动相,而极性小者易被其他分子替换。
同种分子各方面相同,下行速率也应相同,不同分子下行速率不同,即在柱上拉开距离。
用不同的接收容器分别接收各组分的溶液,蒸除溶剂即可得到纯品。
三、主要药品及其用量
装柱的药品:棉花,海砂,硅胶粉
石油醚,乙酸乙酯,展开剂(石油醚:乙酸乙酯=2:1) 四、实验装置图
层璃棉
砂体支持剂(硅胶粉)砂
剂
五、实验步骤
柱层析分离对硝基苯胺和邻硝基苯胺
称取0.05克对硝基苯胺,准备进行以下操作: ①湿法装柱
取一根层析柱和一根长玻璃棒(长度大于层析柱的深度,一端带有橡皮套),在层析柱的活塞处涂上真空脂。
将层析柱固定在铁夹上,使其呈竖直状态,关闭活塞。
通过漏斗向柱中加入少量溶剂(展开剂),观察活塞处是否漏液,在管口下端放一锥形瓶,开启活塞,观察液体能否顺利流出。
否则需要检查真空脂是否涂得足够,或是否有真空脂堵塞活塞上的小孔。
关闭活塞,向柱中加入一半溶剂,放入一小片棉花,用玻璃棒将其压入到底部并挤出气泡,将活塞开到最大,确保液体能以每秒不少于一滴的速率流出。
向小烧杯中加入20克硅胶粉,加入少量溶剂搅成悬浮液,迅速加入到层析柱中。
打开活塞,用锥形瓶承接液体,继续加入悬浮液,用少量溶剂洗涤烧杯和漏斗内壁,使所有硅胶进入到层析柱中,并使硅胶顶部仍有1cm 左右的液体,用玻璃棒一端的橡皮轻敲柱外壁,使硅胶紧密。
②洗脱和收集
取若干支试管,依次编号。
打开活塞使液体留下,开始放出的液体为无色,可不用试管收集,待柱中的黄色部分移动到接近柱底时,开始用试管承接淋洗液,每只试管承接液体的体积可不固定,但需依据柱中颜色判断是否需要更换承接淋洗液的试管。
收集时,必须时刻保持吸附剂上端溶剂的量,保持其溶剂始终高于吸附剂,以免气泡被带入吸附剂中(随着溶剂不断从吸附剂上端通过吸附剂流出层析柱,柱中逐渐形成两层黄色色带,黄色色带下面的颜色较浅,且色带会随溶剂向下移动)。
六、实验过程图片。
