紫外吸收光谱法测定双组分混合物
紫外可见吸收光谱分析法

作用是放大信号并以适当的方式指示或记录。 直流检流计、电位调零装置、数字显示及自动记录装置等。
03:04:37
二、分光光度计的类型
1.单光束
经单色器分光后的一束平行光,轮流通过参比溶液和样 品溶液,以进行吸光度的测定。结构简单,操作方便,维修 容易,适用于常规分析。一般不能作全波段光谱扫描。
03:04:37
2. 紫外-可见吸收光谱的产生
当分子吸收外界的辐射能量(电磁辐射)时,会发生运 动状态的变化,亦即发生能级的跃迁,其中含电子能级、振 动能级和转动能级的跃迁。
h E2 E1 E Ee Ev Er
E h
c
hc
E
分子吸收光谱: 用一连续波的电磁辐射以波长大小顺序分别照射分子,并
流动测量池 两面透光
4.检测器
检测器的作用 检测器是一种光电转换元件,是检测单色光通过溶液被吸收 后透射光的强度,并把这种光信号转变为电信号的装置。 对检测器的要求 检测器应在测量的光谱范围内具有高的灵敏度;对辐射能量 的响应快、线性关系好、线性范围宽;对不同波长的辐射响 应性能相同且可靠;有好的稳定性和低的噪音水平等。 检测器有光电池、光电管和光电倍增管等。
2.双光束
光源发出光经单色器分光后,分解为强度相等的两束 光,一束通过参比池,另一束通过样品池,双光束分光光 度计一般都能自动记录吸收光谱曲线。由于两束光同时分 别通过参比池和样品池,因而能自动消除光源强度变化所 引起的误差。
03:04:37
03:04:37
3.双波长
适用多组分混合物、混浊试样(如生物组织液)分析, 以及存在背景干扰或共存组分吸收干扰的情况下分析,还 能进行化学反应动力学研究。
波谱原理实验讲义

实验一分光光度法同时测定维生素C和维生素E一、实验目的学习在紫外光谱区同时测定双组分体系——维生素C和维生素E。
二、实验原理维生素C(抗坏血酸)和维生素E(α-生育酚)在食品中能起抗氧化作用,即他们在一定时间内能防止油脂变性。
两者结合在一起比单独使用的效果更佳,因为它们在抗氧化剂性能方面是“协同的”。
因此,它们作为一种有用的组合试剂用于各种食品中。
维生素C是水溶性的,维生素E是脂溶性的,但是他们都溶于无水乙醇,因此能在同一溶液中,用与可见分光光度法测定双组分相同的原理,在紫外区测定它们。
三、仪器与试剂1、仪器紫外-可见分光光度计、石英吸收池一对、25mL容量瓶7只、5mL吸量管两只。
2、试剂维生素C:称0.132g抗坏血酸,溶于无水乙醇中,并用无水乙醇定容于1000mL (7.50×10-4mol/L);维生素E:称0.488g α-生育酚,溶于无水乙醇中,并用无水乙醇定容于1000mL1.13×10-3mol/L);无水乙醇四、实验内容与操作步骤1、配制溶液(1)配制维生素C系列标准溶液:分别取抗坏血酸贮备液2.00 、3.00 、4.00mL 于3只25mL容量瓶中,并用无水乙醇稀释至刻度,摇匀。
(2)配制维生素E系列标准溶液:分别取α-生育酚贮备液2.00 、3.00 、4.00mL于3只25mL容量瓶中,并用无水乙醇稀释至刻度,摇匀。
(3)试样的制备:取未知液5.00 mL 于25mL容量瓶中,并用无水乙醇稀释至刻度,摇匀。
2、绘制吸收曲线以无水乙醇为参比,在波长320~220nm范围内测绘抗坏血酸和α-生育酚的吸收光谱,并确定抗坏血酸和α-生育酚的最大吸收波长,分别为λ1、λ2。
3、绘制标准曲线以无水乙醇为参比,在波长λ1、λ2处分别测定维生素C的3个标准溶液的吸光度;以无水乙醇为参比,在波长λ1、λ2处分别测定维生素E的3个标准溶液的吸光度。
4、未知液的测定以无水乙醇为参比,在波长λ1、λ2处分别测定未知液的吸光度。
紫外可见吸收光谱分析

(2) 介质不均匀性引起的偏离 朗伯-比尔定律在均匀、非散射时可成立,当介质不均匀,或有胶体、乳浊、悬浮体存
在时,入射光除了被吸收外,还有反射、折射损失,故所测A值比实际吸收要大许多,导 致偏离比尔定律。
引起工作曲线弯曲的原因还有一些,如:溶质的性质变化、操作不当等等。
§ 2.3 影响显色反应的若干因素 (一) 吸光光度法对显色反应的要求
2、分子吸收光谱
①电子光谱 在多原子分子中,分子轨道中有许多电子能级,平时各电子都尽先进入低能级,处于基态。当
有光波照射这些分子时,轨道中的电子会吸收光波中的某些波长的光,使这束光中缺少某些波长的 光。电子本身将从低能级跃迁到高能级上。
象这样的情况下,被吸收的光往往波长较短,在紫外和可见光范围。本章主要讨论这一部分内 容。
红色), 1﹕3(pH 8~11.5 黄色,最稳定)三种不同颜色的络合物生成。
3、温度的影响:一般在室温.有些需加热. 4、显色时间的影响
5、溶剂的影响:可提高显色反应的灵敏度. 6、共存离子的影响:
§ 2.4 光度测量误差和测量条件的选择
一、 仪器测量误差
在吸光光度分析中,除了各种化学条件所引起的误差外,仪器测量不准确也是误差的主要来源。 任何光度计都有一定的测量误差,这种误差可能来源于光电池不灵敏、光电流测量不准和光源不稳
§ 2 光度分析法的基本原理
一、光度分析法的特点 1、适用范围:常用于测定试样中1%~10-3 %的微量组分,甚至可测定低至10-4 %~10-5 %的痕量组份。目 前,随着仪器和方法的改进,有的已达10-9 %。一般情况下,相对误差为2~5 %,这在微量分析中已是十 分精确的了。 2、特点:灵敏、快速、准确、简便。
cF2e
05第5章紫外可见吸收光谱法

氘较高能级;宏观体现在透射光的强度变弱。
吸收光谱的分类
物质分子内部三种运动形式: (1)电子相对于原子核的运动; (2)原子核在其平衡位置附近的相对振动; (3)分子本身绕其重心的转动。
分子具有三种不同能级:电子能级、振动能级和转动能级 三种能级都是量子化的,且各自具有相应的能量。 分子的内能:电子能量Ee 、振动能量Ev 、转动能量Er
σ电子、π电子、n电子。
s*
p*
K
R
E
E,B
n
p
s
分子轨道理论:成键轨道—反键轨道。
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反
键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
n→π* < π→π* < n→σ* < σ→σ*
1).σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量才能发
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
最大吸收波长λmax,表示谱带位置,是分子
特征常数,可推测物质的结构信息。 整个谱带的形状决定于物质性质,反映分
子内部能级分布状况,是物质定性的依据。
光强参数
1) : 透光率 T I I0
2 ) : 吸光度 A lg I lg T I0
生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区;
吸收波长λ<200 nm;
பைடு நூலகம்
例:甲烷的λmax为125nm , 乙烷λmax为135nm。
只能被真空紫外分光光度计检测到;
特点:作为溶剂使用;
s*
p*
E K
R
E,B
A卷答案:二、简答题:1.什么是分光光度中的吸收曲线?制作吸收

A卷答案:二、简答题:1.什么是分光光度中的吸收曲线?制作吸收曲线的目的是什么?让不同波长的光通过待测物,经待测物吸收后,测量其不同波长的光的吸收程度,以吸收度为纵轴,以波长为横轴作图即位吸收曲线。
根据吸收曲线的峰强度,位置及数目可以研究分子结构。
2.为什么原子吸收光谱法只适用于定量分析而不用于定性分析?原子吸收光谱法是基于物质产生的原子蒸气中待测元素的基态自由原子对特定谱线的吸收强度来进行元素定量分析的方法。
当适当波长的光辐射通过基态原子蒸气时,如果与光辐射频率相应的光量子能量等于原子由基态跃迁到激发态所需的能量,则会引起原子对辐射的吸收,产生原子吸收光谱。
各种元素的原子结构和能级具有特征性,因此各元素的原子吸收光谱是具有一系列特征波长的吸收谱线。
其中原子由基态跃迁至第一激发态时产生的吸收线称为共振线。
由基态跃迁至第一激发态的跃迁最容易发生,因此对于大多数元素来说,共振线是元素的最灵敏线。
在原子吸收光谱法中,就是利用处于基态的待测原子蒸气对光源辐射的共振线的吸收来进行定量分析的。
原子吸收光谱法是测定样品的基态原子对光源发出的特征谱线的吸收强度,主要用于元素的定量分析。
3.根据速率方程,请简述引起GC中峰扩张的因素及其解决方法。
1956 年,荷兰化学工程师 van Deemter 提出了色谱过程动力学速率理论:吸收了塔板理论中的板高 H 概念,考虑了组分在两相间的扩散和传质过程,从而给出了 van Deemter 方程:u 为流动相线速度;A ,B ,C 为常数,其中A —分别表示涡流扩散系数;B —分子扩散系数;C —传质阻力系数(包括液相和固相传质阻力系数)。
该式从动力学角度很好地解释了影响板高(柱效)的各种因素!任何减少方程右边三项数值的方法,都可降低 H ,从而提高柱效。
1 )涡流扩散项 (A)在填充柱中,由于受到固定相颗粒的阻碍,组份在迁移过程中随流动相不断改变方向,形成紊乱的“涡流”:从图中可见,因填充物颗粒大小及填充的不均匀性——同一组分运行路线长短不同——流出时间不同——峰形展宽。
紫外可见吸收光谱法

-C-C- 如:乙烷: max=135nm C-H 如: 甲烷: max= 125nm
2) n * 跃迁
分子中未共用n电子跃迁到* 轨道
化合物种类:凡含有n电子的杂原子的饱和化合物
特点:跃迁所需要的能量较高
位置:远紫外光区和近紫外光区
150-250nm
ε=100 ~ 1000 L·cm-1 ·mol-1
Mn+-Lb- M(n+1)+-L(b+1)- (hν) [Fe3+-SCN-]2+ [Fe2+-SCN]2+ (这就是配合物λmax=490nm为血红色原因)
金属配合物的电荷转移吸收光谱,有三种类型:
1. 电子从配体到金属离子: 相当于金属的还原; 2. 电子从金属离子到配体; 产生这种跃迁的必要条件是金属离子容易被氧化
白炽光源: 热辐射光源:可见光区,340-2 500nm,影响因素:灯电压
如 钨丝灯和卤钨灯; 气体放电光源: 气体放电发光光源:紫外光
否相同。 在进行紫外光谱法分析时,必须正确选择溶剂。
三、紫外-可见分光光度计
光源 λ1、 λ2、 λ3、 …、 λn
分光系统
λmax
调制放大 记录系统→显示A
检测系统 光→电
I0→样品池→ It
紫外-可见分光光度计主要组成部件
光源
分光系统
样品池
检测系统
记录系统
1、光源
1.光源:提供入射光的元件。
3.电子从金属到金属
配合物中含有两种不同氧化态的金属时,电子可在其间转移,
这类配合物有很深的颜色,如普鲁士蓝 (磷、砷)钼蓝 H8 [SiMo2O5(Mo2O7)5 ]
紫外吸收光谱法分析应用

例如: H2O 配位场 < NH3 配位场
Cu 2+ — 水合离子
794 nm 浅蓝色
紫外-可见分子吸收光谱法 (UV-VIS spectrometry)
第一节
概述
一、分子吸收光谱分析的发展概况
•可见-紫外-红外 •目视比色-光电比色-分光光度 •光声光谱-长光程吸收光谱-传感器
二、分子吸收光谱的分类和特征
紫外-可见 红外 远红外
电子光谱 振动光谱 转动光谱
Ee =1 - 20 eV 0.05-1 0.005-0.05
如八面体场、四面体场、正方平面配位场等使能级分裂不
等。
d-d 电子跃迁
绝大多数过渡金属离子都具有未充满的 d 轨道,
按照晶体场理论,当它们在溶液中与水或其它配体生成
配合物时,受配体配位场的影响,原来能量相同的 d轨
道发生能级分裂,产生 d-d 电子跃迁。
配体配位场越强,d 轨道分裂能越大,吸收波长
2、无机化合物的吸收光谱
某些无机金属离子也会产生紫外-可见吸收。如含d电子的 过渡金属离子会产生配位体场吸收带。依据配位场理论, 无配位场存在时,
d xy d xz d yz
d z2
d x2y2
能量简并;当过渡金属离子处于配位体形成的负电场中时,
5个简并的d轨道会分裂成能量不同的轨道。不同配位体场,
电磁辐射与物质的相互作用
物质具有能量,是诱电体。物质与光的作用可看成是光 子对能量的授受,即 hn=E1-E0,该原理广泛应用于光谱 解析。 电磁辐射与物质的作用本质是物质吸收光能后发生跃迁。 跃迁是指物质吸收光能后自身能量的改变。 因这种改变是量子化的,故称为跃迁。 不同波长的光,能量不同,跃迁形式也不同,因此有不 同的光谱分析法。 谱图的三要素 一般进行光谱分析时,要同时注意谱图的位置(能量)、 强度(跃迁几率)、波宽这三个要素,才能得出正确的结 论。
分光光度法测定双组分混合物
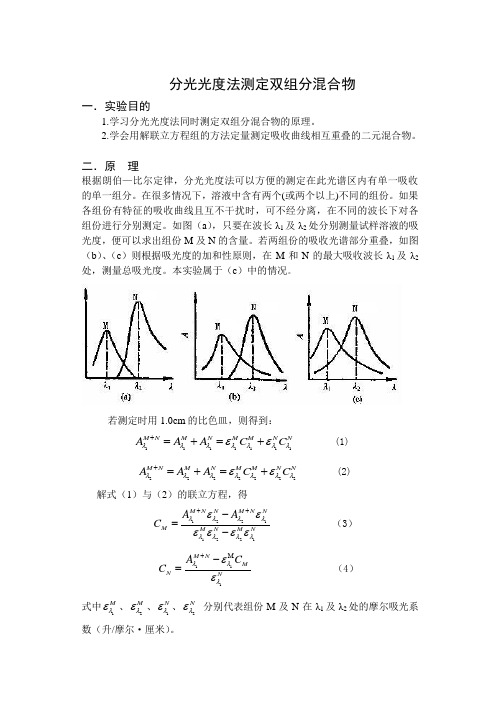
分光光度法测定双组分混合物一.实验目的1.学习分光光度法同时测定双组分混合物的原理。
2.学会用解联立方程组的方法定量测定吸收曲线相互重叠的二元混合物。
二.原 理根据朗伯—比尔定律,分光光度法可以方便的测定在此光谱区内有单一吸收的单一组分。
在很多情况下,溶液中含有两个(或两个以上)不同的组份。
如果各组份有特征的吸收曲线且互不干扰时,可不经分离,在不同的波长下对各组份进行分别测定。
如图(a ),只要在波长λ1及λ2处分别测量试样溶液的吸光度,便可以求出组份M 及N 的含量。
若两组份的吸收光谱部分重叠,如图(b )、(c )则根据吸光度的加和性原则,在M 和N 的最大吸收波长λ1及λ2处,测量总吸光度。
本实验属于(c )中的情况。
若测定时用1.0cm 的比色皿,则得到:1111111M N M N M M N N A A A C C λλλλλλλεε+=+=+ (1) 2222222M N M N M M N N A A A C C λλλλλλλεε+=+=+ (2) 解式(1)与(2)的联立方程,得12211221M N N M N N M M N M N A A C λλλλλλλλεεεεεε++-=- (3)111M M N M N N A C C λλλεε+-=(4) 式中1M λε、2M λε、1N λε、2Nλε 分别代表组份M 及N 在λ1及λ2处的摩尔吸光系数(升/摩尔·厘米)。
本实验测定Co 2+和Cr 3+的混合物。
分别配制Co 2+和Cr 3+的系列标准溶液,在λ1和λ2处分别测定Co 2+和Cr 3+系列标准溶液的吸光度,标准曲线的斜率即为Co 2+和Cr 3+在λ1和λ2处的摩尔吸光系数。
三.仪器及试剂UV-9100紫外-可见分光光度计;1.0cm 比色皿;10mL 比色管;刻度吸管; Co(NO 3)2·6H 2O 、Cr(NO 3)3·9H 2O 均为分析纯四.实验步骤1.溶液配制分别配制0.350mol/L Co(NO 3)2和0.100mol/L 的Cr(NO 3)3 储备液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫外吸收光谱法测定双组分混合物
一、实验目的
1、 掌握单波长双光束紫外可见分光光度计的使用。
2、 学会用解联立方程组的方法,定量测定吸收曲线相互重叠的二元混合物。
二、方法原理
根据朗伯—比尔定律,用紫外--可见分光光度法很容易定量测定在此光谱区有吸收的单一成分。
由两种组分组成的混合物中,若彼此都不影响另一种物质的光吸收性质,可根据相互间光谱重叠的程度,采用相对的方法来进行定量测定。
如:当两组分吸收峰部分重叠时,选择适当的波长,仍可按测定单一组分的方法处理;当两组分吸收峰大部分重叠时(见图1),则宜采用解联立方程组或双波长法等方法进行测定。
图1 高锰酸钾、重铬酸钾标准溶液吸收曲线
解联立方程组的方法是以朗伯--比尔定律及吸光度的加和性为基础,同时测定吸收光谱曲线相互重叠的二元组分的一种方法。
从图2可看出,混合组分在λ1处的吸收等于A 组分和B 组分分别在λ1处的吸光度之和A
A+B
λ1
,即:
A
A+B λ1
= κA λ1bc A + κB λ1bc B
同理,混合组分在λ2处吸光度之和A
A+B λ2
应为:
A
A+B λ2 = κA
λ2bc A
+ κB
λ2bc B
若先用A 、B 组分的标样,分别测得A 、B 两组分在λ1和λ2处的摩尔吸收系数κA λ1、κA λ2和κB
λ
1
、κB
λ2;当测得未知试样在λ1和λ2的吸光度A
A+B λ1和A
A+B λ2后,解下列二元一次方程组:
A
A+B
λ1
= κA
λ1 b c A
+ κB
λ1 b c B
A A+Bλ2 = κAλ2 b c A + κBλ2 b c B
即可求得A、B两组分各自的浓度c A和c B。
c A= (A A+Bλ1 ·κBλ2 - A A+Bλ2 ·κBλ1) / ( κAλ1 ·κBλ2 - κAλ2 ·κBλ1)
c B= (A A+Bλ1 - κAλ1 · c A) /κBλ1
一般来说,为了提高检测的灵敏度,λ1和λ2宜分别选择在A、B两组分最大吸收峰处或其附近。
图2高锰酸钾、重铬酸钾标准溶液及混合溶液的吸收曲线
三、仪器和试剂
1.紫外可见分光光度计(UV/VIS 916型);1cm比色皿;
2.容量瓶、移液管、烧杯;
3.0.0200mol/L KMnO4标准溶液(其中含H2SO4 0.5mol/L,含KIO4 2g/L);
4.0.0200mol/L K2Cr2O7标准溶液(其中含H2SO4 0.5mol/L,含KIO4 2g/L)。
四、实验步骤
1.分别吸取一定量的0.0200mol/L K2Cr2O7标准溶液,稀释配制成浓度为0.0008 mol/L、0.0016 mol/L、0.0024 mol/L、0.0032 mol/L、0.0040 mol/L的系列标准溶液。
编号1~5。
2.分别吸取一定量的0.0200mol/L KMnO4标准溶液,稀释配制成浓度为0.0008 mol/L、0.0016 mol/L、0.0024 mol/L、0.0032 mol/L、0.0040 mol/L的系列标准溶液。
编号6~10。
3.按照分光光度计操作规程,开启仪器。
4.绘制标准溶液在375~625nm围的吸收光谱图,找到最大吸收波长(λ1和λ2)。
并测定它们在最大吸收波长(λ1和λ2)处的吸光度。
操作步骤:
4.1 波长扫描(定性)
A.用去离子水作为空白,做基线;
B.放入KMnO4标准溶液,在375~625nm围进行扫描,得到吸收光谱曲线1,在光谱图上标出最大吸收波长(λ1=545nm);
C.放入K2Cr2O7标准溶液,在375~625nm围进行扫描,得到吸收光谱曲线2,在光谱图上标出最大吸收波长(λ2=440nm);
D.放入试样溶液,在375~625nm围进行扫描,得到吸收光谱曲线3;
E.将标准样品及试样的吸收曲线(1~3)叠在一图上打印出来。
见图2。
4.2 固定波长(定量)
F.输入波长545和440,并以逗号隔开,用去离子水作为空白,调零;
G.分别放入待测溶液,读取吸光度的值并填入下表。
表1 标准溶液及混合液在两个波长处的吸光度(ABS)
五、数据处理
1.由标准溶液测定的吸光度,分别求得KMnO4和K2Cr2O7在545nm和440nm处的摩尔吸收系数κA545、κA440和κB545、κB440。
2.由试样测定的吸光度A A+B545和A A+B440,列出二元一次方程组,求得c A和c B的浓度。
六、问题讨论
1、今有吸收光谱曲线相互重叠的三元体系混合物,能否用解联立方程组的方法测定它们各自的含量?
2、设计一个用双波长法测定本实验容的实验方案。
