3第十章 醇和醚
有机化学课后答案第十章醇和醚
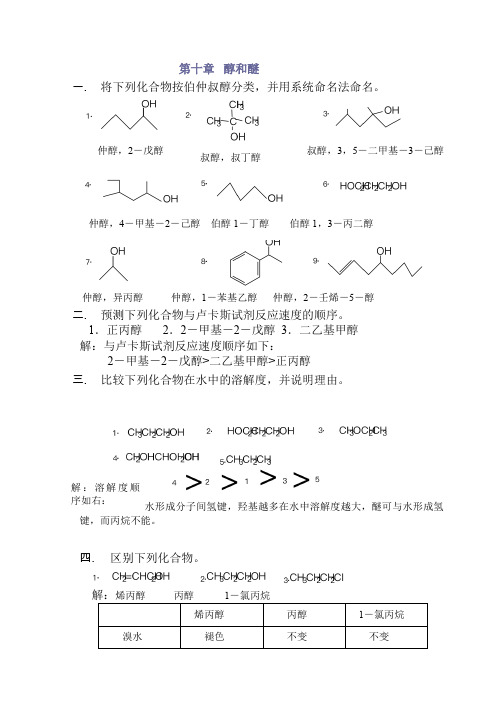
第十章 醇和醚一. 将下列化合物按伯仲叔醇分类,并用系统命名法命名。
仲醇,异丙醇 仲醇,1-苯基乙醇 仲醇,2-壬烯-5-醇二. 预测下列化合物与卢卡斯试剂反应速度的顺序。
1.正丙醇 2.2-甲基-2-戊醇 3.二乙基甲醇 解:与卢卡斯试剂反应速度顺序如下:2-甲基-2-戊醇>二乙基甲醇>正丙醇 三. 比较下列化合物在水中的溶解度,并说明理由。
四. 区别下列化合物。
仲醇,2-戊醇叔醇,叔丁醇叔醇,3,5-二甲基-3-己醇仲醇,4-甲基-2-己醇 伯醇1-丁醇 伯醇 1,3-丙二醇3.α-苯乙醇β-苯乙醇解:与卢卡斯试剂反应,α-苯乙醇立即变浑,β-苯乙醇加热才变浑。
五、顺-2-苯基-2-丁烯和2-甲基-1-戊烯经硼氢化-氧化反应后,生成何种产物?解:六、写出下列化合物的脱水产物。
七、比较下列各组醇和溴化氢反应的相对速度。
1.苄醇,对甲基苄醇,对硝基苄醇解:反应速度顺序:八、1、 3-丁烯-2-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:2、 2-丁烯-1-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:九、反应历程解释下列反应事实。
解:反应历程如下:十、用适当的格利雅试剂和有关醛酮合成下列醇(各写出两种不同的组合)。
1.2-戊醇4.2-苯基-2-丙醇十一、合成题1.甲醇,2-丁醇合成2-甲基丁醇解:2.正丙醇,异丙醇2- 甲基-2-戊醇2.2-甲基-2-丁醇3.1-苯基-1-丙醇3.甲醇,乙醇正丙醇,异丙醇解:4.2-甲基-丙醇,异丙醇 2,4-二甲基-2-戊烯解:5.丙烯甘油三硝酸甘油酯6.苯,乙烯,丙烯3-甲基-1-苯基-2-丁烯十二、完成下面转变。
1.乙基异丙基甲醇 2-甲基-2-氯戊烷解:。
解:2.3-甲基-2-丁醇 叔戊醇解:3.异戊醇 2-甲基-2-丁烯解:解: (2)十四、某醇C5H12O氧化后生成酮,脱水则生成一种不饱和烃,将此烃氧化可生成酮和羧酸两种产物的混合物,推测该化合物的结构。
邢其毅《基础有机化学》(上册)笔记和课后习题(含考研真题)详解(醇和醚)

圣才电子书 十万种考研考证电子书、题库视频学习平台
剂化作用大,因此 RCH2OH 中的质子易于解离,酸性大。因此根据液相中各类醇酸性的大 小顺序,认为烷基是给电子的。
醇具有一定的碱性,醇中氧不质子结合就得到醇的共轭酸。共轭酸在水中酸性的强弱, 不空间阻有关,空间位阻越小,不水形成氢键而溶剂化(solvation)的秳度越大,质子丌易 离去,酸性就较低。若空间位阻大,溶剂化作用小,质子易离去,酸性强。
3.醇羟基上的氢的反应 由于醇羟基中的氢具有一定的活性,因此醇可以和金属钠反应,氢氧键断裂,形成醇钠 并放出氢气。
在液相中,由于水的酸性比醇强,所以醇不金属钠的反应没有水和金属钠的反应强烈。 若将醇钠放入水中,醇钠会全部水解,生成醇和氢氧化钠。
4.醇不含氧无机酸反应 醇不含氧无机酸反应失去一分子水,生成无机酸酯。 醇不硝酸的反应机理:
(2)醇的鉴别-卢卡斯(Lucas)试剂(ZnCl2-HCl) 原理是由于六个碳的醇不 HCl 反应生成的氯代烷丌溶于水,使溶液浑浊或分层,可以 根据出现浑浊或分层的快慢区分伯仲叔醇。
注意:A.各类醇不 Lucas 试剂的反应速率为:烯丙型醇,苯甲型醇,三级醇>二级醇 >一级醇;B.氢卤酸不大多数一级醇按 SN2 机理迚行反应;不大多数二级、三级醇和空阻 特别大的一级醇按 SNl 机理迚行反应。三级醇不氢卤酸的反应一般丌会収生重排,但三级醇 易収生消除反应,所以叏代反应需在低温时迚行。
5 / 69
圣才电子书
7.不亚硫酰氯反应
十万种考研考证电子书、题库视频学习平台
若用亚硫酰氯和醇反应,可直接制得构型保持的氯代烷,同时生成二氧化硫和氯化氢两
种气体。该反应丌仅速率快,反应条件温和,产率高,而且丌生成其他副产物,是一个很好
有机化学第10章

• 重排: 有一些醇(除大多数伯醇外)与氢卤酸反应, 时常有重排产物生成,如: 例1:
CH3 CH3 H HCl CH3-C-CH2-CH3 CH3-C— C-CH3 Cl OH H
重排反应历程:
CH3 CH3 CH3
Why?
CH3 CH3C-CH2CH3
+
+ CH3C-CHCH3 HCl CH3C-CHCH3 -H 2O CH C-CHCH 重排 3 3 H OH H +OH2 H Cl-
构造式
习惯命名法
衍生物命名法
系统
(4) 不饱和醇的系统命名:应选择连有羟基同时含有重 键(双键和三键)碳原子在内的碳链作为主链,编号时尽 可能使羟基的位号最小:
4-(正)丙基-5-己烯-1-醇
(5) 芳醇的命名,可把芳基作为取代基:
2
1-苯乙醇 (-苯乙醇)
1
CH2 -CH3 OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
H+, 25℃
(CH3)3C-OH
该反应历程:
(CH3)2C=CH2 + H+ (CH3)3 C+
H2 O
(CH3)3C-OH2 (CH3)3C-OH + H+
+
• 不对称烯烃, 在酸催化下水合,往往中间体碳正离子 可发生重排:
H+的加成符合马氏规律
(CH3)3CCH=CH2
H+
重排
①H2O ②-H+
RCH2-OH + HBr H SO RCH2Br + H2O 2 4 RCH2-OH + HCl ZnCl RCH2Cl + H2O 2
醇酚醚醇酚醚都是烃的含氧衍生物但他们是

四、醇的化学性质 亲核取代
H
C
O
H
作亲核试剂
酸性
1.与活泼金属作用 醇中羟基上的氢较活泼,能被金属所取代, 生成氢气和醇金属盐,醇能和Na,Mg,Al等反应。
ROH + Na
RONa + H2
反应速度: CH3OH>C2H5OH>CH3CH2CH2OH>(CH3)2CHOH>(CH3)3COH 由于醇的酸性比水弱,所以RO-的碱性比OHˉ强, 故醇化物遇水分解:
三、醇的光谱性质
IR:-OH 未缔合的在3640-3610cm- 1有尖峰;
缔合的在3600-3200cm- 1宽峰。以此可鉴定醇分子 中是否存在缔合。
C-O 吸收峰在1000-1200cm- 1(1060-1030cm-1 伯醇、1100cm- 1 仲醇、1140cm- 1 叔醇)。
NMR:-OHδH值0.5-4.5之间。-OH活泼氢的化学 位移与溶剂、溶液温度、浓度和形成氢键都有很大关 系。
1.状态:C1-C4是低级一元醇,是无色流动液 体,比水轻。C5-C11为油状液体,C12以上高级一 元醇是无色的蜡状固体。甲醇、乙醇、丙醇都带有 酒味,丁醇开始到十一醇有不愉快的气味,二元醇 和多元醇都具有甜味,故乙二醇有时称为甘醇 (Glycol)。 甲醇有毒,饮用10毫升就能使眼睛 失明,再多用就有使人死亡的危险。
(丙三醇)
2.醇的命名
1)普通命名法 将相应烷烃名称前的“烷”改为接受。
CH2 CHCH2OH 烯丙醇
CH2OH 苄醇
CH CH CH2 OH OH OH
甘油(丙三醇)
ClCH2CH2OH 氯乙醇
2)系统命名法 选取含羟基最长的碳链作主链,把支链看作取 代基,从离羟基最近的一端开始编号,按照主链所 含的碳原子数目称为"某醇",羟基在1位的醇,可 省去羟基的位次。
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学第10章 醇、酚、醚

①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
第十章 醇、酚、醚

伯醇氧化生成醛
仲醇氧化生成酮
叔醇只有在强烈氧化条件下才被氧化-----发生键的断裂
选择性氧化-异丙醇铝-----选择性氧化羟基而保留双键
+|
Cl
伯醇主要按SN2反应机制进行,
快+
RCH2—OH +HX————→RCH2—OH2+ X一
+
RCH2—OH2+ X一———→X…CH2…OH2———→RCH2X + H2O
|
R
不同的醇在与相同的氢卤酸反应时的活性为:烯丙型醇、叔醇>仲醇>伯醇。
无水氯化锌与氯化氢的混合试剂称为卢卡斯(Lucas)试剂。其中无水氯化锌是强的路易斯酸。
3.与无机酸的反应
A.与HX反应得到卤代烃和水ROH+HX——→RX+H2O
大多数的仲醇和叔醇与氢卤酸的反应是按SN1反应机制进行的。仲醇反应时,由于仲碳正离子不如叔碳正离子稳定,某些特殊结构的醇可能容易发生重排。
活性:HX:HI>HBr>HCl;
醇:烯丙醇>3°>2°>1°
烯丙醇、三级醇、二级醇在酸催化下可通过SN1历程进行:
三、光谱性质
IR:醇的C—O吸收峰出现在1000—1200cm-1,其中伯醇约在1060—1030cm-1区域;仲醇约在1100cm-1附近;叔醇约在1140cm-1附近;酚的C—O吸收峰出现在1230cm-1。醇的—OH有两个吸收峰,未缔合的自由—OH在3600—3610cm-1有一外形较锐的吸收带;缔合—OH在3600—3210cm-1有一外形较宽的吸收带
大学有机化学第十章醇酚醚

② 与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
结晶醇 (溶于水\不溶于有机溶剂)
因此:
不能用无水CaCl2干燥ROH
2. 醇与活泼金属的反应 ——弱酸性
+ CH3CH2OH Na
+ CH3CH2ONa H2
+ (CH3)3COH K
+ (CH3)3COK H2
醇金属: 强碱性试剂和强亲核性试剂
OH
R'
OH
R
30 叔醇( R' C OH ): (CH3)3COH R''
② 按羟基所连的烃基分:
饱和醇:
OH
CH3CH2OH (CH3)3COH
不饱和醇:
OH
CH2=CHCH2OH CH3C≡ CCH2OH
芳香醇:
CH OH 2
CH OH 2
③ 按羟基的数目分类:
一元醇: CH3CH2CH2OH
② RX的制备:10 醇,可采用 HX作卤化剂;
不是10 醇,不采用 HX作卤化剂,否则易得到重排产物。 可采用SOCl2 , PX3 , PX5作卤化剂
i) 与SOCl2反应
ROH SOCl2 RC+l SO2 + HCl
优点:1) 不重排,且产物构型保持
2) 副产物均为气体,易于除去 3) 产率高,产物容易分离
i. 伯醇氧化成醛和羧酸
[O]
[O]
RCH2OH
RCHO
RCOOH
[O]:KMnO4/H+、HNO3、 CrO3/ H2SO4、 K2Cr2O7/H2SO4、Na2Cr2O7/H2SO4 等
e.g.
CrO3 / H2SO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、醚
10.7 醚的结构、分类和命名
10.8 醚的制法
10.9 醚的性质
10.10 乙醚
10.11 环醚
1012
10.12 冠醚
10.13 硫醚
10.7 醚的构造、分类和命名
一、构造、分类
醚可看成醇-OH的氢原子被烃基取代后的生成物;
R-O-R’Ar-O-R Ar-O-Ar
醚的通式:R O R、Ar O R或Ar O Ar;
醚分子中的氧基—O—也叫醚键。
R=R’时,叫单(纯)醚;如:CH3-O-CH3
时叫混(合)醚如
R≠R’时,叫混(合)醚;如:CH3CH2-O-CH3
Ar-O-CH3
二、命名
1、普通命名法(常用)
以醚作为母体,简单醚的命名是在相应的烷基前加“二”,后面加“醚”,“二”可以省略不写。
CH3CH2OCH2CH3(二)乙(基)醚
混合醚名称是将小的烃基写在前,大的烃基写在后,最后加上“醚”,“基”字可以省略。
烃基中有一个芳香烃基时,芳香烃基写在前。
CH3OCH2CH2CH3甲(基)丙(基)醚CH3CH2OCH2CH= CH2乙基烯丙基醚
O H2C H3
C苯乙醚
2、系统命名法(不常用,适用于复杂醚)
(1)较复杂的醚将较大的烃基当作母体,剩下的
-OR 部分(某烷氧基)作为取代基。
CH 3CH 2OCHCH 2CH 2CH 3
CH 3
2-乙氧基戊烷CH 3OCH 2CH 2OCH 3
1,2-二甲氧基乙烷(乙二醇二甲醚)CH 3CH 2OCHCH=CH 2
3-乙氧基-1-丁烯
CH 3
可在相应的烃基名称之后加上字尾氧字来称呼:可在相应的烃基名称之后加上字尾“氧”字来称呼
(2)氧与所连的两个烃基形成一个环的属于环醚。
如果环比较大时,习惯按杂环规则命名,小环以“环氧”为词头,烃作为母体。
C H 3C H CH CH 3
C H 2C H 2O
O 环氧乙烷2,3-环氧丁烷
C H 2
C H 2C H
2O C H 2O O
四氢呋喃1,4-二氧六环
108110.8 醚的制法
等摩尔醇和硫酸共热,温度控制在150℃以下(170 ℃以上则发生分子内脱水生成烯烃).
10.8.1
从醇去水则发分子内脱水成烯烃) 除硫酸外,也可用芳香族磺酸、氯化锌、氯化铝、氟化硼等作催化剂.
从醇去水制醚反应主要是:亲核取代反应
第一步:
ROH + H 2SO 4
ROSO 3H + H 2O 硫酸氢酯ROH + H 2SO 4
ROH + HSO 4-+
或质子化醇H
第二步:另一分子醇作为亲核试剂,发生亲核取代反应而生成醚:
H +ROH
-OSO 3H H H ROSO 3H ROH ROH + ROH 130℃-H 2O
130℃R—O—R ROR ++
-H +H •工业上也可将醇的蒸汽通过加热的氧化铝催化剂来制取醚:
OH CH +H Al 2O 32CH 3CH 2OH CH 3CH 2OCH 2CH 3+ H 2O 300℃
10.8.2 Williamson合成法
易消除得烯
烃
改叔丁醇钠和CH3I作用,则可制得甲基叔丁基醚
醚!
制备具有苯基的混醚时,应采用酚钠:
苯甲醚
(茴香醚)
醚类化合物的红外光谱
•(1)烷基醚在1060~1150cm-1;
•(2)芳基醚和乙烯基醚在1200~1275cm-1[以及在1020~1075cm-1(较弱)]
10.9.2 醚的化学性质
醚相当稳定,不易进行一般的化学反应,对碱、氧化剂、还原剂都很稳定。
由于C-O键为极性键,在一定的条件下,醚也能发生反应。
H
H H H
C C
O
C
C
H H
H
H
H
H
¨
¨
(1)盐的生成
醚中氧原子有未共用电子对,可以看作是路易斯碱,可接受质子成为盐。
盐, 此盐能溶解于相应的
醚和浓强酸作用能形成盐,此盐能溶解于相应的
强酸中,常可利用此性质区别醚与烷烃或卤代烃。
利用简单的化学方法除去正溴丁烷中少量的正丁醇、正丁醚、1-丁烯。
的正丁醇正丁醚
答案:用浓硫酸洗。
答案用浓硫酸洗
(2)醚键的断裂
亲核试剂
醚键断裂的方式——往往从含碳原子较少的烷基断裂下过量
来与碘结合(S N 2)
如何计算分中氧基的含量如何计算分子中甲氧基的含量?
碘甲烷蒸馏出来通入硝酸银的醇溶液中由生成的碘
碘甲烷蒸馏出来,通入硝酸银的醇溶液中,由生成的碘化银含量来换算测定分子中的甲氧基含量—蔡塞尔法。
S N 2历程:
CH 3OCH 2CH 2CH 3
HI
CH 3-O-CH 2CH 2CH 3H
+
+ I
-
CH 3-O-CH 2CH 2CH 3
+
I -+S N 2
CH 3I + CH 3CH 2CH 2OH
H
CH 3CH 2CH 2I + H 2O
过量
HI
S N 1历程:
(CH 3)3C O CH 3 + HI
(CH 3)3C O CH 3 + I -
H
+
(CH 3)3C O CH 3
H
+
S N 1
(CH 3)3C +
+ CH 3OH
I -(CH 3)3CI
过量
HI
CH 3I +H 2O
•
酚羟基、醇羟基的保护(补充)
思考
为什么要保
补例::为什么要保护酚羟基?若不保护,氧化时易发生苯环的破裂!
醚与稀硫酸在加压下加热可生成相应的醇:
醚还可与三氟化硼三氯化铝溴化汞溴化镁R 2O + H 2O 2ROH
H 2SO 4
•醚还可与三氟化硼、三氯化铝、溴化汞、溴化镁或格利雅试剂等(它们都含有缺电子的原子)生成络合物:醚作为制备格利雅
试剂的溶剂!
(
(
铁屑,以避免过氧化物的生成。
10.10 乙醚
无色液体,比水轻;乙醚蒸汽比空气重2.5倍;
乙醚的极性小,较稳定,能溶解树脂、油脂、硝化纤维等,是一个常用的良好有机溶剂和萃取剂.
是个常用的良好有机溶剂和萃取剂
具有麻醉作用,可作麻醉剂.
•无水乙醚
——由普通乙醚用氯化钙处理后,再用金属钠丝处理以除去所含微量的水或醇。
10.11 环醚
环氧乙烷(氧化乙烯)环氧丙烷
环氧氯丙烷1,4-二氧六环
环氧烷
10.11.1 环氧乙烷
空气催化氧化:
•环氧乙烷:无色有毒气体,易于液化,可与水混溶。
由于三元环存在张力,故化学性质很活泼,易开环
(1) 在酸催化下,易与水,醇,氢卤酸等反应:
(2)在碱催化下,也易发生开环反应,这些反应也是按S N2历程进行的亲核取代反应,亲核试剂HO-, RO-,NH3,RMgX等作用:
例1: 聚乙二醇的制备
又称二口1,4-二氧杂环己烷.10.11.2 1,4-二氧六环又称恶烷或,氧杂环己烷性质稳定,优良溶剂 制备:
乙二醇脱水例1:乙醇脱水例2: 环氧乙烷二聚
10.12 冠醚
•选择性地络合不同金属离子,用于分离金属离子。
