全自动配液系统PQ方案终版
全自动配液系统PQ附录F
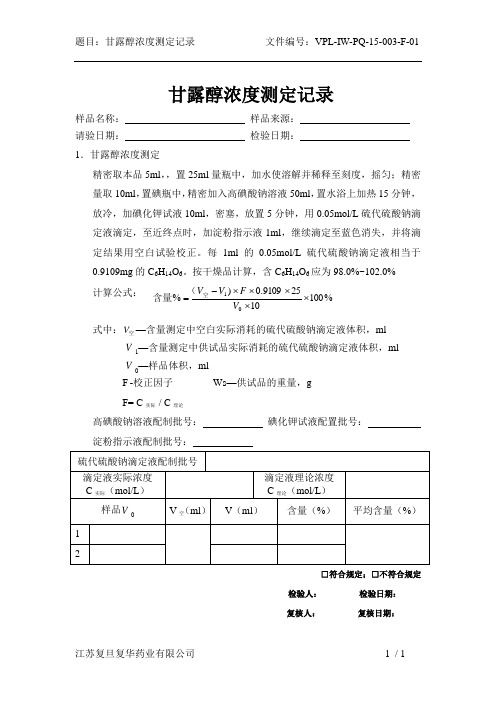
题目:甘露醇浓度测定记录 文件编号:VPL-IW-PQ-15-003-F-01
江苏复旦复华药业有限公司 1 / 1 甘露醇浓度测定记录
样品名称: 样品来源: 请验日期: 检验日期:
1.甘露醇浓度测定
精密取本品5ml ,,置25ml 量瓶中,加水使溶解并稀释至刻度,摇匀;精密量取10ml ,置碘瓶中,精密加入高碘酸钠溶液50ml ,置水浴上加热15分钟,放冷,加碘化钾试液10ml ,密塞,放置5分钟,用0.05mol/L 硫代硫酸钠滴定液滴定,至近终点时,加淀粉指示液1ml ,继续滴定至蓝色消失,并将滴定结果用空白试验校正。
每1ml 的0.05mol/L 硫代硫酸钠滴定液相当于0.9109mg 的C 6H 14O 6。
按干燥品计算,含C 6H 14O 6应为98.0%~102.0% 计算公式:
式中:空V —含量测定中空白实际消耗的硫代硫酸钠滴定液体积,ml
V 1—含量测定中供试品实际消耗的硫代硫酸钠滴定液体积,ml
V 0—样品体积,ml
F -校正因子 Ws —供试品的重量,g
F= C 实际 / C 理论
高碘酸钠溶液配制批号: 碘化钾试液配置批号: 淀粉指示液配制批号:
□符合规定;□不符合规定
检验人: 检验日期: 复核人: 复核日期:
%10010259109.0)%01⨯⨯⨯⨯⨯-=V F V V 空(含量。
配液系统验证方案

类别:设备验证软袋车间配液系统验证方案版次:□新订□替代:起草:年月日审阅会签:(验证领导小组)批准:年月日实施日期:年月日目录1 概述2 范围3 职责3.1 验证领导小组3.2 生产技术部3.3 质量部4 验证4.1 安装确认4.2 运行确认4.3 性能确认5 结果分析和评价6 验证周期6.1 设备再验证7 最终批准1. 概述本公司输液车间配液系统包括浓配罐、稀配罐及其附属设备(管道、泵、过滤器等),本系统为立式封闭型结构,所有与药液直接接触部分均为316L不锈钢材质,浓配罐容量为3000L,稀配罐容量为5000L,均配备搅拌装置及加热降温装置,温度及液位显示装置,精密过滤装置等,滤芯分别为1μm钛棒、0.45μm、0.22μm的聚醚砜滤芯。
2 范围适用于配液系统验证。
本方案包括安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3 职责3.1.1 负责验证方案的审批。
3.1.2 负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
3.1.3 负责验证数据及结果的审核。
3.1.4 负责验证报告的审批。
3.1.5 负责发放验证证书。
3.2.1 负责验证方案的起草、设计及实施。
3.2.2 负责提供本设备的详细资料及相关SOP。
3.2.3 负责提供设备的计量器具校正详细情况。
3.3.1 负责验证方案相关的检验及结果分析报告。
3.3.2 负责数据的选择与评价。
4 验证内容4.1 安装确认(IQ)4.1.1 仪器仪表校正列出设备所有计量器具清单,包括温度显示仪、压力表等,确定校正周期、使用范围等,并按规定程序进行校正。
见仪器仪表校正记录。
4.1.2设备动力部组织人员对设备进行开箱验收及备品备件入库工作。
见设备的开箱验收记录、备品备件入库记录。
4.1.3安装条件确认配制系统浓配罐和稀配罐都应处于万级洁净区下的环境。
见安装条件检查记录。
4.1.4 公用介质的连接确认公用介质的连接已按照设备设计安装说明书的要求进行,各种公用介质的规格与设备相匹配;所用高效过滤器均做完好性检测合格。
制药用配液系统功能及PID图

制药用配液系统功能及PID图
制药用全自动配液系统功能介绍:
1、按品种设置的自动药液配置控制;
2、自动进液、自动补水、自动称重、自动搅拌、自动保压、自动药液传输、罐体恒温自动控制。
3、可验证的自动清洗系统
4、自动清洗球,罐体清洗无死角,按验证工艺自动管道清洗、自动取样阀清洗、自动过滤器壳清洗、罐体自动清洗,每一道工序清洗效果自动确认。
5、配液系统全自动在线SIP控制
6、配料系统中各种介质管路的在线自动SIP,各种过滤器的在线SIP。
7、配液系统的密闭性在线自动检测
8、在每一次SIP开始前,配液系统在线自动气密性检测。
9、药液过滤器在线完整性自动测试
10、过滤器药液过滤后的在线自动检测,过滤器在线SIP后的自动润湿、自动完整性测试。
制药用全自动配液系统PID图:。
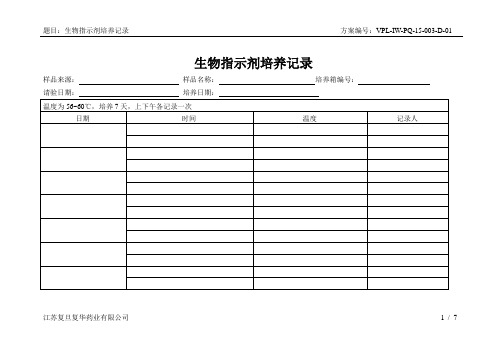
全自动配液系统PQ附录D
□合格□不合格
应变色
(紫色变为黄色)
记录人/日期 复核人/日期
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
应变色
(紫色变为黄色)
记录人/日期 复核人/日期
编号
培养前
培养48h后
培养至7天后
结果
判断标准
备注
B1
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
应不变色
(均为紫色)
B2
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
B3
□紫色□黄色
□紫色□黄色
B20
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
B21
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
B22
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
B23
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
B24
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
阳性对照
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
C10
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
C11
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
C12
□紫色□黄色
□紫色□黄色
□紫色□黄色
□合格□不合格
C13
□紫色□黄色
□紫色□黄色
全自动配液系统PQ方案终版
全自动配液系统PQ方案终版全自动配液系统性能确认方案目录1.1 目的 (3)1.2 范围 (3)1.3 职责 (3)1.4 确认前培训 (3)1.5 文件记录要求 (3)1.6 确认对象描述 (4)1.7 可接受标准 (4)1.8 性能确认步骤及结果 (4)1.9 偏差 (20)1.10 变更 (20)1.11 术语 (21)1.12 参考文献 (21)1.13 修订历史 (21)1.1目的1.1.1本性能确认方案的目的是提供文件证据证明江苏复旦复华药业有限公司无菌配液过滤系统的性能确认方法与标准,能基于批准的工艺方法和产品标准,作为组合或分别进行有效的重复的运行。
1.1.2性能测试应在真实生产条件或模拟生产条件下进行,应收集确认数据并记录在附件的测试报告上。
性能确认是正式测试的最后步骤,以及确认需求矩阵中识别为进行性能确认测试的系统正式运行前正确性能的文件证据。
当最终性能确认报告批准后,系统可用于正常生产操作或用于工艺验证。
1.2范围本确认方案适用于江苏复旦复华药业有限公司冻干粉针剂车间二层无菌配液系统的性能确认工作。
1.3职责1.3.1设备使用部门负责确认文件的起草,确认工作的组织与实施。
1.3.2QC负责样品的检测。
1.3.3QA负责现场取样及确认工作实施的监督。
1.3.4QA经理负责相关确认文件的审核。
1.3.5质量管理负责人负责相关确认文件的批准。
1.3.6QA文档管理员负责给出确认文件的文件编号,以及相关文件的发放、回收及归档。
1.4确认前培训确认小组应在本确认方案批准后进行本确认方案的专项培训,并确保所有参加本确认工作的人都已熟知本方案要求,并记录在《培训记录表》(QA-MAN-005-H)。
1.5文件记录要求1.5.1严格按照《良好的文件记录规范》(QA-MAN-003)中对质量记录填写的要求进行确认报告的填写及记录。
1.5.2确认操作及记录应至少两人进行,确保所有的确认测试均完成,并有足够的确认数据被提供。
全自动配液系统PQ附录E
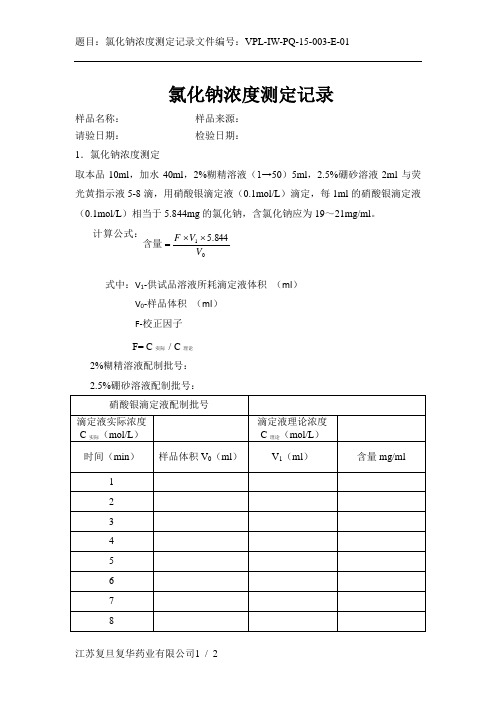
样品名称:_____________样品来源:____________________
请验日期:_____________检验日期:____________________
1.氯化钠浓度测定
取本品10ml,加水40ml,2%糊精溶液(1→50)5ml,2.5%硼砂溶液2ml与荧光黄指示液5-8滴,用硝酸银滴定液(0.1mol/L)滴定,每1ml的硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠,含氯化钠应为19~21mg/ml。
时间(min)
样品体积V0(ml)
V1(ml)
含量mg/ml
1
2
3
4
5
6
7
8
2、检测结果稳定后连续三次样品浓度偏差:
时间(min)
合格标准
实际偏差值
是否符合要求
连续3次样品浓度偏差不超过±1%
结论
□符合规定;□不符合规定
检验人:检验日期:
复核人:复核日期:
计算公式:
式中:V1-供试品溶液所耗滴定液体积(ml)
V0-样品体积(ml)
F-校正因子
F= C实际/ C理论
2%糊精溶液配制批号:_________________
2.5%硼砂溶液配制批号:__________________
硝酸银滴定液配制批号
滴定液实际浓度
C实际(mol/L)
滴定液理论浓度
C理论(moLeabharlann /L)
全自动配液系统PQ报告
全自动配液系统性能确认报告确认方案编号:VRT-IW-PQ-15-003-01目录1.1目的 (3)1.2范围 (3)1.3确认前培训情况总结 (3)1.4确认对象描述 (3)1.5可接受标准 (4)1.6结果和结论汇总 (4)1.7偏差汇总 (4)1.8变更汇总 (4)1.9术语 (4)1.10再确认时间 (4)1.1目的1.1.1本性能确认报告的目的是提供文件证据证明江苏复旦复华药业有限公司无菌配液过滤系统的性能确认方法与标准,能基于批准的工艺方法和产品标准,作为组合或分别进行有效的重复的运行。
1.1.2性能测试应在真实生产条件或模拟生产条件下进行,应收集确认数据并记录在附件的测试报告上。
性能确认是正式测试的最后步骤,以及确认需求矩阵中识别为进行性能确认测试的系统正式运行前正确性能的文件证据。
当最终性能确认报告批准后,系统可用于正常生产操作或用于工艺验证。
1.2范围本确认报告适用于江苏复旦复华药业有限公司冻干粉针剂车间二层无菌配液系统的性能确认工作。
1.3确认前培训情况总结确认前应对实施人员进行培训,实施人员应熟悉此设备原理,操作人员应能正确运行设备。
培训记录见附件:《培训记录》1.4确认对象描述1.4.1该配液系统位于江苏复旦复华药业有限公司冻干粉针剂车间二层,该系统将用于粉针剂的药液配制、除菌过滤和药液输送。
整个系统可以进行在线清洗和在线灭菌。
1.4.2该配液系统包括触摸屏+PLC的控制系统、配制罐、称重模块、输送系统、过滤系统及连接管道等组成。
控制系统能够监测温度、压力、储罐重量等参数,并自动记录,并有趋势和历史记录,具有超限报警功能。
可对关键参数(如转速、温度等)进行设定,并控制气动阀门、搅拌器与泵的开启。
控制方式分为自动与半自动两种方式。
配制罐主要用于原辅料的混合与药液的储存。
称重模块体现罐内液体的重量,便于定容,并反馈到PLC控制面板,便于查看、记录。
输送系统通过输送泵提供药液输送的动力推进。
全自动配液系统标准操作规程—高通
全⾃动配液系统标准操作规程—⾼通标准操作规程题⽬:全⾃动配液系统标准操作规程1.0⽬的建⽴⼀个配液系统的标准操作程序。
2.0范围本SOP适⽤于江苏复旦复华药业有限公司(以下简称“江苏药业”)配液系统的操作、清洁及维护。
3.0定义3.1CIP:即Clean In Place的缩写,原位清洗(在线清洗)。
3.2SIP:即Sterilization in Place的缩写,原位灭菌(在线灭菌)。
3.3配制:是指灌装前将原辅料和溶剂混合的过程。
3.4完整性检测:⼀种对过滤器进⾏的可以关联到其细菌截留能⼒的⾮破坏性物理性检测。
4.0职责4.1岗位⼈员:4.1.1负责设备的使⽤与⽇常维护保养。
4.1.2负责设备记录、异常情况报告的填写。
4.1.3负责设备的清洁。
4.2维修⼈员负责预防性维修及异常情况下的维修。
5.0材料与设备材料:全⾃动配液系统使⽤说明书6.0操作规程6.1操作流程:CIP SIP 称量配制取样0.45um除炭过滤取样0.22um除菌过滤完整性检测CIP6.2系统开机前确认:6.2.1检查氮⽓(2~3bar)、压缩空⽓(6~7bar)的压⼒是否正确。
6.2.2确认配液罐、缓冲罐顶部上的⽓动球阀上⽅阀头黄⾊标线与管路平⾏,呼吸阀即为开启状态。
6.3在线清洗程序CIP6.3.1拧开快装卡箍,拆下钛棒过滤器、0.45µm PES过滤器、0.22µm PES 过滤器(C级配液间)以及两个0.22µm PES过滤器(⼀号、⼆号灌装机A级层流下各⼀个)另⾏清洁;6.3.2⽤专⽤短管替代上述过滤器,拧紧快装卡箍。
6.3.3打开电源启动配液系统,“ON”表⽰开,“OFF”表⽰关。
6.3.4电源开启后进⼊初始界⾯6.3.5点击“登录”按钮,在登录界⾯输⼊⽤户名和密码。
6.3.6点击T101罐按键进⼊操作系统6.3.7点击CIP按键,进⼊CIP操作界⾯;6.3.8选择所需要清洗步骤“有效”,点击“参数1”;6.3.9在配制罐选择中选择所需清洗的配制罐,“T101”表⽰在线清洗T101罐、T103罐及相关药液管路,T102罐为终淋罐;“T102”表⽰在线清洗T102罐、T103罐及相关药液管路,T101罐为终淋罐。
一种全自动配液模块系统设备[实用新型专利]
专利名称:一种全自动配液模块系统设备专利类型:实用新型专利
发明人:岳彩民,许梦醒,黄碧龙
申请号:CN201720414198.7
申请日:20170419
公开号:CN206911266U
公开日:
20180123
专利内容由知识产权出版社提供
摘要:本实用公开了一种全自动配液模块系统设备,包括物料添加配制系统、注射用水温度控制系统、在线CIP/SIP系统、物料除菌过滤系统和自动控制操作系统,所述物料添加配制系统包括配制罐和称重模块,所述配制罐上分别连通有注射用管道、纯蒸汽进管以及CIP输送管道。
本实用不使用工程手段,利用模块设备代替工程手段实现制药行业无菌制剂的工艺物料自动配制,工艺物料温度自动控制,管罐自动清洗与灭菌,工艺物料自动过滤除菌等功能,具有人为干扰因素小,重现性好,符合制药等洁净卫生领域的验证要求,作为专用设备安装即可无菌制剂生产过程监控方便,无质量风险,生产过程数据可追溯等优点,值得大力推广。
申请人:安徽笃舜智能装备有限公司
地址:234000 安徽省宿州市宿马园区科创中心2号楼10层
国籍:CN
更多信息请下载全文后查看。
全自动液体灌装机供液系统的改进
全自动液体灌装机供液系统的改进1.计量采用德国产精度为0.5%的E+H电磁流量计控制。
流量计参数如下:变送器:PROMAG 50 2行显示,带背光,按键操作order code:50H26-WHOA1AA0ABADser. No. :72099119000EPD/MSU 内衬材质:PFAI-out(HART),I-out 应用:医药/食品/过程STATUS-OUT,STATUS-IN传感器:Promag HDN25 PN11850 PN16/230PSIGMaterials PFA/14435/316L/sitconeEPD/MSU 0.5% CAL说明:流量计的参数可咨询厂家,但要注意一个脉冲设定为1克。
在安装时一定要保证流量计的进口处最短直管不能少于10倍管径,出口直管不能少于5倍管径。
如欧福蛋业采用的是DN25口径的流量计,流量计进口处直管为300mm,出口管径为200mm.。
在灌装时,灌装到10L时,流量计显示的瞬时流量不能超过3.5吨/小时,否则计量误差变大。
2。
灌装阀的改造:采用灌装阀在计量结束后,立即关闭,从而杜绝脱尾发生。
关闭灌装阀的气缸和阀杆部分还采用你公司设计的,也可以采用丹麦公司生产的灌装部分但制造较麻烦更换密封圈却很方便。
如感兴趣我可以给你资料。
灌装阀芯图片如下:铜阀芯在制件时应注意:四个支撑部分的外径略小于DN25不锈钢管的内径。
封口时阀芯上密封圈与DN25管上的焊接快接头(快接头内用车床倒个斜角)封合。
铜阀芯放密封圈的下圆外径应大于DN25不锈钢管的内径。
在开始灌装时铜阀芯下降打开,只能向下打开4mm以内(可以通过调节拉杆来调整打开的距离),使物料向喷泉一样喷下,以防止冲击力太大时物料向上飞溅。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全自动配液系统性能确认方案目录1.1 目的 (3)1.2 范围 (3)1.3 职责 (3)1.4 确认前培训 (3)1.5 文件记录要求 (3)1.6 确认对象描述 (4)1.7 可接受标准 (4)1.8 性能确认步骤及结果 (4)1.9 偏差 (20)1.10 变更 (20)1.11 术语 (21)1.12 参考文献 (21)1.13 修订历史 (21)1.1目的1.1.1本性能确认方案的目的是提供文件证据证明江苏复旦复华药业有限公司无菌配液过滤系统的性能确认方法与标准,能基于批准的工艺方法和产品标准,作为组合或分别进行有效的重复的运行。
1.1.2性能测试应在真实生产条件或模拟生产条件下进行,应收集确认数据并记录在附件的测试报告上。
性能确认是正式测试的最后步骤,以及确认需求矩阵中识别为进行性能确认测试的系统正式运行前正确性能的文件证据。
当最终性能确认报告批准后,系统可用于正常生产操作或用于工艺验证。
1.2范围本确认方案适用于江苏复旦复华药业有限公司冻干粉针剂车间二层无菌配液系统的性能确认工作。
1.3职责1.3.1设备使用部门负责确认文件的起草,确认工作的组织与实施。
1.3.2QC负责样品的检测。
1.3.3QA负责现场取样及确认工作实施的监督。
1.3.4QA经理负责相关确认文件的审核。
1.3.5质量管理负责人负责相关确认文件的批准。
1.3.6QA文档管理员负责给出确认文件的文件编号,以及相关文件的发放、回收及归档。
1.4确认前培训确认小组应在本确认方案批准后进行本确认方案的专项培训,并确保所有参加本确认工作的人都已熟知本方案要求,并记录在《培训记录表》(QA-MAN-005-H)。
1.5文件记录要求1.5.1严格按照《良好的文件记录规范》(QA-MAN-003)中对质量记录填写的要求进行确认报告的填写及记录。
1.5.2确认操作及记录应至少两人进行,确保所有的确认测试均完成,并有足够的确认数据被提供。
1.6确认对象描述1.6.1该配液系统位于江苏复旦复华药业有限公司冻干粉针剂车间二层,该系统将用于粉针剂的药液配制、除菌过滤和药液输送。
整个系统可以进行在线清洗和在线灭菌。
1.6.2该配液系统包括触摸屏+PLC的控制系统、配制罐、称重模块、输送系统、过滤系统及连接管道等组成。
控制系统能够监测温度、压力、储罐重量等参数,并自动记录,并有趋势和历史记录,具有超限报警功能。
可对关键参数(如转速、温度等)进行设定,并控制气动阀门、搅拌器与泵的开启。
控制方式分为自动与半自动两种方式。
配制罐主要用于原辅料的混合与药液的储存。
称重模块体现罐内液体的重量,便于定容,并反馈到PLC控制面板,便于查看、记录。
输送系统通过输送泵提供药液输送的动力推进。
过滤系统用于过滤药液,截留大颗粒,降低微生物。
1.6.3主要流程:原辅料在配液罐中充分混合溶解,通过循环泵和钛棒过滤器进行循环脱碳。
后经0.45um过滤器过滤进入缓冲罐,经气压将药液经0.22um除菌过滤后连续输送至灌装分液器待灌装。
该配液系统可进行在线CIP、SIP。
可进行过滤器在线完整性测试。
1.7可接受标准1.7.1配液系统能够满足配制工序工艺参数的要求。
1.7.2设备运行稳定,无异常噪音,运行参数符合URS要求。
1.8性能确认步骤及结果1.8.1测试项目列表在下面的表格列出了本方案将要执行的测试。
1.8.2先决条件确认1.8.2.1目的:确认配液系统安装/运行确认已完成并审批,如果存在未关闭的偏差,偏差不影响PQ的进行。
1.8.2.2方法:检查无菌配液系统IQ/OQ报告,记录报告名称,报告编号,报告批准日期以及是否存在遗留尾项。
如存在未关闭的偏差,需填写偏差名称、偏差编号,对偏差进行简述并判定是否影响PQ执行。
1.8.2.3可接受标准:IQ/OQ报告已完成并审批。
确认人/日期: 复核人/日期:1.8.3人员确认1.8.3.1目的:确认所有执行本方案的人员以及签名。
1.8.3.2方法:列出所有执行本方案的人员(姓名、部门和职务)。
执行方案人员本人在签名处使用蓝色签字笔书写本人签名及日期。
1.8.3.3可接受标准:所有执行本方案人员本人使用蓝色签字笔正确书写本人签名及日期。
所有执行本方案的人员(姓名、签名、日期、部门、职务)已记录。
1.8.4文件确认1.8.4.1目的:确认方案涉及文件名称、编号、版本号、发布日期以及是否生效。
1.8.4.2方法:列出用于无菌配液系统性能确认所需要文件名称。
记录文件编号、版本,以及文件审核状态。
1.8.4.3可接受标准:性能确认所需要的文件都存在。
文件名称、编号、版本号、发布日期正确,且已经生效。
确认人/日期: 复核人/日期:1.8.5测试所用仪器仪表校准确认1.8.5.1目的:确认PQ测试使用仪器仪表经过校准,且在有效期内。
1.8.5.2方法:根据校准管理程序,列出在执行PQ 时使用的所有测量仪器仪表。
记录仪器仪表序列号、校准日期、校准证书编号及有效期至,并检查是否能够追溯到中国国家计量基准。
1.8.5.3可接受标准:所使用的所有仪器仪表均具有校验报告,且在有效期内。
校准使用的参考标准可追溯到中国国家计量基准。
确认人/日期: 复核人/日期:1.8.6所需物品物料确认1.8.6.1目的:确认PQ测试中所需物品物料完备齐全,且在有效期内。
1.8.6.2方法:列出在执行PQ 时所使用的物品物料名称及数量,并记录批号及有效期至,确保PQ顺利完成。
1.8.6.3可接受标准:所需物品物料完备齐全,且在有效期内。
确认人/日期: 复核人/日期:1.8.7称重确认1.8.7.1目的:确认配液系统地称的准确性。
1.8.7.2方法:分别在T101配液罐中依次加入50kg纯化水,T102配液罐中依次加入100kg纯化水记录称重显示值,至理论允许最大容量值。
1.8.7.3可接受标准:应误差不超过±0.5%。
500L配液罐称重确认表确认人/日期: 复核人/日期:1000L配液罐称重确认表确认人/日期: 复核人/日期:1.8.8喷淋球覆盖率确认1.8.8.1目的:检查喷淋球的覆盖率,确认喷淋球可达到冲淋效果。
1.8.8.2确认前准备:1.8.8.2.1取维生素B2(核黄素)2g,加水1000g使其溶解;1.8.8.2.2用小喷壶装取维生素B2溶液,均匀喷洒在T101配液罐、T102配液罐、T103缓冲罐尤其是罐顶封头部位;1.8.8.2.3待自然干燥后,用荧光灯照射核黄素喷洒表面,可见明显黄绿色荧光。
1.8.8.3确认步骤1.8.8.3.1T101配液罐喷淋冲洗:打开配液罐T101顶部的纯化水补水阀和罐底相关排空阀,用纯化水冲洗罐T101两分钟,清洗水直接排放。
1.8.8.3.2T102配液罐喷淋冲洗:打开配液罐T102顶部的纯化水补水阀和罐底相关排空阀,用纯化水冲洗罐T102两分钟,清洗水直接排放。
1.8.8.3.3T103缓冲罐喷淋冲洗:打开配液罐T103顶部的注射水补水阀和罐底相关排空阀,用纯化水冲洗罐T103两分钟,清洗水直接排放。
1.8.8.4可接受标准:清洗后,待自然干燥(暂定放置2小时),用紫外灯照射核黄素喷洒表面,无黄绿色荧光。
确认人/日期: 复核人/日期:1.8.9搅拌时间、转速及均匀性确认1.8.9.1目的:确认搅拌时间、转速的准确性以及搅拌的均匀性。
1.8.9.2最小配液量搅拌时间、转速及均匀性确认1.8.9.2.1目的:确认配液罐在最小配液量情况下搅拌时间、转速的准确性以及搅拌的均匀性。
1.8.9.2.2方法:A. 搅拌时间及搅拌转速确认:在T101配液罐中加入纯化水30 Kg、T102配液罐中加入纯化水50 Kg,设定搅拌时间5分钟、转速240 r/min。
以秒表计时,转速仪测转速,分别记录搅拌时间和搅拌转速,连续进行三次。
B. 搅拌均匀性确认:以氯化钠为例,控温15~30℃,在T101配液罐内用0.6 Kg氯化钠配制成30 Kg 2%的氯化钠溶液;在T102配液罐内用1.0Kg氯化钠配制成50 Kg 2%的氯化钠溶液,设定转速240 r/min、搅拌至目检无未溶解颗粒,取样送QC检测浓度(为方便CIP确认进行,T101、T102两罐搅拌均匀性分开实施,顺序为T101罐搅拌均匀性、T101罐CIP确认、T102罐搅拌均匀性、T102罐CIP确认。
CIP确认详见本方案1.8.10)。
C. 取样方法:在目测无未溶解颗粒时开始取样,以后每隔一分钟取样一次,连续取样8次,每次取样100ml。
取样瓶为250 ml锥形瓶,依次编号后送QC检测。
检测结果详见附录E:《氯化钠浓度测定记录》。
1.8.9.2.3可接受标准:搅拌时间误差不超过±1%;搅拌转速误差不超过±5%;氯化钠溶液浓度为19~21mg/ml,且检测结果稳定后连续3次样品浓度偏差不超过±1%。
最小配液量搅拌时间确认表确认人/日期: 复核人/日期:最小配液量搅拌转速确认表确认人/日期: 复核人/日期:最小配液量搅拌均匀性确认表确认人/日期: 复核人/日期:1.8.9.3最大配液量搅拌时间、转速及均匀性确认1.8.9.3.1目的:确认配液罐在最大配液量情况下搅拌时间、转速的准确性以及搅拌的均匀性。
1.8.9.3.2方法:A. 搅拌时间及搅拌转速确认:在T101配液罐中加入纯化水350 Kg、T102配液罐中加入纯化水700 Kg,设定搅拌时间5分钟、转速240 r/min。
以秒表计时,转速仪测转速,分别记录搅拌时间和搅拌转速,连续进行三次。
B. 搅拌均匀性确认:以氯化钠为例,控温15~30℃,在T101配液罐内用7.0 Kg氯化钠配制成350 Kg 2%的氯化钠溶液;在T102配液罐内用14.0 Kg氯化钠配制成700 Kg 2%的氯化钠溶液,设定转速240 r/min、搅拌至目检无未溶解颗粒,取样送QC检测浓度。
C. 取样方法:在目测无未溶解颗粒时开始取样,以后每隔一分钟取样一次,连续取样8次,每次取样100ml。
取样瓶为250 ml锥形瓶,依次编号后送QC检测。
检测结果详见附录E:《氯化钠浓度测定记录》。
1.8.9.3.3可接受标准:搅拌时间误差不超过±1%;搅拌转速误差不超过±5%;氯化钠溶液浓度为19~21mg/ml,且检测结果稳定后连续3次样品浓度偏差不超过±1%。
最大配液量搅拌时间确认表确认人/日期: 复核人/日期:最大配液量搅拌转速确认表确认人/日期: 复核人/日期:最大配液量搅拌均匀性确认表确认人/日期: 复核人/日期:1.8.10CIP确认1.8.10.1目的:确认配液过滤系统CIP程序运转正常,并能达到一定冲洗效果。
1.8.10.2T101罐CIP确认方法:1.8.10.2.1在T101罐最大配液量搅拌均匀性确认结束之后,进行T101罐CIP确认;1.8.10.2.2手动模式启动生产程序,点击“下一步”至Step 16:配制罐物料转移;1.8.10.2.3设置配方参数Step 17:5min,Step 18:1min。
