高一化学镁铝和铁化学方程式知识点总结
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
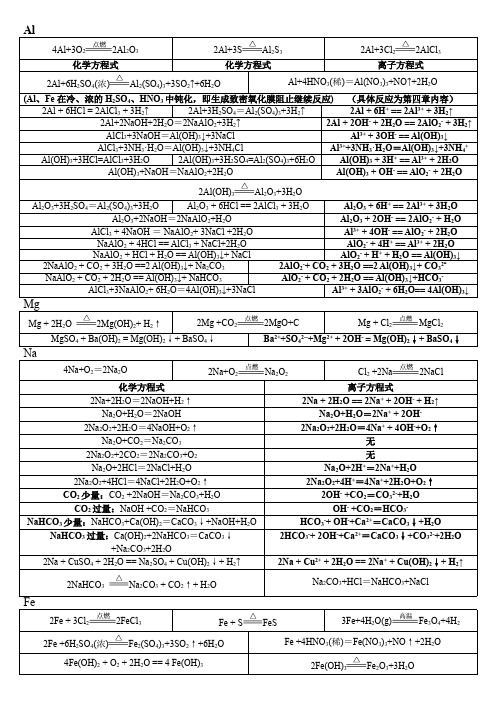
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
高中化学知识点总结:镁、铝、铁及其化合物

高中化学知识点总结:镁、铝、铁及其化合物1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:2 2MgO 2223Mg(OH)2 Mg22AlCl4.氧化铝和氢氧化铝A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2OAl(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O5.生成Al(OH)3沉淀量的图像分析(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物(1)铁在周期表中的位置及原子结构铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质①与非金属反应2Fe+3Cl2=2FeCl3(棕黄色的烟)3Fe+2O2=Fe3O4Fe+S=FeSFe+I2=FeI2注:铁与弱氧化性物质反应生成低价铁的化合物②与酸反应a.非氧化性酸.Fe+2H+=Fe2++H2↑b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。
高一化学钠铁镁铝知识点

高一化学钠铁镁铝知识点化学是一门研究物质性质、组成、构造、变化和相互关系的科学。
在高中化学中,钠(Na)、铁(Fe)、镁(Mg)和铝(Al)是常见的金属元素。
下面将分别介绍这四种金属元素的知识点。
一、钠(Na)1. 基本性质钠是一种银白色的金属,在常温下非常活泼。
它的熔点较低,约为98摄氏度,热稳定性较差,容易氧化。
2. 化合物钠与氧、氯等元素形成多种化合物。
其中最常见的是氯化钠(NaCl),即食盐。
钠还与氧形成氧化钠(Na2O)等化合物。
3. 应用钠在工业上广泛应用,主要用于金属制品的冶炼、合成橡胶和塑料的生产等。
二、铁(Fe)1. 基本性质铁是一种常见的金属元素,在自然界中广泛存在。
它具有良好的延展性和导电性,并且能够吸附磁性。
2. 基本结构铁的原子核中含有26个质子和中子,电子排布为2-8-14-2。
3. 氧化反应铁在空气中容易氧化,形成氧化铁。
常见的氧化铁有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)。
4. 应用铁是制造钢铁的主要原料,广泛用于建筑、机械、交通工具等领域。
三、镁(Mg)1. 基本性质镁是一种银白色的金属,比重轻、延展性好、导电性能强,并具有良好的耐腐蚀性。
2. 化合物镁与氧、氯等元素形成多种化合物。
其中最常见的是氧化镁(MgO),常用作建筑材料。
3. 应用镁在工业上广泛应用,如制造航空器、汽车、光学仪器等。
四、铝(Al)1. 基本性质铝是轻质金属,具有良好的延展性、导电性和热传导性,同时还有一定的耐腐蚀性。
2. 氧化反应铝表面易生成一层氧化铝膜,这层膜能够防止铝继续氧化。
3. 应用铝是一种重要的工业原料,广泛用于建筑、包装、交通工具等。
综上所述,钠、铁、镁和铝是高中化学中常见的金属元素。
通过学习它们的基本性质、化合物以及应用,可以更好地理解化学元素的特点和用途。
这些知识点的掌握有助于培养学生的实践能力和科学思维,为日后深入学习化学和工程技术奠定基础。
高一化学镁铝和铁化学方程式知识点总结-教育文档

高一化学镁铝和铁化学方程式知识点总结
1、碳酸氢钙溶液受热分解 Ca(HCO3)2 =CaCO3+CO2+H2o
2、氯化镁和氨水 MgCl2 + 2NH3H2O = Mg(OH)2+2NH4Cl
3、铝和氢氧化钠溶液 2Al+2NaOH+2H2o=2NaAlO2+3H2
4、铝热反应 4Al+3MnO2=3Mn+2Al2O3(高温)
5、氧化铝和盐酸 Al2O3 + 6HCl = 2AlCl3 + 3H2O
6、氧化铝和氢氧化钠溶液 Al2O3 + 2NaOH = 2NaAlO2 + H2O
7、氢氧化铝受热分解 2Al(OH)3=Al2O3+3H2O
8、氢氧化铝和盐酸 Al(OH)3+3HCl=AlCl3+3H2O
9、氢氧化铝和氢氧化钠溶液 Al(OH)3+NaOH=NaAlO2+2H2O
10、三氯化铝和过量氨水
AlCl3+3NH3+3H2O=Al(OH)3+3NH4Cl
11、三氯化铝和过量氢氧化钠
AlCl3+4NaOH=NaAlO2+3NaCl+2H2o
12、铁和水蒸气 3Fe+4H2O=Fe3O4+4H2
13、铁和足量的稀盐酸 Fe + 2HCl = FeCl2 + H2
14、铁和足量的稀硝酸 Fe+4HNO3=Fe(NO3)3+NO+2H2o
15、铁(完全过量)和少量的稀硝酸
3Fe+8HNO3=3Fe(NO3)2+2NO+4H2o
16、氢氧化铁受热分解 2Fe(OH)3=Fe2O3+3H2o
总结:以上就是高一化学镁铝和铁化学方程式知识点总结的全部内容,希望能帮助同学们巩固学过的化学知识,祝愿同
学们都能轻松愉快的学习,取得好成绩!。
高中元素化合物知识梳理

镁、铝、铜及其化合物 (一)镁与铝化学性质的比较1.与O 2的反应:Mg 、Al 均能与空气中的O 2反应,生成一层坚固而致密的氧化物保护膜.所以,金属镁和铝都有抗腐蚀性能。
它们都可燃烧:2Mg +O 2=====点燃2MgO,4Al +3O 2=====高温2Al 2O 32.与S 、X 2等非金属的反应:Mg +S=====△MgS ,Mg +Cl 2=====点燃MgCl 2 2Al +3S=====△Al 2S 3,2Al +3Cl 2=====点燃2AlCl 3 3.与酸的反应:非氧化性酸:Mg +2H +===Mg 2++H 2↑,2Al +6H +===2Al 3++3H 2↑氧化性酸:镁可溶于氧化性酸;常温下铝在冷的浓HNO 3、浓H 2SO 4中因发生钝化而难溶,但加热时也可溶解。
4.与碱的反应:镁不反应, 2Al +6H 2O +2NaOH===2Na[Al(OH)4]+3H 2↑5.与氧化物的反应:2Mg +CO 2=====点燃2MgO +C(金属镁能在CO 2气体中燃烧),2Al +Fe 2O 3=====高温2Fe +Al 2O 3[铝热反应,铝与比铝不活泼的金属氧化物(如CuO 、MnO 2、Fe 2O 3等)都可以发生铝热反应](二)氧化铝和氢氧化铝1.氧化铝:两性氧化物,既能与酸反应生成铝盐,又能与强碱反应生成四羟基合铝酸盐 :Al 2O 3+6H+===2Al 3++3H 2O , Al 2O 3+2OH -+3H 2O===2[Al(OH)4]-2.氢氧化铝:①既能溶于强酸,又能溶于强碱中:Al(OH)3+3H +===Al 3++3H 2O ,Al(OH)3+OH-===[Al(OH)4]-②受热分解:2Al(OH)3=====△Al 2O 3+3H 2O3.氢氧化铝的制法:可溶性铝盐与氨水反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4 或四羟基合铝酸钠 溶液通入CO 2:CO 2过量:[Al(OH)4]-+CO 2===Al(OH)3↓+HCO -3; CO 2少量: 2[Al(OH)4]-+CO 2===2Al(OH)3↓+H 2O +CO 2-3。
高一化学必修一知识点及方程式总结

高一化学(必修1)各章知识要点归纳第一章从实验学化学第一节化学实验基本方法一.化学实验安全1.遵守实验室规则。
2. 了解安全措施。
(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。
进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)烫伤宜找医生处理。
(3)浓酸沾在皮肤上,用水冲净然后用稀NaHCO3溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。
浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。
浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(5)钠、磷等失火宜用沙土扑盖。
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
3.掌握正确的操作方法。
例如,掌握仪器和药品的使用、加热方法、气体收集方法等。
二.混合物的分离和提纯1.过滤和蒸发实验1—1 粗盐的提纯仪器:天平,烧杯,玻璃棒,漏斗,铁架台,铁圈步骤:步骤现象1.溶解:称取4克粗盐加到盛有12mL水的小烧杯中,用玻璃棒搅拌使氯化钠充分溶解粗盐逐渐溶解,溶液浑浊。
2.过滤:组装好仪器,将1中所得到的混合物进行过滤。
若滤液浑浊,要再次过滤,直到滤液澄清为止。
滤纸上有不溶物残留,溶液澄清。
3.蒸发:将过滤后的澄清溶液转入蒸发皿,加热,并用玻璃棒搅拌,防止液滴飞溅。
当出现较多固体时停止加热,余热蒸干。
蒸发皿中产生了白色固体。
注意事项:(1)一贴,二低,三靠。
(2)蒸馏过程中用玻璃棒搅拌,防止液滴飞溅。
2.蒸馏和萃取(1)蒸馏原理:利用沸点的不同,处去难挥发或不挥发的杂质。
实验1---3 从自来水制取蒸馏水仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶。
操作:连接好装置,通入冷凝水,开始加热。
弃去开始蒸馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
现象:随着加热,烧瓶中水温升高至100度后沸腾,锥形瓶中收集到蒸馏水。
注意事项:①温度计的水银球在蒸馏烧瓶的支管口处。
高一化学方程式总结通用7篇

高一化学方程式总结通用7篇高一化学方程式总结篇一化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3 + HCl =NaHCO3 + NaClCO32- + H+ = HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+ = H2O +CO2↑小苏打受热分解2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑氧化还原反应:1. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O2. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑5. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO26.一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO27.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2氧化性:2FeCl3 + Fe === 3FeCl22FeCl3 + Cu === 2FeCl2 + CuCl2 (用于雕刻铜线路版)2FeCl3 + Zn === 2FeCl2 + ZnCl2FeCl3 + Ag === FeCl2 + AgCFe2(SO4)3 + 2Ag === FeSO4 + Ag2SO4(较难反应)Fe(NO3)3 + Ag 不反应2FeCl3 + H2S === 2FeCl2 + 2HCl + S2FeCl3 + 2I === 2FeCl2 + 2Cl + I2FeCl2 + Mg === Fe + MgCl2还原性:2FeCl2 + Cl2 === 2FeCl33Na2S + 8HNO3(稀) === 6NaNO3 + 2NO + 3S + 4H2O3Na2SO3 + 2HNO3(稀) === 3Na2SO4 + 2NO + H2O2Na2SO3 + O2 === 2Na2SO4硫和硫的化合物1、硫和钠反应的方程式:2Na+S=Na2S (条件:研磨) 现象:轻微爆炸2、硫和铁反应的方程式:Fe+S=FeS(条件加热)3、硫和浓硫酸反应的化学方程式:S+2H2SO4 =SO2↑ +2 H2O (条件:加热)4、硫和氢氧化钠溶液反应的化学方程式:3S+6NaOH=2Na2S+Na2SO3 + 3H2O(除硫的`化学方法)5、SO2与水反应的方程式:SO2 + H2O =H2SO3 (可逆反应要用可逆符号)6、少量的SO2与NaOH溶液反应的化学方程式:SO2 +2NaOH=Na2SO3 + H2O7、过量的SO2与NaOH溶液反应的化学方程式:SO2 + NaOH=NaHSO38、少量的SO2与澄清石灰水反应的化学方程式:SO2 + Ca(OH)2= CaSO3↓ + H2O9、少量的SO2与饱和的碳酸氢钠溶液反应的化学方程式:SO2 +2NaHCO3= Na2SO3 +2CO2 +H2O10、SO2与Na2SO3溶液反应的化学方程式:SO2 + Na2SO3 +H2O =2NaHSO311、SO2与氢硫酸反应的化学方程式:SO2 + 2H2S=3S↓+2H2O高一化学方程式总结篇二钠及其化合物的性质1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2点燃====Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
高中化学“镁、铝及其化合物”知识点总结

“镁、铝及其化合物”知识点总结一、Mg、Al的化学性质(一)与非金属反应1.与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2.与卤素单质、硫等反应。
【特别提醒】(1)镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:(2)燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
(3)集气瓶底部都要放一些细纱,以防集气瓶炸裂。
(二)与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气(三)与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
(四)与某些氧化物反应1.镁与二氧化碳反应:[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:(1)铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
(2)铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
(3)要使用没有氧化的铝粉,氧化铁粉末要烘干。
(4)KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
(五)与碱反应镁不与碱反应,铝与碱液反应:二、氢氧化铝(一)物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。
(二)化学性质1.与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O离子反应方程式:Al(OH)3+3H+=Al3++3H2O2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O离子反应方程式:Al(OH)3+OH =NaAlO2+2H2O3.Al(OH)3的制取(1)铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学镁铝和铁化学方程式知识点总结
1、碳酸氢钙溶液受热分解 Ca(HCO3)2 =CaCO3+CO2+H2o
2、氯化镁和氨水 MgCl2 + 2NH3H2O = Mg(OH)2+2NH4Cl
3、铝和氢氧化钠溶液 2Al+2NaOH+2H2o=2NaAlO2+3H2
4、铝热反应 4Al+3MnO2=3Mn+2Al2O3(高温)
5、氧化铝和盐酸 Al2O3 + 6HCl = 2AlCl3 + 3H2O
6、氧化铝和氢氧化钠溶液 Al2O3 + 2NaOH = 2NaAlO2 + H2O
7、氢氧化铝受热分解 2Al(OH)3=Al2O3+3H2O
8、氢氧化铝和盐酸 Al(OH)3+3HCl=AlCl3+3H2O
9、氢氧化铝和氢氧化钠溶液 Al(OH)3+NaOH=NaAlO2+2H2O
10、三氯化铝和过量氨水
AlCl3+3NH3+3H2O=Al(OH)3+3NH4Cl
11、三氯化铝和过量氢氧化钠
AlCl3+4NaOH=NaAlO2+3NaCl+2H2o
12、铁和水蒸气 3Fe+4H2O=Fe3O4+4H2
13、铁和足量的稀盐酸 Fe + 2HCl = FeCl2 + H2
14、铁和足量的稀硝酸 Fe+4HNO3=Fe(NO3)3+NO+2H2o
15、铁(完全过量)和少量的稀硝酸
3Fe+8HNO3=3Fe(NO3)2+2NO+4H2o
16、氢氧化铁受热分解 2Fe(OH)3=Fe2O3+3H2o
总结:以上就是高一化学镁铝和铁化学方程式知识点总结的全部内容,希望能帮助同学们巩固学过的化学知识,祝愿同
学们都能轻松愉快的学习,取得好成绩!。
