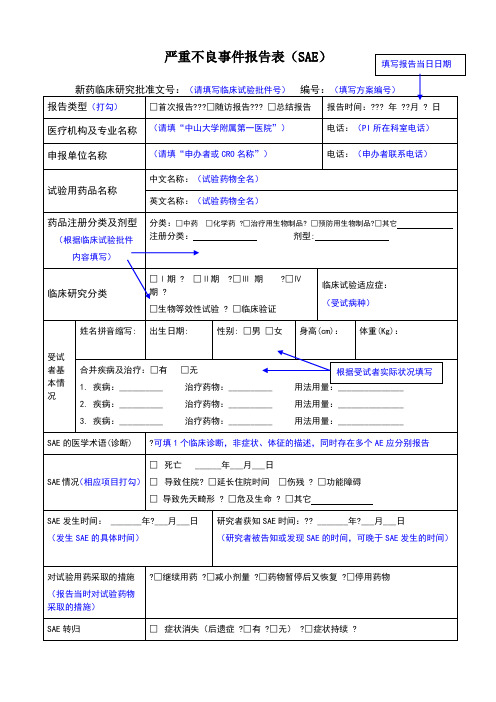
严重不良事件报告表(SAE)
SAE报告表填报指引
4.明确是否恢复试验治疗或退出试验
5.其他
报告单位名称中山大学附属第一医院????报告人职务/职称:如实填写报告人签名:首次报告必需由主要研究者签署,如PI不在,必需电话告知,并在报告中说明。
临床试验适应症:
(受试病种)
受试者基本情况
姓名拼音缩写:
出生日期:
性别: □男 □女
身高(cm):
体重(Kg):
根据受试者实际状况填写
合并疾病及治疗:□有 □无
1. 疾病:__________ 治疗药物:__________ 用法用量:_______________
2. 疾病:__________ 治疗药物:__________ 用法用量:_______________
3. 疾病:__________ 治疗药物:__________ 用法用量:_______________
SAE的医学术语(诊断)
?可填1个临床诊断,非症状、体征的描述,同时存在多个AE应分别报告
SAE情况(相应项目打勾)
□死亡 ______年___月___日
□导致住院? □延长住院时间 □伤残 ? □功能障碍
严重不良事件报告表(SAE)
新药临床研究批准文号:(请填写临床试验批件号)编号:(填写方案编号)
报告类型(打勾)
□首次报告???□随访报告??? □总结报告
报告时间:??? 年 ??月 ? 日
医疗机构及专业名称
(请填“中山大学附属第一医院”)
电话:(PI所在科室电话)
申报单位名称
(请填“申办者或CRO名称”)
SAE报道情况
国内: ?□有 ?□无 ?□不详; 国外: ?□有 ?□无 ?□不详
药物临床试验严重不良事件报告

药物临床试验严重
试验相关资料
项目名称
研究药物名称
天(如果能够精确计算:时分)
末次用药至SAE发生的时间
天(如果能够精确计算:时分)
AE与研究药物的关系(因果关系)
无关,可能无关,可能有关,很可能有关,有关,现有信息无法判断
采取的措施
无,调整研究用药的剂量,暂停研究用药,停用研究用药,停用伴随用药,增加新的治疗药物,应用非药物治疗,延长住院时间,修改方案/知情同意书
注1:如为设盲试验,是否紧急破盲:是,否请在“药物名称”栏填写药物编号
注2:如方案规定需调整研究用药剂量,请说明:
可能与SAE有关的药物(如非药物因素导致SAE,此栏内容可不填)
可能与SAE有关药物名称
该药物属于本临床试验的
研究用药(如果非盲/破盲:试验药物,对照药物),
伴随用药
该药物的适应证
首次用药至SAE发生的时间
研究药物分类
中药,化学药品,预防用生物制品,治疗用生物制品,其它
临床试验批准文号
研究分类
Ⅰ期,Ⅱ期,Ⅲ期,Ⅳ期,生物等效性试验,其它
首次报告(日期:年月日),随访报告,总结报告
申办单位
申办单位名称
申办单位地址
电话
传真
研究单位
研究机构名称
研究机构地址
电话
传真
受试者
姓名拼音首字母缩写
受试者(药物/随机)编码
严重不良事件报告表(SAE)
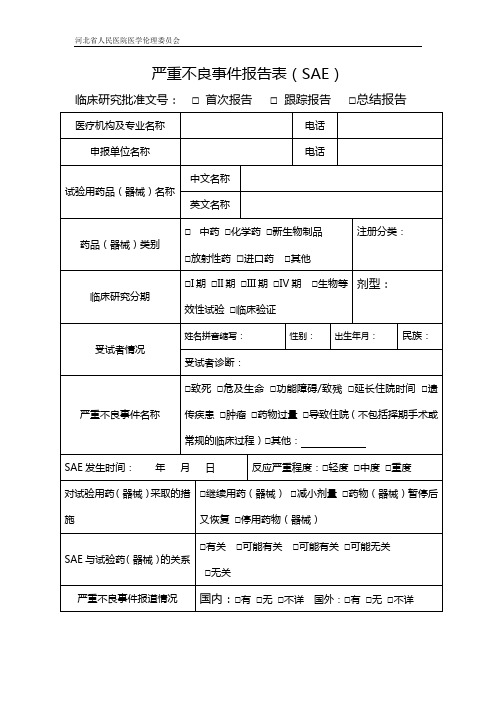
SAE与试验药(器械)的关系
□有关 □可能有关 □可能有关 □可能无关
□无关
严重不良事件报道情况
国内:□有 □无 □不详 国外:□有 □无 □不详
严重不良事件的详说明:(可附页说明)
严重不良事件处理情况:(可附页说明)
报告单位名称: 报告人签名:
严重不良事件报告表(SAE)
临床研究批准文号:□首次报告□跟踪报告□总结报告
医疗机构及专业名称
电话
申报单位名称
电话
试验用药品(器械)名称
中文名称
英文名称
药品(器械)类别
□中药 □化学药 □新生物制品
□放射性药□进口药 □其他
注册分类:
临床研究分期
□I期 □II期 □III期 □IV期 □生物等效性试验 □临床验证
剂型:
受试者情况
姓名拼音缩写:
性别:
出生年月:
民族:
受试者诊断:
严重不良事件名称
□致死 □危及生命 □功能障碍/致残 □延长住院时间 □遗传疾患 □肿瘤 □药物过量 □导致住院(不包括择期手术或常规的临床过程)□其他:
SAE发生时间: 年 月 日
反应严重程度:□轻度 □中度 □重度
对试验用药(器械)采取的措施
药物临床试验严重不良事件SAE报告表

药物临床试验严重不良事件(SAE)报告表
内容填写要求:疾病诊断(只填写SAE发生时的合并疾病),严重程度(根据方案要求),开始时间,合并用药(只需填写SAE发生时的合并用药)
SAE发生及处理的详细情况:(包括受试者详细信息,相关病史,参加试验的情况和进展,SAE的发生、治疗及转归过程,SAE"∕能原因分析):
内容填写要求:
1.SAE的描述:AE开始日期,AE升级为SAE的日期。
相关症状体征,轻重程度(根据方案要求的分级),相关实验室检
查(是否超出正常值范围,判定及日期),事件的诊断,相关诊疗过程,事件符合SAE的标准.
2.请记录SAE的转归.(包括严重程度的变更以及转归的日期)
3.研究者对于SAE相关性的判断(不同SAE分开陈述),并提供判断的依据。
4 .如果患者住院,请记录出院小结(如有).
5 .如患者死亡,请记录死亡时间,死亡小结,抢救情况,尸检报告或其他死亡证明文件,死亡原因.
6 .如患者因SAE 退出研究,请注明.
7 .如以上信息缺失,请注明具体原因。
8 .请列出SAE 发生期间的合并用药,若未产生合并用药,可不填.
随访/总结报告格式:
随访/总结报告(.dd ):新的信息如下:(或:对之前上报的SAE 信息更正如下:)
1 .自首次报告后,该SAE 发生的转归、治疗及相关检查情况
2 .再次评价该SAE 。
试验用药的相关性
3 .明确是否恢复试验治疗或退出试验 申办者盖章
报告人科室/职称: 报告日期:
报告单位名称: 报告人签名:。
SAE-报告模板

SAE发生时间:
研究者获知SAE时间:
对试验器械采取的措施
继续试验□观察后又继续□停用试验
SAE转归
□症状消失(后遗症□有□无)
症状持续
□死亡(死亡时间:______年___月___日)
SAE与试验器械的关系
□肯定有关可能有关□可能无关□肯定无关□无法判定
SAE发生及处理的详细情况:
报告单位名称:报告人职务/职称:报类型
首次报告□随访报告□总结报告
报告时间:
医疗机构及专业名称
电话:
申报单位名称
电话
试验用药品名称
中文名称:
英文名称:
受试者基本情况
姓名拼音缩写:
出生日期:
性别:男□女
身高(cm):
体重(Kg):
合并疾病及治疗:有□无
1.疾病:__________治疗药物:__________用法用量:_______________
2.疾病:__________治疗药物:__________用法用量:_______________
3.疾病:__________治疗药物:__________用法用量:_______________
SAE的医学术语(诊断)
SAE情况
□死亡______年___月___日
导致住院□延长住院时间□伤残□功能障碍
严重不良事件报告表SAE填写说明-中山大学附属第五医院

填写报告当日日
期
新药临床研究批准文号:(请填写临床试验批件号)
编号:(由申办方协助填写)
报告类型(打勾或■) □首次报告 □随访报告 □总结报告 报告时间: 年 月 日
医疗机构及专业名称 (xx 医院 XX 科)
电话:(PI 所在科室电话)
申报单位名称
(请填“申办者或 CRO 名称”)
□生物等效性试验 □临床验证
(方案规定的受试适应症)
姓名拼音缩写: 出生日期:
性别: □男 □女 身高(cm): 体重(Kg):
受试 者基 本情 况
合并疾病及治疗:□有 1. 疾病:__________ 2. 疾病:__________ 3. 疾病:__________
□无 治疗药物:__________ 治疗药物:__________ 治疗药物:__________
□ 症状消失(后遗症 □有 □无) □症状持续
SAE 与试验药的关系 (请尽可能根据临床所
□肯定有关 □可能有关 □可能无关 □肯定无关 □无法判定 (相关性的判断最好由主要研究者或协助研究者完成,参考下文《SAE 与试验药
掌握证据,判断相关性) 的关系因果判断参考表》)
SAE 报道情况
国内: □有 □无 □不详;
□ 导致先天畸形 □危及生命 □其它
SAE 发生时间: _______年 ___月___日 研究者获知 SAE 时间: _______年 ___月___日
(发生 SAE 的具体时间)
(研究者被告知或发现 SAE 的时间)
对试验用药采取的措施
□继续用药 □减小剂量 □药物暂停后又恢复 □停用药物
SAE 转归
“随访/总结报告”应包含但不限于以下信息, 1. 患者入组编号,入组时间和入组临床试验名称(编号),患者诊断 2. 自首次报告后,该 SAE 发生的转归、治疗及相关检查情况 3. 再次评价该 SAE 与试验用药或方法相关性 4. 明确是否恢复试验治疗或退出试验 5. 其他
严重不良事件(SAE)报告
严重不良事件(SAE)报告什么是严重不良事件?严重不良事件(SAE)是指发生在临床试验中可能会危及受试者生命或健康的不良事件。
与其他不良事件(例如轻微不适)不同,SAE往往需要立即上报给监管机构和该试验的伦理委员会。
SAE也可以发生在药品和医疗器械的正式营销中,这时也需要进行临床研究以确认安全性和有效性。
SAE报告的流程1. 紧急处理SAE在发生SAE之后,研究人员应立即采取措施,尽可能减少潜在的风险和继续伤害。
这包括为患者提供紧急治疗、停止试验药物的使用、暂停试验流程、调整试验流程或终止试验等。
2. 上报SAE在紧急处理后,研究人员需要尽快将SAE报告给监管机构和伦理委员会。
这通常需要按照监管机构特定的SAE上报表格或表格模板提交报告,例如中国FDA的SAE报告表格。
3. 追踪SAE进展在提交SAE报告之后,研究人员需要监测SAE患者的进展情况,同时将其汇报给监管机构和伦理委员会。
这些报告可以包括SAE的病因学、症状、严重程度和治疗方法等信息,以及治疗效果和不良反应的监测结果。
除此之外,要及时调整伦理委员会的决策和试验计划。
4. SAE报告/追踪的时间点在报告SAE时,有一定时间限制,这通常是在SAE发生后24小时内或发现亚组后7个日历日内内报告。
对于中国而言,采用了《食品药品安全法》和中国FDA对“在中国进行药物和医疗器械的临床试验管理规定”,规定紧急报告的时间为24小时内。
对于非紧急的SAE报告,则需要在30天内提交报告。
5. SAE报告的必要性SAE报告对于临床研究的推动起着重要作用。
SAE报告不仅有助于确保研究人员能够充分了解试验中不良反应的情况,而且可以促进试验的透明性和公平性,提高患者与公众对试验的信任和接受度。
同时也为监管机构和伦理委员会提供了必要的依据,以评估受试者安全和试验质量。
结论总之,SAE的发生需要及时采取处理措施并报告给监管机构和伦理委员会,提高试验的透明性和公平性。
不良事件和严重不良事件报告SOP
不良事件和严重不良事件报告SOP一、引言不良事件(Adverse Event, AE)和严重不良事件(Serious Adverse Event, SAE)是指在药物使用过程中产生的与药物有可能存在因果关系的有害反应。
为了确保药物的安全使用,必须对不良事件和严重不良事件进行及时、准确的报告和处理。
本文为不良事件和严重不良事件的报告及处理SOP(Standard Operating Procedure)。
二、定义1.不良事件:患者或试验对象在接受药物治疗或药物研究过程中,出现与药物暴露有可能相关的有害反应,包括预期的和非预期的。
2.严重不良事件:不良事件导致以下任何一种情况:危及生命,需要住院或延长住院,导致永久或严重残疾,威胁生命的,先天性异常或畸形。
三、报告责任1.监测人员:负责对临床试验过程中的不良事件进行监测和记录,并负责向研究者报告。
2.研究者:负责对不良事件进行评估,判断是否为严重不良事件,并及时报告给药物监管机构和伦理委员会。
3.药物监管机构:负责接受并处理药物不良事件的报告,保障药物的安全使用。
4.伦理委员会:负责审核研究者提交的严重不良事件报告,并提出建议和决策。
四、报告流程1.不良事件的监测和记录监测人员应定期对患者或试验对象进行随访,记录出现的不良事件,并将相关信息填写在不良事件报告表中,包括发生时间、症状描述、持续时间、严重程度等。
2.不良事件的评估和判断研究者应对收集到的不良事件进行评估,判断是否为严重不良事件。
评估应基于国家和国际上关于不良事件的定义和判断标准。
3.报告严重不良事件一旦判断为严重不良事件,研究者应立即向药物监管机构和伦理委员会进行报告。
报告内容应包括不良事件的描述、发生时间、因果关系评估、严重程度评估等信息。
报告方式可以采用书面报告、电子邮件或在线系统报告等。
4.处理不良事件研究者和药物监管机构应及时处理不良事件,包括调查、记录、分析和采取措施避免类似事件再次发生。
严重不良事件报告表(SAE)
新药临床研究批准文号:药物编号:研究号:
报告类型
□首次报告□随访报告□总结报告
报告时间:_______年___月___日:
医疗机构及专业名称
电话
申办单位名称
电话
试验用药品名称
中文名称:
英文名称:
药品注册分类及剂型
分类:□中药□化学药□治疗用生物制品□其它注册分类:剂型:
临床研究分类
破盲情况
□未破盲□已破盲(破盲日期:)
SAE报道情况
国内:□有□无□不详;国外:□有□无□不详
SAE发生及处理的详细情况:
报告单位名称:柳州市妇幼保健院报告人职务/职称:报告人签名:
3.疾病:__________治疗药物:__________用法用量:______不良反应史:
相关重要信息(动植物过敏史等):
SAE的医学术语(诊断)
SAE情况
□死亡______年___月___日
□导致住院□延长住院时间□伤残□功能障碍
□导致先天畸形□危及生命□其它
SAE发生时间:_______年___月___日:
研究者获知SAE时间:_______年___月___日:
对试验用药采取的措施
□继续用药□减小剂量□药物暂停后又恢复□停用药物□不适用
SAE转归
□症状消失(后遗症□有□无)□症状持续□死亡
SAE与试验药的关系
□肯定有关□可能有关□可能无关□肯定无关□无法判定
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□临床验证
□生物等效性试验□其他:
临床试验适应症:
受试者基本情况
姓名拼音缩写:
出生日期:
性别:
□男□女
身高(cm):
年龄(岁):
SAE报告表填报指引
性别: □男 □女 身高(cm): 体重(Kg):
受试
者基 合并疾病及治疗:□有 □无
本情 况
1. 疾病:__________ 2. 疾病:__________
治疗药物:__________ 治疗药物:__________
3. 疾病:__________ 治疗药物:__________
5. 研究者判断该 SAE 与试验用药或方法的相关性 6. 其他
“随访/总结报告”应包含但不限于以下信息, 1. 患者入组编号,入组时间和入组临床试验名称(编号),患者诊断 2. 自首次报告后,该 SAE 发生的转归、治疗及相关检查情况 3. 再次评价该 SAE 与试验用药或方法相关性 4. 明确是否恢复试验治疗或退出试验 5. 其他
根据受试者实际状况填写 用法用量:_______________ 用法用量:_______________ 用法用量:_______________
SAE 的医学术语(诊断)
可填 1 个临床诊断,非症状、体征的描述,同时存在多个 AE 应分别报告
□ 死亡 ______年___月___日 SAE 情况(相应项目打勾) □ 导致住院 □延长住院时间 □伤残 □功能障碍
严重不良事件报告表(SAE)
填写报告当日日期
新药临床研究批准文号:(请填写临床试验批件号) 编号:(填写方案编号)
报告类型(打勾)
□首次报告 结报告
□随访报告
□总 报告时
间:
年 月日
医疗机构及专业名称 (请填“中山大学附属第一医院”)
电话:(PI 所在科室电话)
申报单位名称
(请填“申办者或 CRO 名称”)
□继续用药 □减小剂量 □药物暂停后又恢复 □停用药物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
□肯定有关
□可能有关
□可能无关
□肯定无关 □无法判定
(请尽可能根据临床所 (相关性的判断最好由主要研究者 PI 或次要研究者 sub-Investigator 完成) 掌握证据,判断相关性) SAE 报道情况 国内: □有 □无 □不详; 国外: □有 □无 □不详
(请根据研究者手册和既往研究经验进行填写) SAE 发生及处理的详细情况:(参考模板) “首次报告”应包含但不限于以下信息, 1. 患者入组编号,入组时间和入组临床试验名称(编号),患者诊断和既往重要病史或合并疾病 2. 入组后已完成的疗程和发生 SAE 前的末次用药时间 3. 发生 SAE 前的相关症状、体征、程度分级,行相关检查和治疗的情况 4. 确认为 SAE 后的详细救治过程,有助于证实 SAE 严重性的检查结果等 5. 研究者判断该 SAE 与试验用药或方法的相关性 6. 其他
研究者获知 SAE 时间:
(研究者被告知或发现 SAE 的时间,可晚于 SAE 发生的时间)
对试验用药采取的措施 (报告当时对试验药物 采取的措施) SAE 转归 (报告当时 SAE 的转归) SAE 与试验药的关又恢复
□停用药物
□ 症状消失(后遗症
□有
□无)
□症状持续
性别: □男 □女
身高(cm):
体重(Kg):
合并疾病及治疗:□有 1. 疾病:__________ 2. 疾病:__________ 3. 疾病:__________
□无 治疗药物:__________ 治疗药物:__________ 治疗药物:__________
根据受试者实际状况填写 用法用量:_______________ 用法用量:_______________ 用法用量:_______________
SAE 的医学术语(诊断)
可填 1 个临床诊断,非症状、体征的描述,同时存在多个 AE 应分别报告 □ 死亡 ______年___月___日 □延长住院时间 □危及生命 □伤残 □其它 _______年 ___月___日 □功能障碍
SAE 情况 (相应项目打勾) □ 导致住院
□ 导致先天畸形 SAE 发生时间: _______年 (发生 SAE 的具体时间) ___月___日
“随访/总结报告”应包含但不限于以下信息, 1. 患者入组编号,入组时间和入组临床试验名称(编号),患者诊断 2. 自首次报告后,该 SAE 发生的转归、治疗及相关检查情况 3. 再次评价该 SAE 与试验用药或方法相关性 4. 明确是否恢复试验治疗或退出试验 5. 其他
报告单位名称中山大学肿瘤防治中心 报告人职务/职称:如实填写 报告人签名: 首次报告必需由主要研究者签署,如 PI 不在,必需电话告知,并在报告中说明。
严重不良事件报告表(SAE)
新药临床研究批准文号:(请填写临床试验批件号) 编号:(由 SAE 专员填写)
填写报告当日日期
报告类型(打勾) 医疗机构及专业名称 申报单位名称 试验用药品名称
□首次报告 结报告
□随访报告
□总
报告时 间:
年
月
日
(请填“江门市五邑中医院”) (请填“申办者或 CRO 名称”) 中文名称:(试验药物全名) 英文名称:(试验药物全名)
电话:(PI 所在科室电话) 电话:(申办者联系电话)
药品注册分类及剂型
(根据临床试验批件 内容填写)
分类:□中药 □化学药 注册分类:
□治疗用生物制品
□预防用生物制品
□其它
剂型:
临床研究分类
□Ⅰ期 Ⅳ期
□Ⅱ期
□Ⅲ 期 □临床验证
□
临床试验适应症: (受试病种)
□生物等效性试验 姓名拼音缩写: 受试 者基 本情 况 出生日期:
