八年级科学下册第一章:粒子的模型与符号知识点整理
八下科学第一章知识总结
第一章 粒子的模型与符号§第1节 模型、符号的建立与作用1、模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
用符号能简单明了地表示事物,还可避免由于事物外形不同和表达的文字语言不同而引起的混乱。
2、改变温度可以改变物质的状态,这是一种物理变化,这个物理变化的实质就是分子之间的空隙在变化。
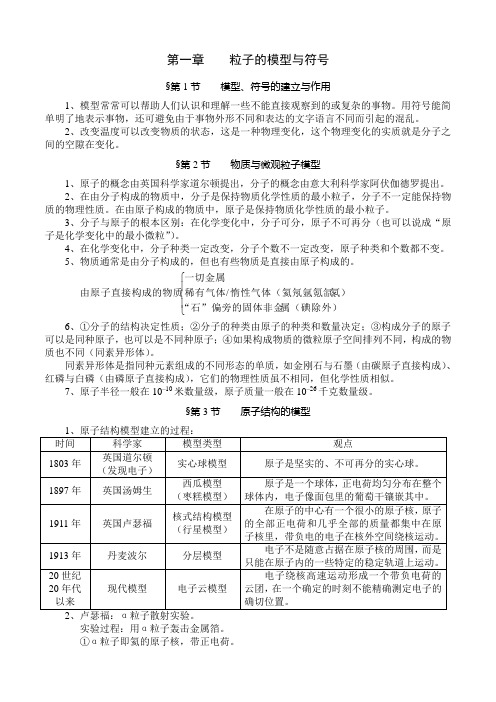
§第2节 物质与微观粒子模型1、原子的概念由英国科学家道尔顿提出,分子的概念由意大利科学家阿伏伽德罗提出。
2、在由分子构成的物质中,分子是保持物质化学性质的最小粒子,分子不一定能保持物质的物理性质。
在由原子构成的物质中,原子是保持物质化学性质的最小粒子。
3、分子与原子的根本区别:在化学变化中,分子可分,原子不可再分(也可以说成“原子是化学变化中的最小微粒”)。
4、在化学变化中,分子种类一定改变,分子个数不一定改变,原子种类和个数都不变。
5、物质通常是由分子构成的,但也有些物质是直接由原子构成的。
⎪⎩⎪⎨⎧属(碘除外)“石”偏旁的固体非金氡)惰性气体(氦氖氩氪氙稀有气体一切金属由原子直接构成的物质/ 6、①分子的结构决定性质;②分子的种类由原子的种类和数量决定;③构成分子的原子可以是同种原子,也可以是不同种原子;④如果构成物质的微粒原子空间排列不同,构成的物质也不同(同素异形体)。
同素异形体是指同种元素组成的不同形态的单质,如金刚石与石墨(由碳原子直接构成)、红磷与白磷(由磷原子直接构成),它们的物理性质虽不相同,但化学性质相似。
7、原子半径一般在10–10米数量级,原子质量一般在10–26千克数量级。
§第3节 原子结构的模型实验过程:用α粒子轰击金属箔。
①α粒子即氦的原子核,带正电荷。
②金属箔由黄金制造。
原因:利用它的延展性使实验效果更明显。
3、研究原子核内部结构的方法:用高能量的粒子撞击、打碎核。
4、原子核由质子和中子构成,质子和中子又是由夸克构成的。
5、原子的结构:⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧中子(不带电荷)质子(带正电荷)原子核核外电子(带负电荷)原子 一个质子所带电量等于一个电子所带电量等于1.6×10–19库仑(即所说的一个单位)。
浙教八年级下册科学知识归纳

八年级下册科学第一章粒子的模型与符号1.速记元素周期表前20元素:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克2. 元素周期表的排列特点:一般每一周期开头的是金属元素,每一周靠近尾部的是非金属元素,每一周结尾的是稀有气体二、元素的符号及分类:①、元素的分类:金属元素:“钅”旁,汞除外;非金属元素:“氵”“石”“气”旁表示其单质在通常状态下存在的状态;稀有气体元素:“气”。
②、元素符号的写法:一大二小的原则:Fe、Cu、Mg、C l、H等。
③、书写常见元素的符号(H、O、C、N、S、Si、Na、Fe、Cu、C l、Ca、Ag、I、K、P)④、元素符号表示的意义:表示一种元素(种类):表示这种元素的一个原子(微粒):(知道一种元素,还可查出该元素的相对原子质量)三、关于化合价的记忆口诀一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。
(二价氧钙镁钡锌)三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷四、元素符号表示的量一、相对原子质量标准:以一个碳12原子的质量的1/12为标准,其他一个原子的质量与之相比的比值。
1个碳原子质量 1.993×10-26千克1/12的碳原子质量 1.661×10-25千克1个氧原子质量 2.657×10-26千克则,氧的相对原子质量为:161个氢原子质量 1.674×10-27千克则,氢的相对原子质量为:1以此类推,也可得出其它的相对原子质量。
*注:相对原子质量的单位符号为“1”,无须表明。
科学八下第一章4-7节 粒子符号模型

粒子符号与模型4-7节一、启发导学、梳理整合1、元素定义:具有相同质子数的一类原子的总称。
分类:(1)金属元素,如:____________。
(2)非金属元素,如:___________。
(3)稀有气体元素,如:__________。
存在形态:(1)单质:由同种元素组成的纯净物。
(游离态)(2)化合物:由不同种元素组成的纯净物。
(化合态)元素符号意义:(1)表示物质。
(直接有原子构成的物质其元素符号才有这个意义)(2)表示一种元素。
(元素属于宏观、不能说“一个元素”)(3)表示一个原子。
(微观含义)2、元素周期表3、化学式:用元素符号表示物质分子组成的式子称化学式。
(1)一种纯净物只有一个化学式,混合物没有化学式(2)化学式中元素符号右下角数字是经过试验测定得出,不能随意改动。
化学式的写法:化合物:(1)氧化物:两种元素组成,其中有一种是氧元素的化合物,氧写在右边;读法:氧化某或几氧化几某(2)氢化物:氢与其它元素组合,一般情况下氢写在左边;读法:某化氢(3)离子化合物:金属元素与非金属元素组成的物质。
写法:其化学式常用其离子最简单整数比表示。
金属左,非金属右。
读法:某化某化学式的意义:4、离子表示方法:在形成离子原子的元素符号右上角标出该离子所带的电荷数。
(1)标在元素符号右上角(“1”省去);(2)先写数字后写正负号。
原子团:由2种以上的原子组成的离子称为某某根离子,是带电的原子团。
如CO 32-称为碳酸根离子。
单质稀有气体:由原子直接构成,用元素符号表示。
如He 、Ne 、Ar 等 金属单质、固态非金属单质:结构复杂,用元素符号表示K 、Ca 、Fe 、Cu 等 C 、Si 、S 、P 等 双原子分子构成的单质:H 2、O 2、Cl 2、F 2、N 2、Br 2、I 2等5、化合价定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。
(化合价是元素的性质,因此,化合价只具有宏观意义。
浙教版八年级科学下册第一章粒子的模型与符号(总结+单元测验+中考题)

浙教版⼋年级科学下册第⼀章粒⼦的模型与符号(总结+单元测验+中考题)浙教版⼋年级科学下册第⼀章粒⼦的模型与符号⼀、知识整理§1.1节模型、符号的建⽴与作⽤1、符号:在⽣活中,我们经常会⽤到⼀些如录⾳机、随⾝听上类似的符号来表⽰事物,我们曾经⽤过的符号有:速度v、时间t、质量m、密度ρ、压强p、电流I、电压U、电阻R、冷锋、暖锋等,你可以对以前的知识进⾏归纳总结。
我们⽣活中,⽤过的符号有:厕所符号、电源符号、交通标志等。
符号的作⽤和意义:⽤符号能简单明了地表⽰事物⽤符号可避免由于外形不同引起的混乱⽤符号可避免表达的⽂字语⾔不同⽽引起的混乱2、模型:建构模型常常可以帮助⼈们认识和理解⼀些不能直接观察的到的事物。
⼀个模型可以是⼀幅图、⼀张表或计算机图像,也可以是⼀个复杂的对象或过程的⽰意。
模型可以表⽰很⼤或很⼩的事物,有些模型可以是具体形象的,⽽有的模型则是抽象的(如⼀个数学或科学的公式)。
§1.2物质与微观粒⼦模型1、分⼦:分⼦是保持物质化学性质的⼀种微粒。
分⼦在化学变化中是可分的,⽽原⼦是不可分的。
在⽔通电实验中,我们发现⽔分⼦变成了氢分⼦和氧分⼦,它们不再保持⽔的化学性质了,该实验充分说明了:⽔分⼦是由两种不同的、更⼩的粒⼦构成的――氢原⼦和氧原⼦;这种⽐分⼦更⼩的微观粒⼦就是原⼦。
2、物质的构成:如右图由原⼦直接构成的物质:⾦属、稀有⽓体、少数⾮⾦属的固体如碳、硅。
3、①原⼦的种类⽐较多,现在已知的有⼏百种原⼦。
不同种类和不同数量的原⼦就能构成各种不同的分⼦,从⽽使⾃然界中有种类繁多的物质。
它们之间的互相组合就好⽐是26个英⽂字母可组合成⽆数个英⽂单词⼀样。
②构成分⼦的原⼦可以是同种原⼦,也可以是不同种原⼦。
③同种原⼦构成不同物质时结构是不⼀样的,如⾦刚⽯和⽯墨。
④原⼦是⼀种微粒,具有⼀定的质量和体积,通常原⼦半径⼀般在10-10⽶数量极,不同种类的原⼦质量不同,体积也不同。
八下科学第一章知识要点

第一章粒子的模型和符号1、构成物质的基本微粒有分子、原子、离子。
①分子是保持物质化学性质的最小粒子②原子是化学变化中的最小粒子③离子是带电的原子或原子团。
2、原子的构成:核电荷数=质子数=核外电子数质子和中子由夸克构成。
原子的质量主要集中在原子核上,所以,一个氯原子和一个氯离子质量几乎相等。
3、元素:具有相同核电荷数的同一类原子的总称。
判断是否为同一元素的标准就是看质子数是否相同。
4、同位素原子:原子中原子核内质子数相同、中子数不相同的同类原子统称为同位素原子。
5、元素分为金属元素、非金属元素(稀有元素)两大类。
目前发现的元素有110多种。
6、元素的分布(识记元素由多到少的顺序)①地壳:O、Si、Al、Fe②人体:O、C、H ③海水:O、H、Cl、Na7、元素周期表中,原子序数=核电荷数=质子数=核外电子数。
在同一族内,各元素的化学性质都很相似。
8、物质的分类:9、在化合物中,氢元素通常显+1价,氧元素通常显-2价。
单质的化合价为零。
在化合物中,各种元素的正负化合价的代数和等于零。
10、元素符号所表示的量①相对原子质量:以C—12质量的1/12作为标准,其它原子的质量跟这个标准的比值。
相对原子质量= 质子数+ 中子数如:钠的相对原子质量为23,质子数为11,则中子数为23-11=12②相对分子质量:一个分子中各原子相对原子质量的总和。
③相关计算:NH4HCO3的相对分子质量=14×1+1×5+12×1+16×3=79N:H:C:O=(14×1):(1×5):(12×1):(16×3)=14:5:12:48NH4HCO3中氮元素的质量分数为:11、水由氢元素和氧元素组成;水由水分子构成;水分子由氢原子和氧原子构成;一个水分子由两个氢原子和一个氧原子构成(把水换成二氧化碳,上面四句话应该怎么表达……)公共邮箱:用户名:tyxxkx密码:kxtyxx。
浙教版初中科学知识点总结(八年级下)

浙教版初中科学知识点总结(八年级下)浙教版科学八下八年级下第一章物质与微观粒子模型1、分子和原子的区别:在化学变化中,分子可分,原子不可再分。
2、化学变化的实质:分子分割成原子,原子重新组合成新的原子。
3、化学变化和物理变化的本质区别:在变化中,物质的分子变为了其它物质的分子,就是化学变化。
在变化中,物质的分子还是原来的分子,只是分子间的距离出现了变化,就是物理变化。
4、分是由原子形成的。
一些气体、液体主要由分子形成5、原子轻易形成的物质:金属和液态非金属及稀有气体原子结构的模型质子(带正电)夸克一、原子的结构:1、原子:原子核:(拎正电)中子(不磁铁)夸克(不显出电性)核外电子:(拎负电)(1)核电荷数=质子数=核外电子数。
(2)质子相同,原子种类一定相同。
原子的质量主要分散在原子核上。
五、带电的原子或原子团--离子【实验】钠在氯气中燃烧的实验实验现象:钠原子丧失电子--构成正电荷的钠离子(阳离子)氯原子获得电子--构成负电荷的氯离子(阴离子)离子就是带电的原子或原子团(离子的组成元素不止一种)。
离子和分子、原子一样也是形成物质的基本粒子。
共同组成物质的元素1、由多种物质组成叫混合物。
由一种物质组成叫纯净物。
纯净物分为单质和化合物:单质:由同种元素共同组成的清澈物。
化合物:由相同种元素共同组成的清澈物。
3、元素在地壳的分布是不均匀的,地壳主要由氧、硅、铝、铁、钙、钠、钾、镁、氢等元素组成。
其中含量最高的是氧,其次是硅。
金属元素中含量最高的是铝,其次是铁。
4、在人体中含量最高的是氧元素,其次是碳、氢;海水中含量多到少:氧、氢、氯、钠。
有机物主要由碳、氢、氧组成则表示元素的符号1、元素符号一般表示:⑴一种元素⑵这种元素的1个原子(3)表物质(由原子直接构成的)表示物质的符号1、化学式的确认依据:由实验测量共同组成,无法凭空想象,一种物质只有一种化学式。
2、化学式则表示的意义:⑴表示某种物质(纯净物)⑵表示物质的元素组成⑶表示某种物质的一个分子由什么原子构成⑷则表示物质分子的形成⑸该物质的相对分子质量就是多少6、离子符号是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数。
科学 八(下) 第一章 粒子的模型与符号

一、分子1.分子的含义:分子是构成物质的一种粒子。
在由分子构成的物质中,分子是保持物质化学性质的最小粒子。
2.分子的性质(1)分子很小。
(2)分子是不断运动的。
(3)分子之间有空隙。
(4)同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
3.用分子观点解释物质变化:物质变化有化学变化和物理变化两种。
若物质由分子构成,分子本身没有发生变化,则属于物理变化;若分子本身发生变化,即变成了其他物质的分子,则属于化学变化。
二、原子1.有些物质由分子构成,而分子又由原子构成。
有些物质则直接由原子构成。
若物质直接由原子构成,则原子是保持物质化学性质的最小粒子。
2.原子是化学变化中的最小粒子,即在化学变化中,分子可以再分成原子。
3. 分子和原子的区别与联系:例1. 200多年前,法国化学家拉瓦锡用定量的方法研究空气的成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气,该反应示意图如图所示:下列说法正确的是()A.氧化汞分解过程中,原子的个数没有发生改变B.氧化汞分解过程中,分子的种类没有发生改变C.氧化汞、汞、氧气都由原子构成D.氧化汞、汞、氧气都由分子构成解析:物质的微观构成:分子可以直接构成物质,原子也可以直接构成物质。
化学变化的微观解释是:反应前是氧化汞分子,反应后变成了汞原子和氧分子,分子的种类发生了变化。
原子个数不变:反应前后,氧原子个数都是2个,汞原子个数也都是2个。
原子种类不变:反应前后,都是氧原子和汞原子。
氧化汞由氧化汞分子构成,汞由汞原子构成,氧气由氧分子构成。
答案: A点拨:本题考查化学变化的微观解释,即构成物质的粒子发生了变化。
一、不同种类的物质1、不同种类和不同数量的原子能构成不同的分子。
2、同种原子可以构成各种结构不同的物质。
3、原子构成分子时结构和种类不同,物质的化学性质也不同。
二、粒子大小与质量1、分子和原子都有一定的质量和体积。
原子的体积很小,原子半径一般在10-10米数量级;原子的质量也非常小,原子的质量的数量级一般在10-26千克。
(完整版)八年级科学下册第一章:粒子的模型与符号知识点整理

粒子的模型与符号一、模型(1)模型的概念:模型是依照实物的形状和结构按比例制成的物品,是用来显示复杂事物或过程的表现手段,如图画、图表、计算机图像等。
(2)模型的分类:①物体的复制品②事物变化的过程③图片④数学公式、表达式或特定的词(3)模型的作用:建立模型能帮助人们理解他们无法直接观察到的事物,如科学家们经常用模型来代表非常庞大或极其微小的事物(太阳系中的行星、细胞的细微结构等)。
[说明]一个模型可以是一幅图、一张表或计算机图像,也可以是一个复杂的对象或过程的示意。
二、符号(1)符号的概念:符号是代表事物的标记。
(2)符号的作用:①能简单明了地表示事物。
②可以避免由于事物外形不同而引起的混乱。
③可以避免由于表达事物的文字语言不同而引起的混乱。
[说明]在某种意义上说符号也是一种模型。
三、化学模型的建立模型可以是实物的模型,一可以是事件的模型,模型能表达出研究对象的基本的特征。
如:(1)人们用水分子结构模型来了解水分子的构成:两个氢原子成104.5°角附在氧原子上:比例模型棍棒模型(2)分子聚集成物质四、分子的构成(1)分子是由原子构成的。
(2)分子构成的描述:以分子A m B n为例,1个A m B n分子由m个A原子和n个B 原子构成。
如1个H2分子由2个H原子构成;1个O2分子由2个O原子构成;1个H2O分子由2个H原子和1个O原子构成。
五、物质的构成⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎩⎨⎧⎩⎨⎧离子构成分子的粒子化学变化中的最小粒子原子粒子化学变化中可以再分的小粒子保持物质化学性质的最分子构成物质的粒子[说明](1)分子是构成物质的一种基本粒子,有的物质是由原子直接构成的,如金属、金刚石、石墨等。
由分子构成的物质在发生物理变化时,物质的分子本身没有变化;由分子构成的物质在发生化学变化时,它的分子起了变化,变成了别的物质的分子。
所以,分子是保持物质化学性质的最小粒子。
同种物质的分子,化学性质相同;不同种物质的分子,化学性质不同,分子不能保持物质的物理性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粒子的模型与符号一、模型(1)模型的概念:模型是依照实物的形状和结构按比例制成的物品,是用来显示复杂事物或过程的表现手段,如图画、图表、计算机图像等。
(2)模型的分类:①物体的复制品②事物变化的过程③图片④数学公式、表达式或特定的词(3)模型的作用:建立模型能帮助人们理解他们无法直接观察到的事物,如科学家们经常用模型来代表非常庞大或极其微小的事物(太阳系中的行星、细胞的细微结构等)。
[说明]一个模型可以是一幅图、一张表或计算机图像,也可以是一个复杂的对象或过程的示意。
二、符号(1)符号的概念:符号是代表事物的标记。
(2)符号的作用:①能简单明了地表示事物。
②可以避免由于事物外形不同而引起的混乱。
③可以避免由于表达事物的文字语言不同而引起的混乱。
[说明]在某种意义上说符号也是一种模型。
三、化学模型的建立模型可以是实物的模型,一可以是事件的模型,模型能表达出研究对象的基本的特征。
如:(1)人们用水分子结构模型来了解水分子的构成:两个氢原子成104.5°角附在氧原子上:比例模型棍棒模型(2)分子聚集成物质四、分子的构成(1)分子是由原子构成的。
(2) 分子构成的描述:以分子A m B n 为例,1个A m B n 分子由m 个A 原子和n 个B原子构成。
如1个H 2分子由2个H 原子构成;1个O 2分子由2个O 原子构成;1个H 2O 分子由2个H 原子和1个O 原子构成。
五、 物质的构成⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎩⎨⎧⎩⎨⎧离子构成分子的粒子化学变化中的最小粒子原子粒子化学变化中可以再分的小粒子保持物质化学性质的最分子构成物质的粒子[说明](1)分子是构成物质的一种基本粒子,有的物质是由原子直接构成的,如金属、金刚石、石墨等。
由分子构成的物质在发生物理变化时,物质的分子本身没有变化;由分子构成的物质在发生化学变化时,它的分子起了变化,变成了别的物质的分子。
所以,分子是保持物质化学性质的最小粒子。
同种物质的分子,化学性质相同;不同种物质的分子,化学性质不同,分子不能保持物质的物理性质。
(2)同种原子构成的物质,由于原子排列不同,可以构成不同的物质。
如金刚石、石墨是由碳原子构成的,足球烯(C 60)是由C 60分子构成的。
金刚石 石墨C 60六、 粒子的大小与质量分子和原子都有一定的质量和体积。
(1) 原子的体积很小,原子半径一般在10-10m 数量级。
(2) 分子和原子的质量也非常小。
氢分子是最轻的分子,其分子质量的数量级是10-27kg 。
(3) 不同种类的分子和原子质量不同,体积也不同。
[说明]组成某个分子的原子,肯定比分子更小,如氢分子由2个氢原子构成,氢原子比氢分子小。
但并不能说原子一定比分子小,某些原子比某些分子大,如铁原子比氢分子大。
(4) 分子的特性:①分子在不断运动;②分子间有间隔。
热胀冷缩就是分子间间隔发生改变的结果。
七、 分子和原子的区别⎪⎩⎪⎨⎧③构成物质的一种离子的粒子②化学变化中可以再分小粒子①保持物质化学性质最分子⎪⎩⎪⎨⎧构成物质的一种粒子构成分子的粒子化学变化中的最小粒子原子[说明]物质由什么粒子直接构成,其化学性质就由该种粒子保持。
八、 区分不同的分子分子是构成物质的一种基本粒子,不同的分子构成不同的物质。
由原子构成分子时: (1) 相同的原子种类,不同的原子个数,能够成不同的分子。
如O 2分子与O 3分子、CO 分子与CO 2分子、SO 2分子与SO 3分子等。
(2) 相同的原子个数,不同的原子种类,也能构成不同的分子。
如H 2与O 2、N 2,H 2O 与CO 2、SO 2,CO 与N 2,SO 3与NH 3等。
[说明]构成分子的原子可以是同种原子(如H 2、O 2、N 2等),也可以是不同种原子(如CO 、H 2O 等)。
九、 化学反应实质、模型的建立当水分子分解时,生成氢原子和氧原子,每两个氢原子又结合成一个氢分子,每两个氧原子结合成一个氧分子。
结论:(1)分子是由原子构成的;(2)物质在发生化学变化时,分子分解成原子,原子重新组合形成新的分子。
在化学变化中,分子是可以再分的,原子是不能再分的,原子是化学变化中的最小粒子。
十、 原子的构成⎪⎪⎩⎪⎪⎨⎧⨯⎪⎩⎪⎨⎧⨯⨯kg101176.9kg 106748.1kg 106726.1131-27-27-质量为核外电子:带负电荷,为中子:不带电荷,质量个单位正电荷,质量为质子:带原子核)原子(X A Z [说明](1) 原子是“空心球体”,原子里有“很大”的空间,电子在绕核做高速运动。
(2) 原子核所带的电量和核外电子的电量相等,但电性相反,因此整个原子不显电性。
对原子而言,核电荷数=质子数=核外电子数。
(3) 一般地,原子核内质子数小于或等于中子数。
(4) 原子的质量主要集中在原子核上。
(5) 质子和中子都是由更微小的基本粒子——夸克构成的。
(6) 原子符号(X AZ )中X ——原子种类,Z ——质子数,A ——质子数与中子数之和。
十一、 元素的概念具有相同核电荷数(即质子数)的一类原子总称为元素。
元素概念中的“一类原子”包括:(1) 质子数相同、中子数不同的同位素原子,如O 168、O 178、O 188。
(2) 质子数相同、化合价不同的元素,如0、+1、+3、+5、+7、-1价的氯元素。
(3) 质子数相同的单核粒子,如Cl -与Cl 原子都属于氯元素。
(4) 元素只论种类,不讲个数。
十二、 同位素原子中核内质子数相同、中子数不同的同类原子统称为同位素。
[说明]元素是同位素原子的总称,同位素原子是一种元素的不同种原子,即原子的“孪生兄弟”。
同位素原子有“三相同三不同”,三相同是:质子数相同、电子数相同、化学性质相同;三不同是:中子数不同、原子质量不同、物理性质不同。
十三、 元素、同位素的比较十四、离子(1)概念:离子是带电荷的原子或原子团。
原子团是“原子的集团”,由几个原子组成,在许多化学反应里作为一个整体参加反应。
(2)分类:① 阳离子:带正电荷;质子数大于电子数。
② 阴离子:带负电荷;质子数小于电子数。
(3)离子也是构成物质的一种基本粒子。
十五、元素与原子的比较十六、原子和离子的比较十七、 应用“四数一量”分析原子结构(1)“四数一量”原子:核电荷数=质子数=核外电子数;近似相对原子质量=质子数+中子数。
①核电荷数”指原子核所带的电荷数,即质子所带电荷数之和。
② 并非所有原子核中都含有中子,如H 11没有中子。
一般地:质子数≤中子数。
③化学变化过程中,原子核不发生变化,即质子数和中子数不发生变化。
(2)分析同位素十八、 元素的存在形式元素的存在形式有两种,即存在于单质或化合物中。
单质:只由同种元素组成的纯净物叫做单质,如氧气、氢气、铜等。
化合物:由两种或两种以上元素组成的纯净物叫做化合物。
如水、二氧化碳等。
氧化物:由两种元素组成,其中一种元素是氧元素的化合物。
[说明]区分单质和化合物是在“纯净物”的前提下,以所含元素是一种或一种以上作为标准去辨识的。
由同种元素形成的不同种单质互称为同素异形体。
如O 2和O 3等。
十九、 元素的种类和分布(1) 已知的元素有110多种,其中有十几种是人造元素。
元素在地壳里的分布量:元素在生物细胞中的分布量:海水中的元素分布:O(85.5%)、H(10.7%),两者约占总量的96.5%;Cl(2.0%),Na、Mg等占1.5%。
(海水中溶解着近80种元素,不仅陆地上的天然元素在海水中几乎都存在,而且有17种元素在陆地上很稀少)(2)人造元素和放射性元素①人造元素:以自然元素为基础,利用核反应的方法,通过用 粒子、氘核、质子或中子对原子核产生作用而人工制造出来的。
②放射性元素:元素周期表中元素符号是红色的是放射性元素,放射性元素对人体有害,但可以用来检查和治疗一些疾病,如用“放疗”治癌症,用X射线检查肺部。
(3)元素的分类:按元素的性质来分,元素可分为金属元素、非金属元素和稀有气体元素,其中金属元素有80多种,占全部元素的4/5。
[说明]通过元素的中文名称可对元素进行简单的分类。
一般有“气”字头(表示单质在常温下是气体),“氵”字旁(表示单质在常温下为液体),“石”字旁(表示单质在常温下为固态)的元素属于非金属元素,而有“钅”字旁的元素属于金属元素(汞也为金属元素)。
二十、单质与化合物概念的区别和联系二十一、描述物质组成的方法与规律物质、元素、分子、原子之间的关系可用图表示。
元素是宏观概念,只有种类之分,没有数量之别。
在讨论物质的组成时,应该用“……由某元素组成”来描述,其中只涉及种类而没有数量多少的含义。
原子、分子、离子是微观的概念,当讨论物质的微观结构时,就应该用原子(或分子、离子)来描述,不仅要讲种类而且要讲个数。
故在讨论物质的组成和结构时,应注意规范地运用这些概念,在具体描述过程中,一般是元素与“组成”匹配,而分子、原子与“构成”匹配。
现举例如下:(1) 由分子构成的物质,有三种说法(以二氧化碳为例):①二氧化碳是由氧元素和碳元素组成的;②二氧化碳是由二氧化碳分子构成的;③每个二氧化碳分子是由2个氧原子和1个碳原子构成的。
(2) 由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:①汞是由汞元素组成的,食盐是由钠元素和氯元素组成的;②汞是由汞原子构成的,食盐是由钠离子和氯离子构成的。
二十二、元素符号及其表示的意义元素符号是表示元素的一种专用符号,国际上采用元素拉丁文名称的第一个字母大写来表示。
当两种元素的第一个大写字母相同时,写上该元素名称的第二个字母(小写)以示区别。
如:Ne (氖)、Na (钠);Mg (镁)、Mn (锰);Cu (铜)、Ca (钙)、Co (钴)。
元素符号表示的意义: (1) 表示一种元素;(2) 表示这种元素的一个原子;(3) 若是由原子直接构成的物质,则表示这种物质。
如:⎩⎨⎧表示一个氢原子。
表示氢元素;H⎪⎩⎪⎨⎧表示碳这种物质。
表示一个碳原子;表示碳元素;C 二十三、元素周期表根据元素的原子结构和性质,把现在已知的110多种元素按原子序数(核电荷数)科学有序地排列起来,得到的表叫做元素周期表。
(1) 在元素周期表中,每一种元素均占据一格。
对于每一格,均包含元素的原子序数(核电荷数)、元素符号、元素名称、相对原子质量等内容。
此外,在周期表中还用不同的颜色对金属元素、非金属元素做了分区。
(2) 周期表每一横行叫做一个周期,共有7个横行,即7个周期。
(3) 周期表有18个纵行,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一族,共有16个族。
二十四、正确书写元素符号并理解其意义正确书写元素符号,熟记27种元素符号。
(1) 由一格字母表示的元素符号要大写。
