【解析】吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷 含解析
吉林省乾安县第七中学高一分班考试化学试卷
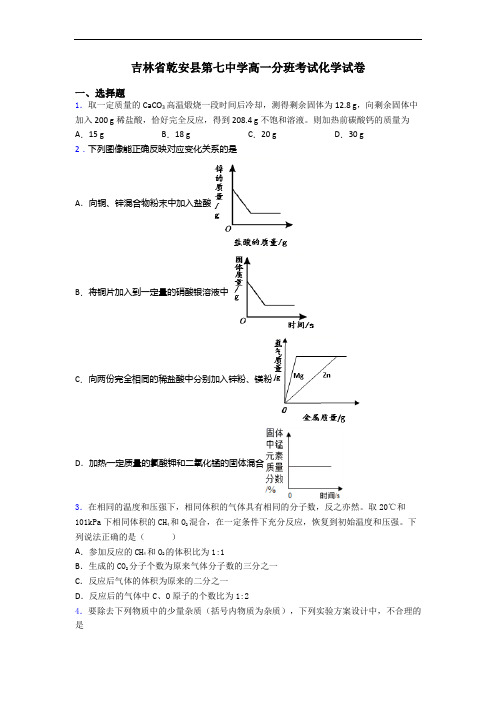
吉林省乾安县第七中学高一分班考试化学试卷一、选择题1.取一定质量的CaCO3高温煅烧一段时间后冷却,测得剩余固体为12.8 g,向剩余固体中加入200 g稀盐酸,恰好完全反应,得到208.4 g不饱和溶液。
则加热前碳酸钙的质量为A.15 g B.18 g C.20 g D.30 g2.下列图像能正确反映对应变化关系的是A.向铜、锌混合物粉末中加入盐酸B.将铜片加入到一定量的硝酸银溶液中C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉D.加热一定质量的氯酸钾和二氧化锰的固体混合3.在相同的温度和压强下,相同体积的气体具有相同的分子数,反之亦然。
取20℃和101kPa下相同体积的CH4和O2混合,在一定条件下充分反应,恢复到初始温度和压强。
下列说法正确的是()A.参加反应的CH4和O2的体积比为1:1B.生成的CO2分子个数为原来气体分子数的三分之一C.反应后气体的体积为原来的二分之一D.反应后的气体中C、O原子的个数比为1:24.要除去下列物质中的少量杂质(括号内物质为杂质),下列实验方案设计中,不合理的是A.KNO3(NaCl):蒸发结晶后,洗涤干燥B.NaCl溶液(Na2SO4):加入适量的BaCl2溶液,过滤C.N2(O2):将气体缓缓通过灼热的铜网D.KCl溶液(K2CO3):加入适量的稀盐酸5.下列图象能正确反映对应变化关系的是A.氧气的溶解度随压强变化的关系B.将等质量的镁片和铁片投入到足量稀硫酸中C.MnO2对过氧化氢溶液分解的影响D.向氢氧化钠溶液中加水稀释A.A B.B C.C D.D6.除去下列各物质中混有少量杂质,所用试剂正确的是选项物质杂质所用试剂A镁粉铁粉稀硫酸B N2O2灼热的铜网C稀盐酸MgCl2KOH溶液D NaCl Na2SO4Ba(NO3)2溶液A.A B.B C.C D.D7.除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是()选项物质(括号内为杂质)试剂操作方法A Fe 粉(CuSO4)加水溶解、过滤、洗涤、干燥B MnO2固体(KC1)加水溶解、过滤、洗涤、干燥C CO2 (H2)足量氧气点燃D KNO3溶液(K2SO4)过量Ba(NO3)2溶液过滤A.A B.B C.C D.D8.下列除杂(括号内为杂质)选用的试剂或方法正确的是 ( ) A.CuO(C):隔绝空气高温加热B.N a2SO4溶液(N a OH):加适量稀盐酸C.CO2(HCl):将气体通入足量的氢氧化钠溶液D.CaCl2溶液(HCl):加入过量碳酸钙,充分反应后过滤9.下列四个图像中,能正确反映对应关系的是A.一定温度下,向一定量水中加入KNO3固体B.加热一定量的高锰酸钾固体C.向一定量的硫酸铜溶液中加入铁粉D.向一定量的MnO2中加入H2O2溶液10.取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.2molH2SO4),恰好完全反应成盐和水.原混合物中氧元素的质量是A.12.8 g B.6.4g C.3.2g D.1.6g11.将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球漂浮在液面上,将几枚洁净的小铁钉投入烧杯中,当不再有气泡逸出时(忽略溶液体积的变化),小球的位置与开始时比较,将()A.下沉一些 B.不变 C.上浮一些 D.无法判断12.除去下列各物质中混有的少量杂质(括号内为杂质),所用试剂及方法不正确...的是A.N2(O2)——将气体通过灼热且足量的Cu粉B.铜粉(CuO)——通入足量的CO气体并加热C.烧碱溶液(Na2CO3)——加入过量的Ca(OH)2溶液,过滤D.CaCl2溶液(盐酸)——加入过量的CaCO3固体,过滤13.向某AgNO3和Fe(NO3)2的混合溶液中加入一定质量的Zn粉,充分反应后过滤,得到滤渣和浅绿色溶液,关于该滤渣和滤液有下列四种说法,其中正确的说法有①向滤渣中加入稀盐酸,一定有气泡产生②滤渣中一定有Ag,可能含有Fe③向滤液中加入稀盐酸,一定有沉淀产生④滤液中一定含有Zn(NO3)2,可能含有Fe(NO3)2和AgNO3A.只有① B.只有② C.只有①②③ D.只有①③④14.实验室使用大理石和盐酸反应制取的CO2是不纯净的,为证明该气体中含有多种物质,所用的试剂及使用顺序正确的是()A.无水硫酸铜、硝酸银溶液、石灰水B.浓硫酸、氢氧化钠溶液、石灰水C.硝酸银溶液、石灰水、无水硫酸铜D.氯化钙、石蕊试液、水15.下列从左到右依次代表ABCD四个图像中,能正确表示对应变化关系的是()A.向氢氧化钠和碳酸钠的混合溶液中滴加盐酸 B.向一定量稀硫酸中加水稀释C.加热等质量的氯酸钾制取氧气 D.向饱和氢氧化钙溶液中加入CaO16.下列各组内物质间的转化关系中,存在不能一步转化的是()A. B.C. D.17.下列有关图像的描述,正确的是()A.加水稀释浓盐酸 B.点燃一定质量的镁带C.一定质量锌粒放入稀硫酸中 D.电解水18.在天平两边的托盘上各放一个盛有某质量分数相同,质量也相同的盐酸的烧杯,此时天平平衡。
吉林省松原市乾安县第七中学2017届高三第一次模拟考试化学试卷 含答案

乾安七中2016—2017学年度高三第一次模拟考试化学试题本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cu 64 S 32 Cl 35。
5 Al 27第I 卷(选择题共60分)一、单选题(本大题20小题,每小题3分,共60分)1.下列表格中各项都正确的一组是( ) 类别选项碱 盐 电解质 非电解质 A烧碱 小苏打 BaSO 4 干冰 B纯碱 CaCO 3 NH 3•H 2O Fe C胆矾 食盐 石墨 醋酸 D KOH CuSO 4 Na 2SO 4 KClO 32.某溶液中只含有Na +、Al 3+、Cl -、SO 42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al 3+和 SO 42-的离子个数比为A .1∶2B .1∶4C .3∶4D .3∶23.设N A 为阿伏加德罗常数,下列叙述中正确的是A .足量铁在氯气中反应,l mol 铁失去的电子数为2 N AB.标准状况下22.4 L H2中含中子数为2 N AC.1 L Imol/L的盐酸溶液中,所含氯化氢分子数为N AD.常温下46 g NO2和N2O4混合气体中含有原子数为3N A4.下列说法正确的是()A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出B.使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干C.用10 mL量筒量取9。
2 mL NaCl溶液D.检验某溶液是否含有SO错误!时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸5.设N A为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22。
4 L的CCl4中含CCl4分子数为N AB.5。
6 g铁和6。
4 g铜分别与0。
1 mol氯气完全反应,转移的电子数相等C.0。
1 mo1·L-1 MgCl2溶液中含Cl-数为0。
2N AD.3。
【精选】吉林省乾安县_高二化学上学期期中试题

2017—2018学年度上学期期中考试高二化学试题第Ⅰ卷(50分)一、选择题(每小题只有一个选项正确。
每小题2分,共20分)1、室温下,0.04 mol/L的硫酸铝钾水溶液的离子积常数(K W)为A. 小于1×10—14B.大于1×10—14C.等于1×10—14D.无法确定2、下列属于强电解质的是A.H2CO3B.Ba(OH)2C.H2SO4溶液D.SO23、某学生的实验报告所列出的下列数据中合理的是A.用10mL量筒量取5.12mL稀盐酸B.用25mL碱式滴定管,中和滴定时用去某浓度碱溶液21.70mLC.用广泛pH试纸测得某溶液pH为12.23D.用托盘天平称量24.20g NaCl4、可逆反应2A+3B 2C+D在四种不同条件下的反应速率分别是A.v (A) 0.5mol/ (L·min) B.v (B) 0.6mol/ (L·min)C.v (C) 0.35mol/ (L·min) D.v (D) 0.4mol/ (L·min)则该反应在不同条件下反应速率最快的是5、有一支50 mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是A. a mLB.(50―a)mLC. 大于(50―a)mLD. 大于a mL6、下列物质在水溶液中的电离方程式方程式书写正确的是A.BaSO4Ba2+ + SO42-B. H2CO3 2H++CO32-C. HF+ H2O F- +H3O+D. NaHSO4 ==Na++HSO4-7、下列溶液肯定呈酸性的是:A .含H+的溶液B.加酚酞显无色的溶液C.pH<7的溶液D.c(OH-)<c(H+)的溶液8、下列组合在任何温度下反应均能自发地进行是A.ΔH<0,ΔS<0B.ΔH>0,ΔS>0C.ΔH<0,ΔS>0D.ΔH>0,ΔS<09、一定温度下,可逆反应2NO2 2NO+O2在恒容密闭容器中反应,①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态;⑦密度不再变化其中达到平衡状态的标志是A.①④⑤⑥B.①②④⑤⑥C.⑥③①⑦D.⑤③①④10、下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是A.(正反应为吸热反应)B.(正反应为放热反应)C.(正反应为放热反应)D.(g)(g)(正反应为吸热反应)二、选择题(每小题只有一个选项正确。
吉林省乾安县第七中学高一化学上学期第一次质量检测试题

乾安七中 2018—— 2019 学年度上学期第一次质量检测高一化学试题本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
考试结束后,只交答题卡,试题自己保存。
满分100分,时间 90分钟。
第I 卷( 60分)一、选择题:(共 20 小题,每题 3 分,共 60 分)1、 1.在自来水蒸馏实验中,以下操作表达不正确的选项是()A.在蒸馏烧瓶中盛约1/3 体积的自来水,并放入几粒碎瓷片B.将温度计水银球插到蒸馏烧瓶中的自来水中C .冷水应从冷凝管下口进,上口出D .采集到的液体取少许滴入硝酸银和稀硝酸,无明展现象2、以以下图,在盛有碘水的三支试管中分别加入苯(密度比水小,不溶于水)、四氯化碳和酒精,振荡后静置,出现以下现象,正确的结论是()A.①加入的是CCl4, ②加苯,③加酒精B.①加入的是酒精② 加CCl4,③加苯C.①加入的是苯②加CCl4③加酒精D .①加入的是苯② 加酒精③加CCl43.以下说法正确的选项是()A.0℃,101 kPa 时, 1 mol O 2和 N2的混淆气体的整体积约为22.4 LB.标准状况下,O2的体积约为22.4 LC.标准状况下,0.5 mol的H2O的体积约为11.2 LD.标准状况下,CO2的气体摩尔体积为22.4 L4.按单质、氧化物、酸、碱、盐分类,以下各组物质中,两种物质类型同样的是()A.氧气、氧化镁B.硫酸铜、氯化钠- 1 -C.硫酸、碳酸钠 D .硝酸银、氢氧化钠5、用托盘天平称取16 克 CuSO?完整溶于水配成1000mlCuSO?溶液,从中拿出10ml, 这 10ml 溶液的物质的量浓度为( )A. 2.5mol/L B.0.1mol/LC . 1mol/L D.1.6mol/L6、以下说法正确的选项是()A.34 g H 2O2中含原子总数为4N AB.2.4 g金属镁变为镁离子时获得的电子数量为0.2N AC. 若气体的摩尔体积为22.4 L/mol,则所处条件必定为标准状况D.摩尔是用来权衡微观粒子多少的一种物理量7、以下图,同样状况下,分别用氯化氢和四种混淆气体吹出体积相等的五个气球。
吉林省乾安县七中2017-2018学年高一上学期第二次月考

乾安七中2017——2018学年度实验班第二次月考试卷高一地理试题本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
考试结束后,只交答题卡,试题自己保留。
满分100分,时间90分钟。
第I卷(60分)一、选择题:(共40小题,每小题1.5分,共60分)1. 下列现象中,可能是受到太阳活动影响的是A. 北极地区出现极昼现象B. 沙尘暴频繁C. 短波收音机声音不清楚D. 南极上空出现臭氧层空洞【答案】C【解析】北极地区出现极昼现象与太阳直射点的移动有关,与太阳活动无关,A错误;沙尘暴与天气系统有关,与太阳活动无关,B错误;太阳活动发生时会扰乱地球电离层,影响无线电短波通讯,C正确;南极上空出现臭氧层空洞的出现与氟氯氢化合物的排放有关,与太阳活动无关,D错误。
故选C。
2. 某地,水平运动的物体向左偏,一年中只有一天太阳直射,该地位于A. 北回归线B. 南纬30ºC. 赤道D. 南回归线【答案】D【解析】水平运动的物体向左偏说明位于南半球,一年中只有一天太阳直射,说明位于回归线上,因此可判断该地位于南回归线。
故选D。
读下图回答下列各题。
3. 如下图所示,甲、乙、丙、丁为地球绕日公转轨道的四等分点,地球从甲处开始绕日公转一周,途中用时最少的是经过A. 甲—乙段B. 乙—丙段C. 丙—丁段D. 丁—甲段4. 当地球位于图示位置时,太阳直射点所处位置及移动方向是A. 北半球,向北移动B. 北半球,向南移动C. 南半球,向北移动D. 南半球,向南移动5. 当地球公转经过乙处时,下列说法正确的是A. 我国北方出现“秋高气爽”的天气B. 正是到南极考察的最佳季节C. 正是我国华北平原冬小麦播种季节D. 北极点附近极昼的范围呈扩大的趋势6. 当地球位于图示位置时,地球上两地A(36゜N,128゜E)和B(36゜S,128゜E)相比A. 自转角速度不同,线速度相同B. 地方时和日出时间都相同C. 日期相同,季节不同D. 两地正午太阳高度相同【答案】3. D 4. C 5. D 6. C【解析】3. 据图,甲、乙、丙、丁为地球绕日公转轨道的四等分点,地球从甲处开始绕日公转一周,每年1月初,地球位于近日点附近,公转速度最快,相等的公转轨道,丁-甲段地球公转速度最快,途中用时最少。
吉林省乾安县第七中学2017-2018学年高一实验班第一次月考化学试题 含解析 精品

吉林省乾安县第七中学2017-2018学年高一实验班第一次月考化学试题可能用到的相对原子质量:H-1 C-12 N-14 O-16Ne-20 Na-23Mg-24S-32Cl-35.5第I卷(60分)一、选择题:(每题3分,共60分)1. 下列实验处理过程不正确...的是( )A. AB. BC. CD. D【答案】B【解析】A、废气中含有有毒气体不能随意排放在空气中,否则造成大气污染,例如SO2、Cl2等气体需要用碱溶液吸收,A正确。
B、废液中常含有酸或者碱及其他有害液体,若直接冲入下水道会引起水污染,需要处理后才可以排放,B错误。
C、废渣中含有不同种类的废弃物,有些可以回收利用,故必须分类回收,C正确。
D、酒精灯着火,可以用细沙盖灭,隔绝空气,达到灭火的目的,D正确。
正确答案为B2. 下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是( )A. 二氧化碳、氮气(澄清石灰水)B. 氯化钠溶液、碳酸钠溶液(稀盐酸)C. 硫酸钾溶液、碳酸钾溶液(氯化钡溶液)D. 盐酸、硝酸溶液(硝酸银溶液)【答案】C【解析】A、CO2通入澄清石灰水变浑浊,而N2通入无明显现象,可以鉴别,A正确。
B、NaCl 与稀盐酸不反应,无明显现象,而Na2CO3与稀盐酸反应产生大量气泡,可以鉴别,B正确。
C、K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl,两者均产生白色沉淀,无法鉴别,C错误。
D、硝酸与硝酸银不反应,无明显现象,而盐酸与硝酸盐反应能产生白色沉淀,变浑浊,可以鉴别,D正确。
正确答案为C3. 在海带灰中提取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。
下列图示对应的装置合理、操作规范的是( )A. AB. BC. CD. D【答案】C【解析】本题以从海带中提取碘为知识载体,考查学生的实验基本操作。
A,灼烧海带,要用到坩埚、泥三角等,不能用蒸发皿,所以A错;B,过滤,从图上看不出问题;C,由于苯的密度比水小,所以有机层在上层,C错;D,蒸馏,利用混合物沸点不同将混合物分离的方法,温度计测量的是蒸气的温度,所以温度计水银球应位于烧瓶支管出口处,D错。
2018-2019学年吉林省乾安县七中高一下学期第一次质量检测化学试题
乾安七中2018—2019学年度下学期第一次质量检测高一化学试题★祝考试顺利★注意事项:1、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
2、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
3、主观题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域的答案一律无效。
如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。
不按以上要求作答无效。
4、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
5、保持卡面清洁,不折叠,不破损,不得使用涂改液、胶带纸、修正带等。
6、考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
可能用到的原子量:H : 1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 Mg:24 Al:27第I卷(60分)一、选择题(每题3分,共60分)1、下列化学用语书写正确的是A.氯原子的结构示意图:B.作为相对原子质量测定标准的碳核素: 14CC.氯化镁的电子式:D.用电子式表示氯化氢分子的形成过程:2、下列不能说明氯的非金属性比硫强的事实是①HCl 比H2S稳定②HCl 和H2S 的水溶液,前者的酸性强③HClO4酸性比H2SO4强④Cl2能与H2S 反应生成S⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子⑥Cl2与Fe 反应生成FeCl3,S与Fe反应生成FeSA.②⑤B.①②C.①②④D.①③⑤3、短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是A.单质的还原性: A>B>D>CB.离子半径: C>D>B>AC.c-a=5D.原子半径: A>B>D>C4、短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a–b),L层电子数为(a+b)。
2017-2018学年吉林省乾安县第七中学高二上学期月考化学试题 解析版
乾安七中2017-2018学年度实验班第一次月考高二化学试题一、选择题1. 可逆反应2A+3B 2C+D该反应在不同条件下反应速率最快的是A. v (A)=0.5mol/ (L·min)B. v (B)=0.6mol/ (L·min)C. v (C)=0.35mol/ (L·min)D. v (D) =0.4mol/ (L·min)【答案】D【解析】试题分析:反应速率的单位要相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快。
反应速率除以对应各物质的化学计量数为:A、0.5mol/(L•min)÷2=0.25mol/(L•min)B、0.6mol/(L•min)÷3=0.2mol/(L•min)C、0.35mol/(L•min)÷2=0.175mol/(L•min)D、0.4mol/(L•min)÷1=0.4mol/(L•min)反应快慢的顺序为:D>A>B>C,所以D最快。
故选D。
考点:反应速率的定量表示方法..................比较反应速率时注意(1)反应速率的单位要相同(2)单位时间内反应物或生成物的物质的量变化大,反应速率不一定快,反应速率是用单位时间内浓度的变化量来表示的。
2. 反应3Fe(s)+4H2O(g) Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是A. 增加Fe的物质的量B. 将容器的体积缩小一半C. 保持体积不变,充入氢气使体系压强增大D. 压强不变,充入Ne使容器的体积增大【答案】A【解析】考查外界条件对反应速率的影响。
铁是固体,改变固体的质量不能改变反应速率,所以选项A正确,其余选项都能改变反应速率,答案选A。
3. 下列说法正确的是A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率【答案】C【解析】试题分析:增大反应物浓度,可增大单位体积内活化分子的数目,但百分数不变,A 错误;有气体参加的化学反应,增大压强,可增大单位体积的活化分子数目,但百分数不变,B错误;升高温度,可增加反应物分子中活化分子的百分数,使反应速率增大,C正确;加入催化剂,降低反应物的活化能,增大活化分子的百分数,反应速率增大,D错误。
吉林省松原市乾安县第七中学2017-2018学年高一上学期期中考试化学试题 Word版含答案
乾安七中2017-2018学年度上学期期中考试高一化学试题考试时间:90分钟总分:100分可能用到的原子量:H-1 O-16 S-32 C-12 Na-23 Cu-64N-14一、选择题(每小题只有一个选项正确。
每小题2分,共20分)1.下列常用实验仪器中,不能直接用于混合物的分离或提纯的是()A.分液漏斗 B.普通漏斗 C.蒸馏烧瓶 D.容量瓶2.下列物质中,能够导电的电解质是()A.Cu丝B.熔融的MgCl2C.NaCl溶液D.蔗糖3.下列实验操作中有错误..的是( )A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出B.实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线C.用淘洗的方法从沙里淘金D.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干4.以下电离方程式错误的是()A.MgCl2===Mg2+ + 2Cl-B.Fe2(SO4)3===2Fe3+ +3SO42-C.NaHCO3===Na+ +H++ CO32- D.KAl(SO4)2===K+ + Al3+ +2SO42-5.在碱性溶液中能大量共存且溶液为无色透明的离子组是()A.K+、MnO4-、Na+、Cl-B.K+、Na+、NO3-、CO32-C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-6.下列叙述正确的是()A.1 mol H2O的质量为18g/molB.标准状况下,1 mol任何物质体积均为22.4LC.3.01×1023个SO2分子的质量为32gD.CH4的摩尔质量为16g7.鉴别SO42-时所选用的试剂及顺序最合理的是()A.稀盐酸、BaCl2溶液B.稀硝酸、BaCl2溶液C.Ba(NO3)2溶液、稀盐酸D.BaCl2溶液、稀盐酸8.氧化还原反应的实质是()A.得氧和失氧 B.化合价的升降C.有无新物质生成 D.电子的转移9.对危险化学品要在包装标签上印有警示性标志。
吉林省乾安县高一化学上学期期中试题
2017——2018学年度上学期期中考试高一化学试题第Ⅰ卷本试卷分第Ⅰ卷(60分)和第Ⅱ卷(40分)总分100分。
答题时间90分钟一、选择题(每小题只有一个选项正确。
每小题2分,共60分1.用N A表示阿伏德罗常数,下列叙述正确的是()A.在 0.5 mol/L 的 AlCl3溶液中,含有 Cl- 个数为1.5 N AB.在常温下,把 100 g CaCO3加到1 L 水中,所得溶液中的 Ca2+数等于N AC.通常状况下,N A个CO2分子占有的体积为 22.4 LD.常温常压下, 1.9 g H3O+所含电子数为N A2.以下是对某水溶液进行离子检验的方法和结论,其中正确的是()A.先加入 BaCl2溶液,再加入足量的 HNO3溶液,产生了白色沉淀。
溶液中一定含有大量的SO42-B.加入足量的 CaCl2溶液,产生了白色沉淀。
溶液中一定含有大量的CO32—C.加入稀盐酸,产生了无色能使澄清石灰水变浑浊的气体,溶液中一定含有大量的 CO32—D.加入足量浓 NaOH 溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的 NH4+3.有NO、CO2、N2O4三种气体,它们都含有相同的氧原子,则三种气体的物质的量之比为( ))A.1:2:4 B.1:1:1 C.4:2:1 D.1:2:44.下列溶液中Cl-的物质的量浓度最大的是()A.200mL 2mol/L MgCl2溶液 B.1000mL 2.5mol/L NaCl溶液C.250mL 1mol/L AlCl3溶液 D.300mL 5mol/L KClO3溶液5.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是()A.所含原子数相等B.气体密度相等C.气体质量相等D.摩尔质量相等6.标准状况下VL氨气溶解在1L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w%,物质的量浓度为cmol·L-1,则下列关系中正确的是()A.ρ=(17V+22400)/(22.4+22.4V)B.w=17c/(1000ρ)C.w=17V/(17V+22400)D.c=1000Vρ/(17V+22400)7.下列事实与胶体的性质无关的是()A.在豆浆里加入盐卤坐豆腐B.河流入海处易形成沙洲C.一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀8.下列说法正确的是()A.碱都是强电解质,酸都是弱电解质B.NH3的水溶液能导电,所以NH3为电解质C.强电解质溶液的导电能力一定大于弱电解质溶液D.CaCO3在水中的溶解性小,但溶解的部分完全电离,故CaCO3是强电解质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷第Ⅰ卷本试卷分第Ⅰ卷(60分)和第Ⅱ卷(40分)总分100分。
答题时间90分钟一、选择题(每小题只有一个选项正确。
每小题2分,共60分1. 用N A表示阿伏德罗常数,下列叙述正确的是()A. 在 0.5 mol/L 的 AlCl3溶液中,含有 Cl- 个数为1.5 N AB. 在常温下,把 100 g CaCO3加到 1 L 水中,所得溶液中的 Ca2+数等于 N AC. 通常状况下,N A个 CO2分子占有的体积为 22.4 LD. 常温常压下, 1.9 g H3O+所含电子数为N A【答案】D【解析】A、只给了溶液的浓度而未给出溶液的体积,所以无法计算Cl-的个数,故A错误;B、CaCO3是难溶物,在水中不能完全溶解,所以把 100 g CaCO3加到 1 L 水中,所得溶液中的 Ca2+数小于 N A,故B错误;C、因题中所给条件不是标准状况,所以无法计算N A个 CO2分子占有的体积,故C错误;D、1个H3O+含有10个电子,1.9g H3O+的物质的量是1.9g÷19g/mol=0.1mol,所含电子的物质的量0.1mol×10=1mol,所以1.9 g H3O+所含电子数为N A,故D正确;此题答案选D。
点睛:阿伏加德罗常数正误判断题在注重对有关计算关系考查的同时,又隐含对某些概念理解的考查,试题计算虽然难度不大,但概念性强,区分度大,具有较强的综合性,符合了目前高考的命题特点。
主要考查物质所含的粒子数目(质子数、中子数、电子数、离子数、电荷数、化学健)、气体摩尔体积、氧化还原反应中电子转移的数目、电解质的电离、物质之间可能发生的反应等,所以在审题时要注意看清题目,注意题目中的隐含条件。
2. 以下是对某水溶液进行离子检验的方法和结论,其中正确的是()A. 先加入 BaCl2溶液,再加入足量的 HNO3溶液,产生了白色沉淀。
溶液中一定含有大量的SO42-B. 加入足量的 CaCl2溶液,产生了白色沉淀。
溶液中一定含有大量的CO32—C. 加入稀盐酸,产生了无色能使澄清石灰水变浑浊的气体,溶液中一定含有大量的 CO32—D. 加入足量浓 NaOH 溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的 NH4+【答案】D【解析】A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中可能含有Ag+,SO32-,所以溶液中不一定含有大量的SO42-,故A错误;B、加入足量的CaCl2溶液,产生了白色沉淀.溶液中含有Ag+也可以生成沉淀,所以溶液中不一定含有大量的CO32-,故B错误;C、加入稀盐酸,产生了无色能使澄清石灰水变浑浊的气体,溶液中可能含有HCO3-、CO32-、SO32-、HSO3-,所以不一定是CO32-,故C错误;D、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味,并能使湿润的红色石蕊试纸变蓝的气体.溶液中一定含有大量的NH4+,符合铵根离子的检验方法,故D正确;此题答案选D。
3. 有NO、CO2、N2O4三种气体,它们都含有相同的氧原子,则三种气体的物质的量之比为A. 1:2:4B. 1:1:1C. 4:2:1D. 1:2:4【答案】C【解析】有NO、CO2、N2O4三种气体,它们都含有相同的氧原子,设氧原子都是1mol,则NO、CO2、N2O4三种气体的物质的量分别为1mol、0.5mol、0.25mol,三者物质的之比为1mol:0.5mol:0.25 mol=4:2:1,故选C。
4. 下列溶液中Cl-的物质的量浓度最大的是()A. 200mL 2mol/L MgCl2溶液B. 1000mL 2.5mol/L NaCl溶液C. 250mL 1mol/L AlCl3溶液D. 300mL 5mol/L KClO3溶液【答案】A【解析】试题分析:A.2mol/L MgCl2溶液中Cl-的物质的量浓度为4mol/L,B.2.5mol/L NaCl 溶液中Cl-的物质的量浓度为2.5mol/L,C.1mol/L AlCl3溶液中Cl-的物质的量浓度为3mol/L,D.5mol/L KClO3溶液中Cl-的物质的量浓度为0mol/L,故选A。
【考点定位】考查物质的量浓度的计算【名师点晴】本题考查物质的量浓度的计算与理解,为高频考点,侧重于学生的分析能力的考查,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度。
根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,如2mol•L-1MgCl2溶液中Cl-物质的量浓度为4mol/L。
5. 如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是()A. 所含原子数相等B. 气体密度相等C. 气体质量相等D. 摩尔质量相等【答案】A【解析】试题解析:同温同压下,气体摩尔体积相等,相同体积的气体,其物质的量相等, A.根据N=nN A知,二者物质的量相等,则其分子数相等,每种分子都含有两个原子,所以其原子总数一定相等,故A正确; B、根据ρ=M/V m;知,气体摩尔体积相等时,其密度之比等于摩尔质量的反比,二者摩尔质量不一定相等,所以其密度不一定相等,B错误; C、根据m=nM知,物质的量相等时,气体质量之比等于其摩尔质量之比,二者摩尔质量不一定相等,所以其质量不一定相等,C错误; D、NO的摩尔质量是个定值,是30g/mol,而混合气体N2和O2的平均摩尔质量M=m/n;由于混合气体的质量m总随着N2和O2所占百分含量的不同而变化,平均摩尔质量M在一个范围内变化,不是一个定值,故M不一定相同,故D错误.考点: 考察阿伏伽德罗定律;6. 标准状况下VL氨气溶解在1L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w%,物质的量浓度为cmol·L-1,则下列关系中正确的是()A. ρ=(17V+22400)/(22.4+22.4V)B. w=17c/(1000ρ)C. w=17V/(17V+22400)D. c=1000Vρ/(17V+22400)【答案】D【解析】A、由ρ=(17V+22400)/(22.4+22.4V)可知,该溶液的密度=,但实际上溶液体积不等于氨气体积与水的体积之和,故A错误;B、由c=可知,w%=17c/(1000ρ)而不是w=17c/(1000ρ),故B错误;C、氨气的物质的量为n(NH3)= =mol,故氨气的质量为mol×17g/mol=g,1L水的质量为1000g,故该溶液的质量分数为w%=()÷(g+1000g)×100%=,故C错误;D、由C分析可知此溶液的质量分数为w%=,故c====,故D正确;此题答案选D7. 下列事实与胶体的性质无关的是()A. 在豆浆里加入盐卤坐豆腐B. 河流入海处易形成沙洲C. 一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路D. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀【答案】D【解析】试题分析:A、豆浆是常见的胶体,加入盐卤,使胶体聚沉,与胶体性质有关,故错误;B、河流含有的泥沙,属于胶体,在入海口遇到电解质,造成胶体聚沉,与胶体性质有关,故错误;C、这是胶体的丁达尔效应,跟胶体有关,故错误;D、发生的是Fe3++3OH-=Fe(OH)3↓,和胶体无关,故正确。
考点:考查胶体的性质等知识。
8. 下列说法正确的是()A. 碱都是强电解质,酸都是弱电解质B. NH3的水溶液能导电,所以NH3为电解质C. 强电解质溶液的导电能力一定大于弱电解质溶液D. CaCO3在水中的溶解性小,但溶解的部分完全电离,故CaCO3是强电解质。
【答案】D【解析】A、电解质的强弱取决于是否完全电离,与化合物类型没有必然关系,如NaOH属于强电解质而NH3·H2O属于弱电解质,H2SO4是强电解质而CH3COOH是弱电解质,故A错误;B、虽然NH3的水溶液能导电但NH3不是电解质,因为不是氨气本身电离出的离子导电,故B错误;C、溶液的导电性取决于溶液中离子浓度大小和离子所带的电荷多少,与强弱电解质没有必然关系,故C错误;D、虽然碳酸钙的溶解度很小,但溶解的碳酸钙能全部电离,完全电离的电解质是强电解质,所以碳酸钙是强电解质,故D正确;故选D。
9. 下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是()A. K+ MnO4-Cl-SO42-B. Na+ K+ Cu2+ Ba2+C. Na+ HCO3-NO3- SO42-D. Na+ SO42- NO3- Cl-【答案】D【解析】碱性溶液中含大量的氢氧根离子。
A、MnO4−是紫色,与无色不符,故A错误;B、Cu2+是蓝色,与无色不符,故B错误;C、碱性溶液中不能大量存在HCO3-,故C错误;D. 碱性溶液中该组离子之间不反应,可大量共存,故D正确;故选D。
点睛:如果离子间能发生复分解反应、氧化还原反应等则不能在溶液中大量共存,在做题时要注意题目中的隐含信息,如“无色”、“酸性”、“一定”、“等物质的量”等。
日常学习中,建议将离子共存和离子反应方程式书写结合一起做好总结,以便提高解题速度和准确度。
10. 能正确表示下列化学反应的离子方程式是()A. 金属铝溶于盐酸中:Al+2H+=Al3++H2↑B. 碳酸镁溶于硝酸中:2H++CO32-=CO2↑+H2OC. 在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2OD. 硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2O【答案】D【解析】A.题中所给离子方程式电荷不守恒,金属铝溶于盐酸中的离子反应为2Al+6H+=2Al3++3H2↑,故A错误;B.碳酸镁难溶于水,在离子反应中应保留化学式,碳酸镁溶于硝酸中的离子反应为2H++MgCO3=CO2↑+H2O+Mg2+,故B错误;C.因通入的CO2过量,反应生成碳酸氢钙,所以在澄清石灰水中通入过量的CO2的离子反应为OH-+CO2=HCO3-,故C错误;D.硫酸氢钠溶液中加入碳酸氢钠溶液的离子反应为H++HCO3-=CO2↑+H2O,故D正确;故选D。
点睛:离子方程式除符合质量守恒外,还应符合电荷守恒,学生往往只注意质量守恒,而忽略电荷守恒,这也经常是命题者设置的“陷阱”;离子方程式的正误判断中,还常常设置物质是否能“拆分陷阱”,氧化物,弱电解质,沉淀等在离子方程式中不能拆分。
在复习时,应熟记常见的弱电解质,溶解度表及常见多元弱酸的酸式酸根。
