铁盐和亚铁盐的鉴别
高一化学【亚铁盐和铁盐的性质】实验报告
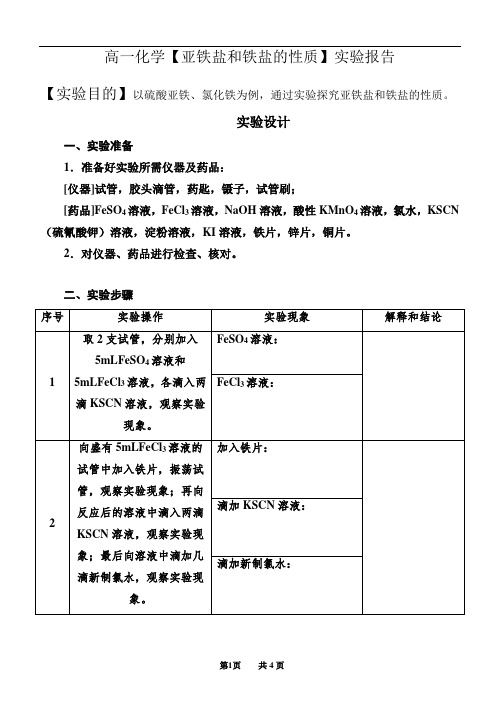
高一化学【亚铁盐和铁盐的性质】实验报告
【实验目的】以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
实验设计
一、实验准备
1.准备好实验所需仪器及药品:
[仪器]试管,胶头滴管,药匙,镊子,试管刷;
[药品]FeSO4溶液,FeCl3溶液,NaOH溶液,酸性KMnO4溶液,氯水,KSCN (硫氰酸钾)溶液,淀粉溶液,KI溶液,铁片,锌片,铜片。
2.对仪器、药品进行检查、核对。
二、实验步骤
注意事项
1.氯水、稀硫酸、酸性KMnO4溶液等具有腐蚀性,取用时应避免沾到皮肤或衣服上,若沾到,应立即用大量清水冲洗;
2.实验1和实验6应注意除铁盐与亚铁盐的区别外,控制其它药品用量均相同;
3.每支试管尽量避免重复使用,若需要重复使用,一定要用蒸馏水清洗干净;
4.实验废液不能随意倾倒,应按照老师的指示倒入指定的废液缸里。
[思考分析]
1.怎样检验溶液中的铁离子和亚铁离子?
2. 氯气、铁盐、亚铁盐的氧化性大小顺序是?酸性KMnO4溶液、铁盐、亚铁盐的氧化性大小顺序是?
实验总结。
第20课铁盐和亚铁盐
02
预习导学
自主梳理
一、Fe3+和 Fe2+的检验方法
FeCl3 溶液中滴加 KSCN 溶液,溶液变红色
FeCl2 溶液中滴加 KSCN 溶液,溶液不变色, 再滴加氯水,溶液变红色
1.滴加 KSCN 溶液,溶液直接变红色,该溶液中含有______。
2.滴加 KSCN 溶液,无明显现象,再加新制氯水溶液变红色,该溶液中含有______。
D.加入铜片
【答案】B
【解析】要想证明某溶液中是否含有 Fe3+,可以向溶液中加入硫氰化钾溶液,若溶液变成红色,证明
溶液中含有铁离子,否则不含铁离子。故选 B 项。
3.(2023 年北京市东城区期末)下列关于 FeCl2 和 FeCl3 的叙述中,不.正.确.的是 A.二者溶液的相互转化均可通过化合反应实现
第 20 课 铁盐和亚铁盐
01
学习目标
1.知道 Fe3+、Fe2+的检验原理、试剂的选择及用显色法检验 Fe2+时试剂加入的顺序。 2.知道 Fe2+的强还原性、Fe3+的强氧化性,能依据氧化还原反应原理选择适当的物质实现两者间的相互转 化。 3.依据氧化还原反应原理理解 Fe、Fe2+、Fe3+的转化关系及应用。
二、铁盐、亚铁盐的性质与转化
Fe3+、Fe2+的相互转化
实验操作
实验现象
加少量铁粉振荡后,溶液变成浅绿色,
向上层清液中滴加新制氯水,
再加 KSCN 溶液,溶液颜色无变化
溶液变成红色
离子方程式 实验结论
2Fe3++Fe=3Fe2+ Fe3+遇到较强的还原剂时,会被还原成 Fe2+
2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe2+在较强氧化剂的作用下会被氧化成 Fe3+
【知识解析】亚铁盐和铁盐

亚铁盐和铁盐亚铁盐:组成中含有Fe2+的盐,如FeCl2、FeSO4·7H2O(绿矾)、(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵或莫尔盐)、Fe(NO3)2等。
铁盐:组成中含有Fe3+的盐,如FeCl3、Fe2(SO4)、Fe(NO3)3等。
3教材P83活动·探究亚铁盐和铁盐的性质方法导引研究物质性质的两个基本角度在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
Fe3+的检验依据Fe3+与SCN-反应使溶液显红色的性质,可以用KSCN溶液检验Fe3+的存在,发生反应的离子方程式为:Fe3++3SCN-===Fe(SCN)3。
1 铁盐的性质【实验目的】以FeCl3为例,通过实验探究铁盐的性质。
【性质预测】【实验试剂】FeCl3溶液,NaOH溶液,KSCN溶液,KI溶液,淀粉溶液,铁粉,铜片。
【实验方案设计及实施】2 亚铁盐的性质【实验目的】以FeSO4为例,通过实验探究亚铁盐的性质。
【性质预测】【实验试剂】FeSO4溶液,酸性KMnO4溶液,氯水,KSCN溶液,NaOH溶液,锌片。
【实验方案设计及实施】教材延伸Fe2+的检验方法可用先加KSCN溶液再加新制氯水的方法检验Fe2+的存在:发生反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3。
检验补铁保健品是否变质的方法补铁剂或补铁片的有效成分是亚铁盐,若补铁片的糖衣破裂,其可能已经变质而失去补铁作用,可以采用研碎、溶解、滴加KSCN溶液的方法检验补铁片是否变质。
名师提醒(1)实验室在配制和保存亚铁盐(Fe2+)时,通常加入铁粉或铁钉,防止Fe2+被氧化成Fe3+。
(2)工业上常用FeCl3溶液腐蚀覆盖在绝缘板上的铜箔制造印刷电路板,发生反应的化学方程式为2FeCl3+Cu===CuCl2+2FeCl2,说明Fe3+的氧化性强于Cu2+。
高考化学一轮复习讲义—铁盐、亚铁盐及相互转化

[复习目标]1.掌握Fe 2+和Fe 3+的检验方法。
2.掌握铁盐、亚铁盐的性质,能实现Fe 2+和Fe 3+的转化高考化学一轮复习讲义—铁盐、亚铁盐及相互转化。
考点一铁盐、亚铁盐的性质与检验1.铁盐与亚铁盐亚铁盐(Fe 2+)铁盐(Fe 3+)颜色浅绿色(溶液)黄色(溶液)氧化性与还原性既有氧化性,又有还原性,以还原性为主,如在酸性条件下能被H 2O 2、NO -3氧化,反应的离子方程式分别为2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O 、3Fe 2++4H ++NO -3===3Fe 3++NO↑+2H 2O 一般表现为氧化性,如能溶解铜,反应的离子方程式为2Fe 3++Cu===Cu 2++2Fe 2+水解性水解呈酸性极易水解,只存在于酸性较强的溶液中2.其他常见铁盐(1)绿矾(FeSO 4·7H 2O):一种重要的还原剂,可用作补血剂及植物的补铁剂。
(2)铁铵矾[NH 4Fe(SO 4)2·12H 2O]:无色晶体,易溶于水,常用作化学分析试剂、药物和织物媒染剂。
(3)赤血盐{K 3[Fe(CN)6]}:红色晶体,能溶于水,常用于检验Fe 2+,生成蓝色沉淀。
(4)高铁酸钾(K 2FeO 4):暗紫色晶体,具有强氧化性,可用作水体的杀菌、消毒剂或高容量电池材料。
3.Fe 2+和Fe 3+的检验(1)(2)(3)含Fe 2+、Fe 3+的混合溶液中Fe 2+、Fe 3+的检验混合溶液――――――→滴加KSCN 溶液溶液变红色,说明含有Fe 3+。
混合溶液――――→滴加酸性KMnO 4溶液酸性KMnO 4溶液紫红色褪去,说明含有Fe 2+。
1.氢氧化铁与HI 溶液仅能发生中和反应()2.中性溶液中可能大量存在Fe 3+、Cl -、K +、SO 2-4()3.酸性条件下H 2O 2氧化Fe 2+的离子方程式为2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O()4.将Fe(NO 3)2样品溶于稀H 2SO 4后,滴加KSCN 溶液,溶液变红,则Fe(NO 3)2晶体已氧化变质()5.用酸性高锰酸钾溶液检验FeCl 3溶液中是否含有FeCl 2()答案 1.× 2.× 3.√ 4.× 5.×一、铁盐、亚铁盐的性质1.铁及其化合物是中学化学中一类重要的物质。
铁盐和亚铁盐PPT课件

②还原性:遇较强氧化剂时被氧化成三价铁的化合物
Fe 2 Br2、Cl2、O2、浓 H2SO4、HNO3等 Fe 3
MnO4 (H )、H2O2、ClO等
例:2Fe2++Cl2=2Fe3++2Cl4Fe2++O2+4H+=4Fe3++2H2O
2020/1/2
15
Fe3+和Fe2+的检验
Fe2+:浅绿色
Fe3+:棕黄色或黄色
加 现象:白色沉淀
NaOH 等碱 溶液
灰绿色 红褐色 现象:红褐色沉淀
Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓ 4Fe(OH)2+O2+2H2O=
4Fe(OH)3
加
KSCN 现象:不变红色,若 现象:变红色 溶液 再通Cl2则变红色 Fe3++3SCN-
FeCl3溶液 FeCl2溶液
滴入KSCN溶液 溶液呈红色 溶液颜色无变化
Fe3++3SCN-=Fe(SCN)3(红色络合物) FeCl2
FeCl3
13
(2)Fe3+和Fe2+的转化
科学探究:在FeCl3溶液中加入足量Fe粉,振荡。再滴 入几滴KSCN溶液,观察现象;在以上所得到的FeCl2 和KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。
与CO反应
不稳定
ቤተ መጻሕፍቲ ባይዱ
稳定
稳定
FeO+2H+= Fe2O3+6H+= Fe3O4+8H+=
亚铁盐和铁盐的检验方法

亚铁盐和铁盐的检验方法亚铁盐和铁盐啊,这可真是化学世界里很有趣的一对“小伙伴”呢!那怎么检验它们呢?嘿,这可得好好说道说道。
咱先说说亚铁盐吧。
你知道吗,亚铁盐就像是个有点害羞的小孩子,不太容易被直接发现。
但是呢,我们有办法让它“现形”!有一种试剂叫高锰酸钾,这玩意儿可厉害啦。
如果往含有亚铁盐的溶液里滴加高锰酸钾溶液,要是溶液的颜色从紫红色变成了无色或者浅粉色,那可就八九不离十,里面有亚铁盐啦!你说神奇不神奇?就好像是给这个害羞的小孩子找到了一个特别的标记一样。
还有啊,亚铁盐遇到铁氰化钾也会有特别的反应哦!会产生一种蓝色的沉淀,就像是天空的颜色一样好看呢。
这就像是给亚铁盐贴上了一个独一无二的“标签”,一下子就能把它认出来啦。
那铁盐呢,它可就没那么“害羞”啦。
铁盐就像是个爱表现的孩子。
比如说硫氰酸钾,这可是铁盐的“好朋友”呢。
只要把硫氰酸钾滴到含有铁盐的溶液里,哇塞,溶液马上就会变成血红色!那颜色,可鲜艳啦,一下子就能让你知道这里面有铁盐。
这就好像是铁盐在大声喊:“嘿,我在这里呢!”咱平时生活里也能碰到和亚铁盐、铁盐有关的事儿呢。
就好比说有些补铁的药品,里面说不定就有亚铁盐或者铁盐。
那我们怎么知道它到底是不是有效的呢?这时候检验方法不就派上用场啦!要是能准确检验出来,那我们用起来也放心呀,对吧?你想想看,如果没有这些检验方法,那我们岂不是对这些物质一无所知,就像在黑暗中摸索一样。
但有了它们,就好像点亮了一盏明灯,让我们能清楚地看到它们的存在和特点。
所以啊,学会这些亚铁盐和铁盐的检验方法,真的很重要呢!它能让我们更好地了解和利用这些化学物质,就像拥有了一把打开化学世界大门的钥匙。
我们可以通过这些方法去探索、去发现更多有趣的化学现象和规律。
这难道不是一件超级棒的事情吗?难道你不想掌握这些神奇的检验方法,去感受化学的魅力吗?赶紧行动起来吧!让我们一起在化学的海洋里畅游,发现更多的精彩!。
课件1:3.1.2铁盐和亚铁盐

【思考·讨论】 (1)利用离子间的转化分析,怎样除去FeCl3溶液中含有的FeCl2 杂质? 提示:向混合溶液中加足量氯水或H2O2或通入足量Cl2。
(2)根据Fe2+的性质分析,实验室中应该怎样保存亚铁盐溶液? 提示:向亚铁盐溶液中加入铁粉,防止Fe2+被氧化。
【案例示范】 【典例】(2019·济南高一检测)已知A是一种常见金属,F是一 种红褐色沉淀。试根据图中转化关系,回答下列问题。
为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;(2)D为FeCl3, 含有的阳离子为Fe3+,检验Fe3+的方法为取少量D溶液于试管中,滴加
几滴KSCN溶液,若溶液变红色,证明有Fe3+;(3)FeCl2易被空气中的
氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧化;(4)①A→C反
第三章 铁 金属材料
第一节 铁及其化合物 第2课时 铁盐和亚铁盐
一、Fe2+和Fe3+的检验 红色
红色
【巧判断】 (1)用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 ( ) 提示:×。Cl-也能使酸性KMnO4溶液褪色。
(2)检验绿矾晶体(FeSO4·7H2O)是否已氧化变质,可将绿矾晶体 溶于稀硫酸后滴加KSCN溶液,再观察溶液是否变红( ) 提示:√。如果绿矾变质,会生成Fe3+,滴加KSCN溶液会变红色。
【情境·思考】化学老师在课堂上演示了一个“血手印”魔术。 预先在手上喷上KSCN溶液,然后印在白纸上晾干。用FeCl3溶 液喷洒白纸,白纸立刻出现红色血手印。 这个现象与FeCl3的性质有什么关系?有什么用途?
提示:该魔术利用了Fe3+与SCN-结合生成红色 Fe(SCN)3,该现象可用于Fe3+的检验。
鲁科版高一化学必修一同步精选对点训练:铁盐和亚铁盐的检验

铁盐和亚铁盐的检验1.要检验久置的FeSO4溶液中是否含有Fe2(SO4)3,应选用的试剂是()A. NH4SCN溶液B. KI溶液C.氨水D. Fe粉2.向某溶液中加入几滴KSCN溶液,溶液不变色;再向该溶液中继续通入Cl2,溶液变红色。
关于原溶液下列说法正确的是()A.一定有Fe3+B.一定有Fe2+C.可能有Fe3+D.不可能有Fe2+3.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是()A. NaOHB. KMnO4C. KSCND.铁4.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是()A.依次滴加氯水和硫氰酸钾溶液后,溶液显红色B.先滴加硫氰酸钾溶液,不显红色,再滴加氯水后显红色C.通入氨气,产生白色沉淀,无红褐色沉淀D.加入锌片,片刻取出,质量减轻;加入铜片,片刻取出,质量不变5.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时,最佳顺序为()①加入足量氯水②加入足量酸性KMnO4溶液③加入少量NH4SCN溶液A.①③B.③②C.③①D.①②③6.下列有关物质检验方法不合理的是()A.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2C.检验绿矾晶体是否已氧化变质,可将绿矾晶体溶于稀H2SO4后滴加KSCN溶液,再观察溶液是否变红D.向某溶液中加入NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+7.下列有关离子检验的叙述正确的是()A. Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+B.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+C.向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
说明溶液中一定含有Fe2+D.某铁的氧化物溶于盐酸中,然后滴加KSCN溶液,溶液变红色,则此铁的氧化物一定是Fe2O3 8.有NaCl、FeCl2、FeCl3、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是() A.盐酸B.烧碱溶液C. AgNO3溶液D. KSCN溶液9.为了检验某溶液中是否含有Fe3+,可向溶液中加入的试剂是()A.氯化钠溶液B.氨水C.硫氰化钾溶液D.石蕊试液10.某物质溶于盐酸后,再向溶液中滴加硫氰化钾溶液,结果溶液颜色无变化,然后加入新制氯水,溶液呈红色,则这种物质是()A.氯化铁B.氯化亚铁C.氢氧化铁D.四氧化三铁11.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是()A.先滴加氯水,再滴加硫氰化钾溶液后显血红色B.先滴加硫氰化钾溶液,不显血红色,再滴加氯水后显血红色C.滴加氢氧化钠溶液,先产生白色沉淀,后变灰绿,最后呈红褐色D.只需滴加硫氰化钾溶液12.证明某溶液中不含Fe3+而可能含有Fe2+的实验操作如下:①加入足量新制氯水,②加入足量酸性高锰酸钾溶液,③加入少量硫氰化铵溶液,④加入氢氧化钠溶液。
