糖化白蛋白测定试剂盒(酶法)产品技术要求haomai
糖化血红蛋白测定试剂盒(荧光免疫层析法)产品技术要求

糖化血红蛋白测定试剂盒(荧光免疫层析法)组成:每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样本缓冲液及1个校准信息卡。
不同批号试剂盒中各组分不可互换。
预期用途:用于体外定量测定人全血中糖化血红蛋白(HbA1c)的百分比含量。
2.1外观1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2装量样本缓冲液装量偏差应不大于±10%。
2.3宽度试纸条宽度为4.0±0.2mm。
2.4移行速度液体移行速度不低于10mm/min。
2.5空白限试剂盒的空白限不大于3%。
2.6线性在[3,15]% 范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度[8,12]%、低浓度[4,6]%两水平样本重复测定10次,其测定值的变异系数(CV)应不大于10%。
2.8准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性取不含HbA1c的样本,加入以下物质平行检测3次,结果均应不大于3%。
表1 特异性2.10溯源性根据GB/T21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.11批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于10%。
2.12 稳定性原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8,2.9项,结果应符合各项目的要求。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求lepu

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量测定人血清中的糖化血红蛋白的含量。
1.1 规格试剂1:30mL×1,试剂2a:9.5mL×1, 试剂2b:0.5mL×1,前处理液:50mL×2;试剂1:12mL×1,试剂2:4 mL×1;试剂1:60mL×3,试剂2:60mL×3;试剂1:60mL×1,试剂2:20mL×1;试剂1a:16.8mL×1,试剂1b:7.2mL×1,试剂2:10mL×1,前处理液:30mL×1;试剂1a:33mL×2,试剂1b:14.1mL×2,试剂2:19mL×2,前处理液:60mL×2;试剂1a:15.4mL×1,试剂1b:6.6mL×1,试剂2:8mL×1,前处理液:30mL×1;试剂1a:15mL×1,试剂1b:5mL×1,试剂2:5.5mL×1,前处理液:20mL×1;试剂1a:3.5mL×3,试剂1b:4.0mL×1,试剂2:3.5mL×2,前处理液:15mL×1;试剂1a:3.5mL×6,试剂1b:4.0mL×2,试剂2:3.5mL×4,前处理液:15mL×2。
1.2主要组成成份试剂1主要成分:试剂2a主要成分:试剂2b主要组分:前处理液主要成分:2.1 外观试剂1:无色透明溶液;试剂2:无色透明溶液;前处理液:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在660nm处测定试剂空白吸光度,应≤1.5;2.4 分析灵敏度测试6%的被测物时,吸光度变化(ΔA)应≥0.020。
糖化白蛋白测定试剂盒(酶法)产品技术要求meigaoyi

糖化白蛋白测定试剂盒(酶法)适用范围:用于体外定量检测人体血清样本中糖化白蛋白的含量。
1.1包装规格a)糖化白蛋白: 试剂1:1×40ml,试剂2:1×10ml;白蛋白: 试剂1:1×40ml,试剂2:1×20ml;b)糖化白蛋白: 试剂1:2×40ml,试剂2:2×10ml;白蛋白: 试剂1:2×40ml,试剂2:2×20ml。
1.2主要组成成分糖化白蛋白试剂1主要组分:糖化白蛋白试剂2主要组分:白蛋白试剂1主要组分:白蛋白试剂2主要组分:2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 糖化白蛋白:试剂1应为无色澄清液体,试剂2应为无色或淡黄色液体,无沉淀、无悬浮物、无絮状物。
2.1.3 白蛋白:试剂1应为无色或淡黄色液体,试剂2应为无色或淡黄色液体,无沉淀、无悬浮物、无絮状物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度2.3.1 糖化白蛋白试剂空白吸光度≤0.3。
2.3.2 白蛋白试剂空白吸光度≤0.5。
2.4 分析灵敏度2.4.1 糖化白蛋白浓度为1.5g/dl时,其吸光度变化在0.0200~0.0900之间。
2.4.2 白蛋白浓度为4.0g/dl时,其吸光度变化在0.3000~1.0000之间。
2.5 准确性与比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,样本浓度在[3.2,69]%范围内,其相关系数(r)不小于0.975;测定浓度在[3.2,20)%范围内绝对偏差不超过±3%;测定浓度在[20,69]%范围内相对偏差不超过±15%。
2.6 重复性重复测定糖化白蛋白比值正常值和高值样品,变异系数(CV%)应不大于10%。
2.7 线性2.7.1在[3.2,69]%范围内,线性相关系数r应不低于0.990;2.7.2 在[3.2,20)%范围内绝对偏差不超过±3%;20,69]%范围内相对偏差不超过±15%。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求shijiwode
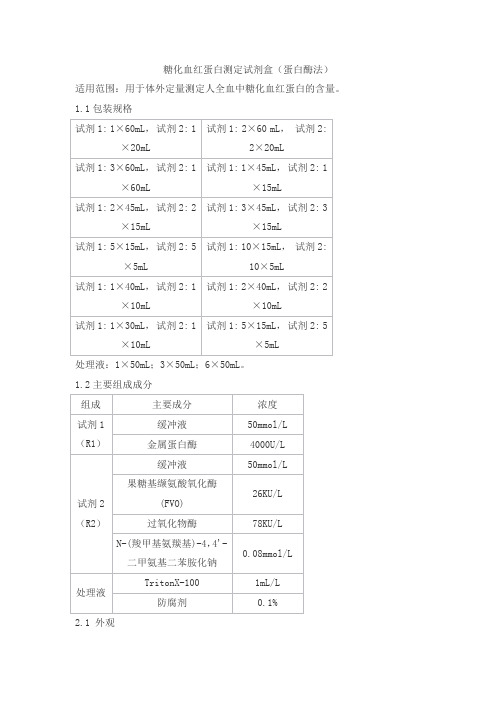
糖化血红蛋白测定试剂盒(蛋白酶法)
适用范围:用于体外定量测定人全血中糖化血红蛋白的含量。
1.1包装规格
处理液:1×50mL;3×50mL;6×50mL。
1.2主要组成成分
2.1 外观
试剂1为无色或浅黄色澄清液体,试剂2为黄色或黄绿色液体,处理液为无色液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
在700nm处测定试剂空白吸光度≤1.5。
2.4 分析灵敏度
测试5.0%的被测物时,吸光度变化(ΔA)≥0.0019。
2.5 准确度
检测三个水平国家标准物质(GBW09181、GBW09182、GBW09183)中的任两个水平,分别重复检测3次,检测值与标示值相对偏差不超过±10%。
2.6 线性
2.6.1在[1.8,12]%区间内,线性相关系数r≥0.990;
2.6.2在[1.8,
3.5]%区间内,线性绝对偏差不超过±0.35%;(3.5,12]%区间内,线性相对偏差不超过±10%。
2.7 重复性
检测高、中、低三个浓度水平的样本,变异系数CV不大于10%。
2.8 批间差
随机抽取三批试剂盒对同一份样品进行重复测定,相对极差不超过±10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)产品技术要求sainuopu

糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)适用范围:用于体外定量测定人体血清中糖化血清蛋白的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:1×8L,试剂2:1×2L;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×1ml,2×1ml(单水平),1×3ml,2×3ml(单水平)。
质控品(选配,冻干品):1×1ml,1×3ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色至浅红黄色液体;试剂2:无色至浅红黄色液体。
校准品:冻干品,溶解后为无色至淡黄色液体。
质控品:冻干品,溶解后为无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.1。
2.4 分析灵敏度测定浓度为600μmol/L的样本时,吸光度变化值(ΔA)应不小于0.05。
2.5 线性范围在(50,1000)μmol/L范围内,线性相关系数r不小于0.996。
在(150,1000)μmol/L范围内的线性相对偏差不大于±10%;在(50,150]μmol/L范围内线性绝对偏差不大于±15.0 μmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求senmeixikema

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量检测全血中糖化血红蛋白的浓度。
1.1规格a) 试剂1:1×30ml,试剂2:1×10ml,前处理液:1×90ml;b) 试剂1:2×45ml,试剂2:2×15ml,前处理液:3×90ml;c) 试剂1:2×16.8ml,试剂2:2×5.6ml,前处理液:1×100ml;d) 试剂1:2×150ml,试剂2:2×50ml,前处理液:8×100ml;e) 试剂1:2×30ml,试剂2:1×10ml,前处理液:1×90ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液;前处理液应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1在600nm处测定试剂空白吸光度,应<1.5;2.3.2在700nm处测定试剂1和试剂2混合后的空白吸光度,应<1.5。
2.4 分析灵敏度2.4.1 测定HbA1c浓度为 800ml/dl的样品,吸光度变化(ΔA)应不低于0.03;2.4.2 测定Hb浓度为1000mg/dL的样品,吸光度变化(ΔA)应不低于0.05。
2.5 线性2.5.1在[3%,16%]范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[6%,16%]的样品,相对偏差应不超过±15%;测试浓度[3%,6%) 的样品,绝对偏差应不超过±0.9%。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度用国家标准物质[BW3625、GBW09181、GBW09182任选一种]对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±10%。
糖化血红蛋白(HbA1c)测定试剂盒(酶法)产品技术要求上泰

1.性能指标1.1外观外观应符合以下要求:a)试剂盒应组分齐全,完整,液体无渗漏;包装标签文字符号应清晰。
b)样本处理夜:无色液体。
c)试剂1(R1):淡黄色至黄色液体。
d)试剂2(R2):黄色至棕黄色液体。
e)校准品/质控品:红色冻干粉。
1.2装量液体试剂装量要求不低于标示量。
1.3分析灵敏度测试浓度为6%的样本时,吸光度差值△A 应≥0.020。
1.4线性范围1.4.1 糖化血红蛋白浓度在[4,12]%范围内,线性相关系数r≥0.990。
1.4.2 在[4,5] %范围内,线性绝对偏差应不超过±0.5%;在(5,12]%范围内,线性相对偏差应不超过±10%。
1.5精密度1.5.1日间重复性测试两个不同浓度水平的样本,变异系数CV 结果均应≤3%。
1.5.2日内重复性测试两个不同浓度水平的样本,变异系数CV 结果均应≤3%。
1.6批间差三个不同批号试剂盒测试相同样本,相对极差R 应≤10%。
1.7准确度相对偏差应不超过±10%。
1.8分析特异性当胆红素≤15mg/dL、脂肪乳≤0.5%、葡萄糖≤4000mg/dL、抗坏血酸≤12mg/dL、血红蛋白≤2.1g/dL、尿酸≤30mg/dL,尿素≤80mg/dL,类风湿因子≤200IU/mL、氰酸钠≤3000mg/dL、阿司匹林≤3000mg/dL 时,对HbA1c 试剂检测结果的偏差影响在±10%以内。
1.9校准品/质控品水分含量水分含量应不超过5%。
1.10校准品正确度量值传递的正确度应符合E≤1。
n1.11质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.12校准品/质控品均匀性应不大于8%。
1.12.1瓶内均匀性:CV瓶内应不大于10%。
1.12.2瓶间均匀性:CV瓶间1.13校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
糖化白蛋白测定试剂盒(酶法)产品技术要求

糖化白蛋白测定试剂盒(酶法)结构组成:试剂1:糖化氨基酸氧化酶 5.00KU/L3-羟基-2,4,6-三碘苯甲酸(HTIB) 10mmol/L过氧化物酶 50KU/L试剂2:蛋白酶200KU/L4-氨基安替比林(4AAP) 10mmol/L试剂3:柠檬酸缓冲液(pH4.2) 30mmol/L溴甲酚绿(BCG) 0.25mmol/L校准品(冻干粉):Tris缓冲液,30mmol/L,人血清(含量≥5%),糖化白蛋白目标浓度13 g/L,白蛋白目标浓度42.5g/L,批特异,具体浓度见瓶签;质控品(冻干粉):Tris缓冲液,30mmol/L,人血清(含量≥5%),质控品靶值范围:糖化白蛋白水平1:4g/L~8g/L,水平2:10g/L~15g/L,白蛋白35g/L~50g/L,批特异,具体浓度见瓶签。
预期用途:用于体外定量测定人血清中糖化白蛋白和白蛋白测量浓度的比值。
2.1外观试剂1:无色至淡黄色澄清液体;试剂2:淡黄色至淡红色澄清液体;试剂3:黄绿色澄清液体;校准品:冻干粉,复溶后为无色或淡黄色液体;质控品:冻干粉,复溶后为无色或淡黄色液体。
2.2装量液体成分应不少于标示值。
2.3试剂空白吸光度2.3.1糖化白蛋白试剂空白吸光度说明书规定的测量波长(光径1cm)处,试剂空白吸光度应不大于0.30。
2.3.2白蛋白试剂空白吸光度说明书规定的测量波长(光径1cm)处,试剂空白吸光度应不大于1.00。
2.4分析灵敏度2.4.1糖化白蛋白分析灵敏度测试浓度为15g/L样本,所引起的吸光度差值在0.02~0.20范围内。
2.4.2白蛋白分析灵敏度测试浓度为40g/L样本,所引起的吸光度差值在0.02~1.00范围内。
2.5准确度2.5.1糖化白蛋白准确度用已上市试剂盒和本公司试剂盒同时测试至少40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990,斜率应在[0.9,1.1]内;[3.5,14.0]g/L区间内绝对偏差不超过±1.4g/L,(14.0,30.0]g/L区间内相对偏差应不超过±10%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
糖化白蛋白测定试剂盒(酶法)
适用范围:本试剂盒用于体外定量测定人血清或血浆中糖化白蛋白(GA)的含量。
1.产品型号/规格及其划分说明
试剂盒是由糖化白蛋白试剂和白蛋白试剂组成的液体试剂。
规格见表1。
表1 规
格
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
糖化白蛋白试剂1为无色至淡黄色液体,糖化白蛋白试剂2为无色至淡黄色液体。
白蛋白试剂1为无色至淡黄色液体,白蛋白试剂2为淡褐色至淡绿色液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量
用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白
糖化白蛋白:在546nm处测定试剂空白吸光度,应<0.6A。
白蛋白:在600nm处测定试剂空白吸光度,应<0.6A。
2.4 分析灵敏度
糖化白蛋白:测试0.626g/dl的被测物时,吸光度差值变化△A为(0.01~0.30)。
白蛋白:测试4.4g/dl的被测物时,吸光度差值变化△A为(0.11~0.49)。
2.5 准确性
参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在(3.2,5.8]%范围内绝对偏差不超过±2%;(5.8,68)%范围内相对偏差不超过±15%。
2.6 重复性
用不同浓度的两个样本进行检测,各重复检测20次,其批内变异系数(CV)应小于5%。
2.7 线性
2.7.1在(
3.2,68)%范围内,线性相关系数r应不低于0.990;
2.7.2 在(
3.2,5.8]%范围内绝对偏差不超过±2%;(5.8,68)%范围内相对偏差不超过±15%。
2.8 批间差
用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应小于15%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取到效期后的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
